探究钠及其化合物的性质,请按要求填空:
(1)Na、Na2O、Na2O2、NaOH置空气中最终都是变为_______ (填化学式)。
(2)Na投入MgCl2溶液中发生反应的化学方程式有________ ,_______ 。
(3)常温常压下制取100mL纯净的CO2,将其通入装有Na2O2粉末的两通玻璃管中。
①反应的化学方程式为________ 。
②若反应后收集的气体体积为65mL,则反应消耗CO2的体积是_______ mL。
(4)现有一种以NaHCO3为主要成分的膨松剂,由于膨松剂存放时间较长,部分分解成Na2CO3粉末。为测定混合样品中NaHCO3的质量分数,按如图所示连接装置(装置的气密性良好,各装置中的试剂皆为足量)。
实验过程:将样品m1g装入样品管B,测定实验前D的质量m2g;打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,以除去装置中的二氧化碳;然后关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为_________ 。
拆下装置,再次称量D的质量m3g
①E处干燥管中盛放碱石灰的作用是________ 。
②混合物中NaHCO3的质量分数为________ (用含m1、m2、m3的代数式表示)。
(1)Na、Na2O、Na2O2、NaOH置空气中最终都是变为
(2)Na投入MgCl2溶液中发生反应的化学方程式有
(3)常温常压下制取100mL纯净的CO2,将其通入装有Na2O2粉末的两通玻璃管中。
①反应的化学方程式为
②若反应后收集的气体体积为65mL,则反应消耗CO2的体积是
(4)现有一种以NaHCO3为主要成分的膨松剂,由于膨松剂存放时间较长,部分分解成Na2CO3粉末。为测定混合样品中NaHCO3的质量分数,按如图所示连接装置(装置的气密性良好,各装置中的试剂皆为足量)。
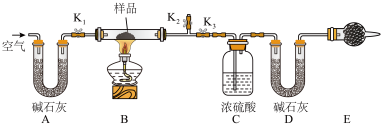
实验过程:将样品m1g装入样品管B,测定实验前D的质量m2g;打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,以除去装置中的二氧化碳;然后关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为
拆下装置,再次称量D的质量m3g
①E处干燥管中盛放碱石灰的作用是
②混合物中NaHCO3的质量分数为
更新时间:2023-10-05 13:25:36
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】 、CuCl是重要的化工原料,常用来作为有机合成的催化剂。实验室常用如下装置来制备
、CuCl是重要的化工原料,常用来作为有机合成的催化剂。实验室常用如下装置来制备 。
。

已知: 易潮解;CuCl不溶于乙醇和稀盐酸;
易潮解;CuCl不溶于乙醇和稀盐酸; 在酸性条件下被还原成
在酸性条件下被还原成 。
。
Ⅰ. 的制备
的制备
(1)实验开始时需要先打开A装置中分液漏斗活塞滴加浓盐酸,一段时间后再点燃D处酒精灯,目的是___________ 。
(2)装置A中发生反应的化学方程式是___________ ;该反应氧化剂与还原剂的物质的量之比为___________ 。
(3)B装置所盛试剂为___________ ;E装置的作用是___________ 。
Ⅱ.CuCl的制备
将上述实验制得的粉末加水溶解,滴加少量稀盐酸,向溶液中通入适量的 气体,加热即可得到白色沉淀,将过滤后的白色沉淀用乙醇洗涤2~3次后,干燥即可得到CuCl晶体。
气体,加热即可得到白色沉淀,将过滤后的白色沉淀用乙醇洗涤2~3次后,干燥即可得到CuCl晶体。
(4)加少量盐酸的作用是___________ 。
(5)用 和
和 ,制备CuCl的离子方程式为
,制备CuCl的离子方程式为___________ 。
(6)用乙醇洗而不用水洗的原因是___________ 。
 、CuCl是重要的化工原料,常用来作为有机合成的催化剂。实验室常用如下装置来制备
、CuCl是重要的化工原料,常用来作为有机合成的催化剂。实验室常用如下装置来制备 。
。
已知:
 易潮解;CuCl不溶于乙醇和稀盐酸;
易潮解;CuCl不溶于乙醇和稀盐酸; 在酸性条件下被还原成
在酸性条件下被还原成 。
。Ⅰ.
 的制备
的制备(1)实验开始时需要先打开A装置中分液漏斗活塞滴加浓盐酸,一段时间后再点燃D处酒精灯,目的是
(2)装置A中发生反应的化学方程式是
(3)B装置所盛试剂为
Ⅱ.CuCl的制备
将上述实验制得的粉末加水溶解,滴加少量稀盐酸,向溶液中通入适量的
 气体,加热即可得到白色沉淀,将过滤后的白色沉淀用乙醇洗涤2~3次后,干燥即可得到CuCl晶体。
气体,加热即可得到白色沉淀,将过滤后的白色沉淀用乙醇洗涤2~3次后,干燥即可得到CuCl晶体。(4)加少量盐酸的作用是
(5)用
 和
和 ,制备CuCl的离子方程式为
,制备CuCl的离子方程式为(6)用乙醇洗而不用水洗的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
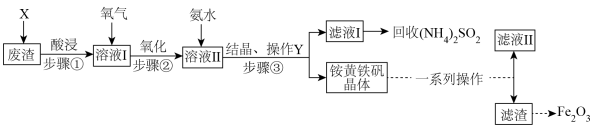
【推荐2】工业上利用废渣[ 、
、 及少量CaO和MgO]制备高档颜料铁红(主要成分为
及少量CaO和MgO]制备高档颜料铁红(主要成分为 )和回收
)和回收 。具体生产流程如下:
。具体生产流程如下:
【背景信息】a.氧化步骤中会有元素化合价发生变化。
b.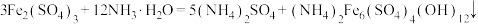 (铵黄铁矾晶体)。
(铵黄铁矾晶体)。
(1)步骤③中“操作Y”的名称是_______ ,必须用到的玻璃仪器有_______ 。
(2)加入物质X溶解废渣,X应选用_______(填标号)。
(3)步骤①“酸浸”时,生成盐的化学方程式为_______ (任写一个)。
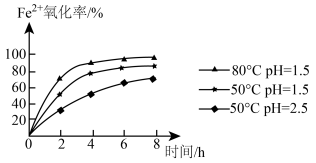
(4)用离子方程式表示步骤②通入氧气氧化的目的:_______ 。工业上该操作的时间一般控制在4小时左右为宜,根据如图有关数据分析 氧化率[
氧化率[ 氧化率=
氧化率=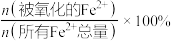 ]的变化规律:
]的变化规律:_______ 。
(5)“滤液Ⅱ”中溶质的主要成分是_______ (填化学式)。
 、
、 及少量CaO和MgO]制备高档颜料铁红(主要成分为
及少量CaO和MgO]制备高档颜料铁红(主要成分为 )和回收
)和回收 。具体生产流程如下:
。具体生产流程如下:
【背景信息】a.氧化步骤中会有元素化合价发生变化。
b.
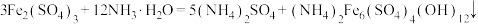 (铵黄铁矾晶体)。
(铵黄铁矾晶体)。(1)步骤③中“操作Y”的名称是
(2)加入物质X溶解废渣,X应选用_______(填标号)。
| A.盐酸 | B.硫酸 | C.氨水 | D.氢氧化钠 |
(4)用离子方程式表示步骤②通入氧气氧化的目的:
 氧化率[
氧化率[ 氧化率=
氧化率=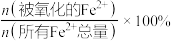 ]的变化规律:
]的变化规律:
(5)“滤液Ⅱ”中溶质的主要成分是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以饱和食盐水、NH3、CO2为原料先制得NaHCO3,进而生产出纯碱。回答下列问题:
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

(1)装置甲中用稀盐酸与CaCO3反应制备CO2,发现CaCO3与试管内的稀盐酸不能接触,在加稀盐酸时,发现试剂瓶中的稀盐酸已用完,为使反应能顺利进行,可向长颈漏斗中加入的试剂是______________ 。
A.H2SO4溶液 B.CCl4 C.苯 D.稀硝酸
(2)乙装置中的试剂是______________ ;丁装置中稀硫酸的作用是______________ 。
(3)另一位同学用图中戊装置(其他装置未画出)进行实验。实验时,须先从______________ 管通入 __________ 气体。
(4)有同学建议在戊装置的b管下端连接己装置,理由是______________ 。
(5)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g 水):
参照表中数据,请分析丙、戊装置中使用冷却水或者冰水的原因:______________ 。
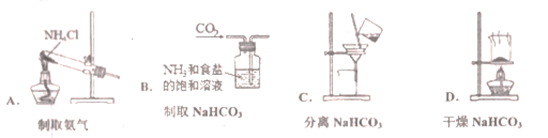
(6)根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是______________ 。
(7)该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行下图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是______________ (填字母)。
a.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为______________ 。
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

(1)装置甲中用稀盐酸与CaCO3反应制备CO2,发现CaCO3与试管内的稀盐酸不能接触,在加稀盐酸时,发现试剂瓶中的稀盐酸已用完,为使反应能顺利进行,可向长颈漏斗中加入的试剂是
A.H2SO4溶液 B.CCl4 C.苯 D.稀硝酸
(2)乙装置中的试剂是
(3)另一位同学用图中戊装置(其他装置未画出)进行实验。实验时,须先从
(4)有同学建议在戊装置的b管下端连接己装置,理由是
(5)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g 水):
| 0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ | 50 ℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
(6)根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是

(7)该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行下图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是
a.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题:
(1)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再产生CO2气体为止,在此过程中,溶液中的碳酸氢根离子浓度的变化是___________。
(2)有含21.2gNa2CO3和含10.95gHCl的两种溶液中:①将Na2CO3溶液逐滴加入HCl溶液中;②将HCl溶液逐滴加入Na2CO3溶液中。①②两种操作生成的CO2的质量之比为___________ 。
(3)已知固体混合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成。请通过计算和推理完成下列各小题:
①取A与足量的盐酸反应:若固体混合物A的质量m(A)为定值,生成气体的量为定值,则A的可能组成是(填写化学式):___________ 、___________ ;___________ 、___________ ;(可以不填满)
②若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清石灰水生成的沉淀均为10.0g,则混合固体A中碳元素的总质量是___________ g。
(1)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再产生CO2气体为止,在此过程中,溶液中的碳酸氢根离子浓度的变化是___________。
| A.先变大后变小 | B.先变小后变大 | C.一直变小 | D.保持不变 |
(3)已知固体混合物A由NaHCO3、KHCO3、MgCO3、CaCO3四种物质中的两种混合而成。请通过计算和推理完成下列各小题:
①取A与足量的盐酸反应:若固体混合物A的质量m(A)为定值,生成气体的量为定值,则A的可能组成是(填写化学式):
②若先将A加热,剩余固体再与足量的盐酸反应,且先后两次产生的气体分别通过足量的澄清石灰水生成的沉淀均为10.0g,则混合固体A中碳元素的总质量是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】草酸(H2C2O4)是一种常用的化工原料,能形成多种化合物,其中草酸钠是一种常用的化工还原剂,草酸钙可用于陶瓷上釉等,回答下列问题:
(1)Na2C2O4溶液显_______ 性(填“酸性”“中性”或“碱性”)。
(2)某同学用酸性KMnO4溶液滴定含杂质的Na2C2O4测定样品的纯度(已知杂质不参与反应),实验步骤如下:
准确称取1.0g Na2C2O4固体样品,配成100mL溶液,取出20.00mL于锥形瓶中,再向锥形瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。(发生反应的离子方程式为2 +5
+5 +16H+═10CO2↑+2Mn2++8H2O)
+16H+═10CO2↑+2Mn2++8H2O)
①高锰酸钾溶液应装在_______ 滴定管中,滴定至终点时的实验现象是_______ 。
②下列操作可能使测量结果偏低的是_______ 。
a.盛装Na2C2O4的滴定管没润洗 b.称取的Na2C2O4样品部分含有结晶水
c.读数时滴定前俯视,滴定后仰视 d.滴定结束后滴定管尖端悬有一滴溶液
③计算样品中Na2C2O4的纯度:_______ 。
(3)CaC2O4是五种肾结石里最为常见的一种,患草酸钙结石的病人多饮白开水有利于结石的消融,请用必要的化学原理和简要的文字说明其原因:_______ 。
(1)Na2C2O4溶液显
(2)某同学用酸性KMnO4溶液滴定含杂质的Na2C2O4测定样品的纯度(已知杂质不参与反应),实验步骤如下:
准确称取1.0g Na2C2O4固体样品,配成100mL溶液,取出20.00mL于锥形瓶中,再向锥形瓶中加入足量稀H2SO4溶液,用0.016mol/L高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。(发生反应的离子方程式为2
 +5
+5 +16H+═10CO2↑+2Mn2++8H2O)
+16H+═10CO2↑+2Mn2++8H2O)①高锰酸钾溶液应装在
②下列操作可能使测量结果偏低的是
a.盛装Na2C2O4的滴定管没润洗 b.称取的Na2C2O4样品部分含有结晶水
c.读数时滴定前俯视,滴定后仰视 d.滴定结束后滴定管尖端悬有一滴溶液
③计算样品中Na2C2O4的纯度:
(3)CaC2O4是五种肾结石里最为常见的一种,患草酸钙结石的病人多饮白开水有利于结石的消融,请用必要的化学原理和简要的文字说明其原因:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】为测定某Na2SO3样品(含少量Na2SO4杂质)的纯度,实验室按以下步骤进行;①称取ag样品,置于烧杯中;②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:

请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的的仪器是E和______ (填字母);
(2)在方法一④中加入过量稀盐酸的目的是________________________________ ;
(3)在方法一测定得到Na2SO3样品的纯度是_______________ (列出算式,可不化简);
(4)在方法二中,是否需要加入指示剂_______ (填“是”或“否”),请简述理由________ ;
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果________________________
(填“偏高”、“偏低”、“无影响”)。
然后,可采用下列两种方法进行测定:
| 方法一 | 方法二 |
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量BaCl2溶液,充分搅拌,使沉淀完全; ⑥过滤、洗涤、干燥沉淀、称量得到bg固体。 | ④将25.00mL溶液置于锥形瓶中; ⑤用0.1 mol/L的酸性KMnO4溶液进行滴定,达到滴定终点时,消耗10.00mL溶液。 |

请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的的仪器是E和
(2)在方法一④中加入过量稀盐酸的目的是
(3)在方法一测定得到Na2SO3样品的纯度是
(4)在方法二中,是否需要加入指示剂
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果
(填“偏高”、“偏低”、“无影响”)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】三氧化二钴(Co2O3)是重要的化工原料。用含钴废料(主要成分为Co2O3,含少量SiO2、NiO、Fe2O3等)制备Co2O3的流程如下图:

已知:“滤液1”中含有的阳离子有H+、Co2+、Fe3+、Ni2+。
(1)“滤渣1”的主要成分是_______ (写化学式)。
(2)“酸浸”时,H2O2可将Co2O3还原为Co2+,离子方程式为_______ 。
(3)“调pH”时,常温下,为保证“滤液1”中Fe3+完全沉淀,需调节“滤液1”的pH的最小值为_______ 。(已知:溶液中离子浓度小于1×10-5mol·L-1,则认为离子完全沉淀;Fe(OH)3的Ksp为1×10-38)
(4)加入有机萃取剂的目的是_______ 。
(5)由“滤液2”可得到的主要副产品是_______ (写化学式)。
(6)“沉钴”过程中,生成Co2(OH)2CO3的离子方程式为_______ 。

已知:“滤液1”中含有的阳离子有H+、Co2+、Fe3+、Ni2+。
(1)“滤渣1”的主要成分是
(2)“酸浸”时,H2O2可将Co2O3还原为Co2+,离子方程式为
(3)“调pH”时,常温下,为保证“滤液1”中Fe3+完全沉淀,需调节“滤液1”的pH的最小值为
(4)加入有机萃取剂的目的是
(5)由“滤液2”可得到的主要副产品是
(6)“沉钴”过程中,生成Co2(OH)2CO3的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】亚硝酸钙是一种重要的化工原料,可作为水泥添加剂,防锈剂等。某兴趣小组拟利用以下装置制备Ca(NO2)2并测定产品的纯度(夹持及加热装置略)。
已知:①Ca(OH)2+NO+NO2=Ca(NO2)2+H2O
②2Ca(OH)2+4NO2=Ca(NO2)2+Ca(NO3)2+2H2O
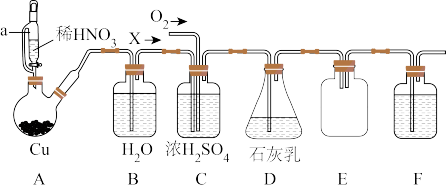
(1)仪器a的名称是____ ,B的作用是____ ,F中盛放的试剂是____ 。
(2)A中发生反应的离子方程式为____ 。
(3)C中通入的O2的量应为X的 ,若
,若 <
< ,会导致
,会导致____ ;若 >
> ,会导致
,会导致____ 。
(4)实验中可通过调节气体X流速来控制其与O2通入量的比,调节流速的方法有____ (任答一种)。
(5)充分反应后,经分离提纯得到Ca(NO2)2,设计如下方案测定产品中Ca(NO2)2的纯度(杂质不参与以下反应):准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,加入过量的c1mol·L-1的KI溶液、淀粉溶液,然后滴加稀硫酸,用c2mol·L-1的Na2S2O3溶液滴定,平行滴定3次,平均消耗VmL的Na2S2O3溶液。
(在酸性条件下:2NO +4H++2I-=2NO↑+I2+2H2O,I2+2S2O
+4H++2I-=2NO↑+I2+2H2O,I2+2S2O =2I-+S4O
=2I-+S4O )
)
①滴定至终点的现象是____ 。
②Ca(NO2)2的纯度为____ 。
已知:①Ca(OH)2+NO+NO2=Ca(NO2)2+H2O
②2Ca(OH)2+4NO2=Ca(NO2)2+Ca(NO3)2+2H2O

(1)仪器a的名称是
(2)A中发生反应的离子方程式为
(3)C中通入的O2的量应为X的
 ,若
,若 <
< ,会导致
,会导致 >
> ,会导致
,会导致(4)实验中可通过调节气体X流速来控制其与O2通入量的比,调节流速的方法有
(5)充分反应后,经分离提纯得到Ca(NO2)2,设计如下方案测定产品中Ca(NO2)2的纯度(杂质不参与以下反应):准确称取mgCa(NO2)2样品放入锥形瓶中,加适量水溶解,加入过量的c1mol·L-1的KI溶液、淀粉溶液,然后滴加稀硫酸,用c2mol·L-1的Na2S2O3溶液滴定,平行滴定3次,平均消耗VmL的Na2S2O3溶液。
(在酸性条件下:2NO
 +4H++2I-=2NO↑+I2+2H2O,I2+2S2O
+4H++2I-=2NO↑+I2+2H2O,I2+2S2O =2I-+S4O
=2I-+S4O )
)①滴定至终点的现象是
②Ca(NO2)2的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素的氧化物)制备,工艺如下图所示。回答下列问题:

相关金属离子[c0(Mn2+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和___________ ;写出“溶浸”中二氧化锰与硫化锰反应的离子方程式___________ 。
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化,离子方程式为___________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为___________ 之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是___________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是___________ 。
(6)写出“沉锰”的离子方程式___________ 。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4,当x=y= 时,z=
时,z=___________ 。

相关金属离子[c0(Mn2+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化,离子方程式为
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4,当x=y=
 时,z=
时,z=
您最近一年使用:0次



