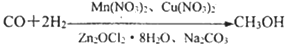下表为周期表的一部分,其中的编号代表对应的元素。请回答下列问题:
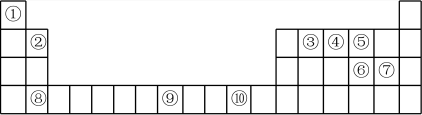
(1)表中属于d区的元素是_____ (填序号)。
(2)写出元素⑨的基态原子的核外电子排布式_____ ,元素⑩的价电子轨道表示式_____ 。
(3)表中所给元素中,原子半径最大的是_____ (填元素符号),元素⑥、⑦形成的简单离子半径更小的是_____ (填离子符号)。
(4)下列关于元素③、④分别与①形成的简单化合物的叙述正确的是_____(填序号)。
(5)元素④、⑤的第一电离更大的是_____ (填元素符号)。
(6)元素②与元素⑦形成的分子的空间结构为_____ 。

(1)表中属于d区的元素是
(2)写出元素⑨的基态原子的核外电子排布式
(3)表中所给元素中,原子半径最大的是
(4)下列关于元素③、④分别与①形成的简单化合物的叙述正确的是_____(填序号)。
| A.中心原子的价层电子对数相同 |
| B.中心原子的杂化方式不同 |
| C.分子的VSEPR模型相同,空间结构也相同 |
| D.④与①形成的分子的键角比③与①形成的分子的键角更大 |
(5)元素④、⑤的第一电离更大的是
(6)元素②与元素⑦形成的分子的空间结构为
更新时间:2023-12-12 09:33:23
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】铝及其化合物在日常生活、工业上有广泛的应用。
(1)研究表明26Al可以衰变为26Mg,下列可以比较这两种元素金属性强弱的方法是_______。
(2)国产C919飞机外壳应用了铝合金材料。下列铝合金的性质与该应用无关的是_______
(3)Al2O3、MgO和SiO2都可以制耐火材料,其原因是_______。
(4)工业上用电解Al2O3的方法获得铝单质,若反应中有0.6mol电子转移,则在_______ 极(选填“阴”或“阳”)可得金属铝的质量为_______ 克。
(5)氢氧化铝是用量最大、应用最广的无机阻燃添加剂,解释氢氧化铝能做阻燃剂的原因_______ (用化学方程式结合简明语言说明)。
(6)AlN是一种高性能陶瓷材料,高碳热还原制备AlN的总反应化学方程式为(未配平):
_______Al2O3(s)+_______C(s)+_______N2(g) _______AlN(s)+_______CO(g)
_______AlN(s)+_______CO(g)
①配平化学方程式,并标出电子转移数目和方向_____ 。
②上述反应中,部分元素原子可形成具有相同电子层结构的简单离子,这些简单离子的半径由大到小的顺序是_______ 。
(7)已知AlN遇水缓慢水解,生成白色沉淀和能使湿润的红色石蕊试纸变蓝的气体。为回收AlN中的铝元素,工业常在90℃下对AlN进行水解,对应化学反应方程式为_______ ;采用90℃代替常温进行水解的理由是_______ 。
(8)达喜是常用中和胃酸的药物。其主要成分是铝和镁的碱式盐[(Al)a(Mg)b(OH)c(CO3)d]。取一定量该碱式盐,加入1.0mol·L-1盐酸使其溶解,当加入盐酸85mL时开始产生CO2,加入盐酸至90mL时正好反应完全,该样品中氢氧根与碳酸根的物质的量之比为_______ 。
(1)研究表明26Al可以衰变为26Mg,下列可以比较这两种元素金属性强弱的方法是_______。
| A.比较这两种元素的单质的硬度和熔点 |
| B.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液 |
| C.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液 |
| D.将空气中放置已久的这两种元素的单质分别和热水作用 |
| A.密度小 | B.能导电 | C.抗腐蚀性能强 | D.硬度大 |
| A.Al2O3、MgO和SiO2都不溶于水 | B.Al2O3、MgO和SiO2都是白色固体 |
| C.Al2O3、MgO和SiO2都是氧化物 | D.Al2O3、MgO和SiO2都有很高的熔点 |
(5)氢氧化铝是用量最大、应用最广的无机阻燃添加剂,解释氢氧化铝能做阻燃剂的原因
(6)AlN是一种高性能陶瓷材料,高碳热还原制备AlN的总反应化学方程式为(未配平):
_______Al2O3(s)+_______C(s)+_______N2(g)
 _______AlN(s)+_______CO(g)
_______AlN(s)+_______CO(g)①配平化学方程式,并标出电子转移数目和方向
②上述反应中,部分元素原子可形成具有相同电子层结构的简单离子,这些简单离子的半径由大到小的顺序是
(7)已知AlN遇水缓慢水解,生成白色沉淀和能使湿润的红色石蕊试纸变蓝的气体。为回收AlN中的铝元素,工业常在90℃下对AlN进行水解,对应化学反应方程式为
(8)达喜是常用中和胃酸的药物。其主要成分是铝和镁的碱式盐[(Al)a(Mg)b(OH)c(CO3)d]。取一定量该碱式盐,加入1.0mol·L-1盐酸使其溶解,当加入盐酸85mL时开始产生CO2,加入盐酸至90mL时正好反应完全,该样品中氢氧根与碳酸根的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】硅材料在生活中占有重要地位。请回答:
(1)Si(NH2)4分子的空间结构(以Si为中心)名称为___________ 。
(2)由硅原子核形成的三种微粒,电子排布式分别为:①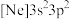 、②
、②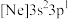 、③
、③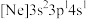 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是___________ ,该化合物的化学式为___________ 。
(1)Si(NH2)4分子的空间结构(以Si为中心)名称为
(2)由硅原子核形成的三种微粒,电子排布式分别为:①
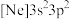 、②
、②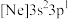 、③
、③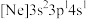 ,有关这些微粒的叙述,正确的是___________。
,有关这些微粒的叙述,正确的是___________。| A.微粒半径:③>①>② |
| B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ |
| D.得电子能力:①>② |
(3)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是

您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】粉煤灰是燃煤电厂的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为38%,还有含量较多的SiO2。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4,有关化学反应方程式:Al6Si2O13+3Na2CO3=2NaAlSiO4+4NaAlO2+3CO2↑,结合上述反应完成填空:
(1)Na2CO3中所含化学键的类型是______ ,SiO2属于______ 晶体。
(2)在上述反应所涉及的元素中,原子核外电子数最多的元素在周期表中的位置是______ 。
(3)上述元素中有三种元素在元素周期表中处于相邻位置,其原子半径从大到小的顺序为______ 。(用元素符号表示)。
(4)二氧化碳分子的结构式为_______ 。
(5)上述元素中有两种元素位于同一主族,可以作为判断两者非金属性强弱的依据的是_____ (填编号)。
a.该两种原子形成的共价键中共用电子对的偏向 b.最高价氧化物熔沸点高低
c.最高价氧化物对应水化物的酸性强弱 d.单质与酸反应的难易程度
(1)Na2CO3中所含化学键的类型是
(2)在上述反应所涉及的元素中,原子核外电子数最多的元素在周期表中的位置是
(3)上述元素中有三种元素在元素周期表中处于相邻位置,其原子半径从大到小的顺序为
(4)二氧化碳分子的结构式为
(5)上述元素中有两种元素位于同一主族,可以作为判断两者非金属性强弱的依据的是
a.该两种原子形成的共价键中共用电子对的偏向 b.最高价氧化物熔沸点高低
c.最高价氧化物对应水化物的酸性强弱 d.单质与酸反应的难易程度
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】如图是s能级和p能级的电子云轮廓图,试回答问题。
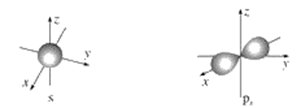
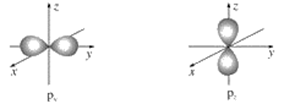
(1)s电子云轮廓图呈________ 形,每个s能级有________ 个原子轨道;p电子云轮廓图呈________ 状,每个p能级有________ 个原子轨道,其能量关系为____________ (填“相同”或“不相同”)。
(2)元素X的原子最外层的电子排布式为nsnnpn+1,原子中能量最高的是________ 电子;元素X的名称是____ ,它的氢化物的电子式是________ 。
(3)若元素Y的原子最外层的电子排布式为nsn-1npn+1,那么Y的元素符号应为________ ,原子的电子排布图为______________________________ 。
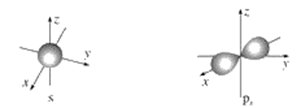
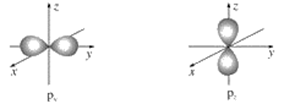
(1)s电子云轮廓图呈
(2)元素X的原子最外层的电子排布式为nsnnpn+1,原子中能量最高的是
(3)若元素Y的原子最外层的电子排布式为nsn-1npn+1,那么Y的元素符号应为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】科学家们锲而不舍地努力,揭示了原子结构的奥秘,知道了原子核外电子的排布决定元素在周期表中的位置。
Ⅰ.请回答下列问题
(1)下列分子中,所有原子都满足最外层为8电子结构的是_________
(2)下列对分子性质的解释中,正确的是_________
(3)关于氢键,下列说法正确的是_________
Ⅱ.氮及其化合物在自然界中存在循环,请回答下列问题:
(4)基态氮原子核外电子共占据___________ 个轨道,最外层有___________ 种不同能量的电子。
(5)NH3中心原子为___________ 杂化,N2的电子式为___________ 。
(6)在催化剂和加热条件下,NO2与NH3可反应生成无害物质,请写出反应的化学方程式:___________ 。
(7)实验室可用烧碱溶液吸收NO2和NO,(已知2NO2+2NaOH=NaNO2+NaNO3+H2O,NO2+NO+2NaOH=2NaNO2+H2O),当消耗100mL 0.5mol·L-1的烧碱溶液时,共吸收混合气体___________ L(标准状况下)。
(8)NH4Fe(SO4)2用作工业废水的凝结剂,为检验其中的铁元素可选用的方法是___________ 。相同条件下,0.1mol/L NH4Fe(SO4)2中[Fe3+]___________ 0.1mol/L FeCl3中[Fe3+](填“=”、“<”或“>”)。
Ⅰ.请回答下列问题
(1)下列分子中,所有原子都满足最外层为8电子结构的是_________
| A.CH4 | B.XeF2 | C.BF3 | D.NF3 |
A.乳酸(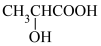 )具有光学活性,因为其分子中含有一个手性碳原子 )具有光学活性,因为其分子中含有一个手性碳原子 |
| B.NH3极易溶于水而CH4难溶于水只是因为NH3是极性分子,CH4是非极性分子 |
| C.水很稳定(1000°C以上才会部分分解)是因为水分子间存在大量的氢键 |
| D.已知酸性:H3PO4>HClO,因为H3PO4的氧原子数大于HClO的氧原子数 |
A.因为氢键的缘故,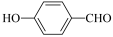 比 比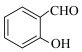 熔沸点高 熔沸点高 |
| B.分子中有N、O、F原子,分子间就存在氢键 |
| C.NH3的稳定性很强,是因为其分子间能形成氢键 |
| D.“可燃冰”—甲烷水合物(CH4·8H2O)中CH4与H2O之间不存在氢键 |
Ⅱ.氮及其化合物在自然界中存在循环,请回答下列问题:
(4)基态氮原子核外电子共占据
(5)NH3中心原子为
(6)在催化剂和加热条件下,NO2与NH3可反应生成无害物质,请写出反应的化学方程式:
(7)实验室可用烧碱溶液吸收NO2和NO,(已知2NO2+2NaOH=NaNO2+NaNO3+H2O,NO2+NO+2NaOH=2NaNO2+H2O),当消耗100mL 0.5mol·L-1的烧碱溶液时,共吸收混合气体
(8)NH4Fe(SO4)2用作工业废水的凝结剂,为检验其中的铁元素可选用的方法是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】如图是部分元素的第一电离能随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。
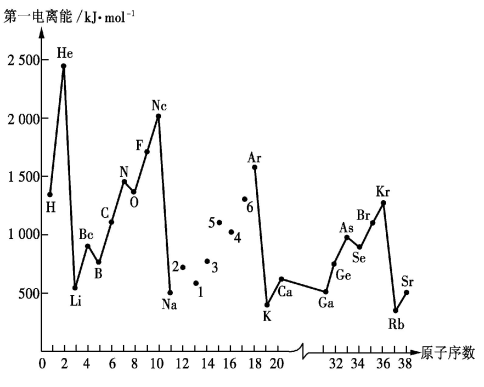
请回答下列问题:
(1)请写出ds区铜原子基态电子排布式_______
(2)同主族元素的第一电离能的变化规律是_______ 。
(3)图中第一电离能最小的元素在周期表中的位置是_______ 。
(4)根据对角线规则,Be、Al的最高价氧化物对应水化物的性质相似,它们都具有_______ 性,能证明 该性质的实验结论是
该性质的实验结论是______________ 。
(5)Na~Ar元素中,某元素M电离能如表所示:
①由此判断该元素是_______ ;
②分析图中同周期元素第一电离能的变化规律,推断:I1(Mg)_______ I1(M),其原因是_______ 。

请回答下列问题:
(1)请写出ds区铜原子基态电子排布式
(2)同主族元素的第一电离能的变化规律是
(3)图中第一电离能最小的元素在周期表中的位置是
(4)根据对角线规则,Be、Al的最高价氧化物对应水化物的性质相似,它们都具有
 该性质的实验结论是
该性质的实验结论是(5)Na~Ar元素中,某元素M电离能如表所示:
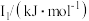 |  | 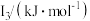 | 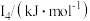 | 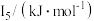 |
| 578 | 1817 | 2745 | 11575 | 14830 |
①由此判断该元素是
②分析图中同周期元素第一电离能的变化规律,推断:I1(Mg)
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态 的简化电子排布式为
的简化电子排布式为___________ 。
(2)实验室可用 、苯酚(
、苯酚( )来检验
)来检验 。N、O、S三种元素的第一电离能由大到小的顺序为
。N、O、S三种元素的第一电离能由大到小的顺序为___________ (用元素符号表示),苯酚中碳原子的杂化轨道类型为___________ 。
(3) 常作净水剂和补铁剂,
常作净水剂和补铁剂, 的空间结构是
的空间结构是___________ 。
(4)羰基铁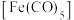 可用作催化剂、汽油抗爆剂等。
可用作催化剂、汽油抗爆剂等。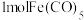 分子中含
分子中含___________  配位键,与
配位键,与 互为等电子体的离子是
互为等电子体的离子是___________ (填化学式,写一种)。
(1)基态
 的简化电子排布式为
的简化电子排布式为(2)实验室可用
 、苯酚(
、苯酚( )来检验
)来检验 。N、O、S三种元素的第一电离能由大到小的顺序为
。N、O、S三种元素的第一电离能由大到小的顺序为(3)
 常作净水剂和补铁剂,
常作净水剂和补铁剂, 的空间结构是
的空间结构是(4)羰基铁
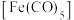 可用作催化剂、汽油抗爆剂等。
可用作催化剂、汽油抗爆剂等。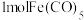 分子中含
分子中含 配位键,与
配位键,与 互为等电子体的离子是
互为等电子体的离子是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】按要求填空。
(1)已知Ge与C同族, 中心原子价层电子对互斥模型为
中心原子价层电子对互斥模型为_______ 。
(2)等电子体是具有相同的价电子数和原子数的分子或离子,它们通常具有相似的空间结构。CO的结构式为_______ , 的空间结构为
的空间结构为_______ 。
(3)根据对角线规则,铍(Be)的性质_______ (填化学式)相似,能与氢氧化钠溶液反应。写出氢氧化铍与氢氧化钠溶液反应的化学方程式_______ 。
(4)某有机物结构简式为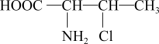 ,该分子中含有
,该分子中含有_______ 个手性碳原子。
(5)在BF3分子中,硼原子的杂化轨道类型为_______ ,F-B-F的键角是_______ , 为
为_______ 分子(填“极性”或“非极性”)。
(1)已知Ge与C同族,
 中心原子价层电子对互斥模型为
中心原子价层电子对互斥模型为(2)等电子体是具有相同的价电子数和原子数的分子或离子,它们通常具有相似的空间结构。CO的结构式为
 的空间结构为
的空间结构为(3)根据对角线规则,铍(Be)的性质
(4)某有机物结构简式为
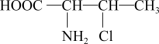 ,该分子中含有
,该分子中含有(5)在BF3分子中,硼原子的杂化轨道类型为
 为
为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ.现有下列粒子:①BF3、②HCN、③NH2- 请填写下列空白(填序号):
(1)存在极性键的非极性分子是__________ ;
(2)中心原子轨道为sp3杂化的是________ ;
(3)只存在σ键的微粒是__________ , 存在π键的微粒是__________ ,
(4)空间构型呈“V”形的是__________ 。
Ⅱ.氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)N2H62+在碱性溶液中反应的离子方程式:_______________ ,
(2)NH2-的电子式为__________________________ ,
(3)写出二种与N3-等电子体的微粒化学式___________ 。
(1)存在极性键的非极性分子是
(2)中心原子轨道为sp3杂化的是
(3)只存在σ键的微粒是
(4)空间构型呈“V”形的是
Ⅱ.氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)N2H62+在碱性溶液中反应的离子方程式:
(2)NH2-的电子式为
(3)写出二种与N3-等电子体的微粒化学式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题:
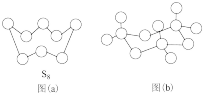
(1)图(a)为 的结构,其硫原子的杂化轨道类型为
的结构,其硫原子的杂化轨道类型为___________ 。
(2)气态三氧化硫以单分子形式存在,其分子的空间结构为___________ ;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为___________ 。
(3) 分子中所有原子均满足8电子构型,
分子中所有原子均满足8电子构型, 分子中
分子中 键和
键和 键的个数比为
键的个数比为___________ ,中心原子的杂化方式为___________ 。
(4) 的分子结构如图所示,其中
的分子结构如图所示,其中 原子的杂化方式为
原子的杂化方式为___________ 。
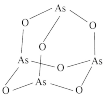
(5) 中,
中, 原子的轨道杂化方式为
原子的轨道杂化方式为___________ 。

(1)图(a)为
 的结构,其硫原子的杂化轨道类型为
的结构,其硫原子的杂化轨道类型为(2)气态三氧化硫以单分子形式存在,其分子的空间结构为
(3)
 分子中所有原子均满足8电子构型,
分子中所有原子均满足8电子构型, 分子中
分子中 键和
键和 键的个数比为
键的个数比为(4)
 的分子结构如图所示,其中
的分子结构如图所示,其中 原子的杂化方式为
原子的杂化方式为
(5)
 中,
中, 原子的轨道杂化方式为
原子的轨道杂化方式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】已知肼(N2H4)和强氧化剂过氧化氢常用作火箭燃料,火箭部分构件采用钛合金材料。请回答下列问题:
(1)N2H4、H2O2的组成元素中第一电离能最大的是______ 。
(2)钛元素基态原子的核外电子排布式为_____________________ 。
(3)1 mol N2H4分子中所含极性键的数目为___________ 。
(4)H2O2受热易分解为H2O,H2O的空间构型为_______ ,其中心原子的杂化轨道类型为_________ 。
(5)H2S和H2O2的主要物理性质如下表所示:
造成上述熔沸点和溶解度差异的主要原因分别是_______________ 和________________ 。
(6)氧化镁和氮化硼均可用作返回舱的热屏蔽材料,晶格能:氧化镁_______ (填“大于”或“小于”)氧化钙。
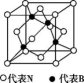
(7)立方氮化硼的晶胞如图所示。处于晶胞顶点的原子的配位数为______ 。若晶胞边长为a cm,则立方氮化硼的密度是________________ g·cm-3。(只要求列出算式,设阿伏伽德罗常数的值为NA)
(1)N2H4、H2O2的组成元素中第一电离能最大的是
(2)钛元素基态原子的核外电子排布式为
(3)1 mol N2H4分子中所含极性键的数目为
(4)H2O2受热易分解为H2O,H2O的空间构型为
(5)H2S和H2O2的主要物理性质如下表所示:
| 物质 | 熔点/K | 沸点/K | 水中溶解度(标准状况) |
| H2S | 187 | 202 | 每升水中溶解2.6 L |
| H2O2 | 272 | 423 | 以任意比互溶 |
造成上述熔沸点和溶解度差异的主要原因分别是
(6)氧化镁和氮化硼均可用作返回舱的热屏蔽材料,晶格能:氧化镁
(7)立方氮化硼的晶胞如图所示。处于晶胞顶点的原子的配位数为

您最近一年使用:0次