某废钒渣(主要成分为V2O3,含有少量Al2O3、CaO)为原料生产V2O5的工艺流程如图:
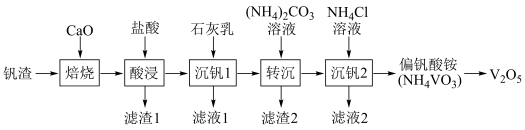
已知:钒酸(H3VO4)是强酸,NH4VO3难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
(1)向钒渣中加入生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式为_______ 。
(2)已知Ca(VO3)2难溶于水,可溶于盐酸。若“酸浸”时溶液的pH=4,则Ca(VO3)2溶于盐酸的离子方程式为_______ 。
(3)已知加入石灰乳后生成Ca3(VO4)2沉淀,则加入石灰乳的作用是_______ 。
(4)反应Ca3(VO4)2(s)+3 (aq)⇌2VO
(aq)⇌2VO (aq)+3CaCO3(s)的平衡常数为
(aq)+3CaCO3(s)的平衡常数为_______ (用含m,n的代数式表示),已知:Ksp(CaCO3)=m,Ksp[Ca3(VO4)2]=n。
(5)沉钒2过程中加入氯化铵溶液,控制溶液的pH=7.5,当pH>8时,NH4VO3的产量明显降低,原因是_______ 。
(6)测定产品中V2O5的纯度:取ag产品用硫酸溶解得(VO2)2SO4溶液,加入b1mLclmol·L-1(NH4)2Fe(SO4)2溶液(VO +2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知
+2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知 被还原为Mn2+,假设杂质不参与反应。
被还原为Mn2+,假设杂质不参与反应。
①滴定时装KMnO4溶液为_______ 滴定管(填“酸式”或“碱式”)
②则产品中V2O5的质量分数是_______ (V2O5的摩尔质量为Mg·mol-1)。
(7)下列操作会导致测定的纯度偏高的是_______。

已知:钒酸(H3VO4)是强酸,NH4VO3难溶于水;+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO |  | V2O | VO |
(1)向钒渣中加入生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式为
(2)已知Ca(VO3)2难溶于水,可溶于盐酸。若“酸浸”时溶液的pH=4,则Ca(VO3)2溶于盐酸的离子方程式为
(3)已知加入石灰乳后生成Ca3(VO4)2沉淀,则加入石灰乳的作用是
(4)反应Ca3(VO4)2(s)+3
 (aq)⇌2VO
(aq)⇌2VO (aq)+3CaCO3(s)的平衡常数为
(aq)+3CaCO3(s)的平衡常数为(5)沉钒2过程中加入氯化铵溶液,控制溶液的pH=7.5,当pH>8时,NH4VO3的产量明显降低,原因是
(6)测定产品中V2O5的纯度:取ag产品用硫酸溶解得(VO2)2SO4溶液,加入b1mLclmol·L-1(NH4)2Fe(SO4)2溶液(VO
 +2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知
+2H++Fe2+=VO2++Fe3++H2O),再用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知 被还原为Mn2+,假设杂质不参与反应。
被还原为Mn2+,假设杂质不参与反应。①滴定时装KMnO4溶液为
②则产品中V2O5的质量分数是
(7)下列操作会导致测定的纯度偏高的是_______。
| A.锥形瓶水洗后未干燥 |
| B.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| C.滴定终点时俯视读数 |
| D.滴定管用蒸馏水洗净后未用标准溶液润洗 |
更新时间:2023-12-01 12:15:14
|
相似题推荐
解答题-工业流程题
|
困难
(0.15)
【推荐1】电池级Li2CO3是制造LiCoO2等锂离子电池必不可少的原材料。以锂云母浸出液(含Li+、Fe3+、Ca2+、Na+等)为原料制取电池级Li2CO3的工艺流程如图:

已知:①HR为有机萃取剂,难溶于水,可萃取Fe3+,萃取时发生的反应可表示为:Fe3++3HR FeR3+3H+;②常温时,1mol•L-1LiOH溶液的pH=14。回答下列问题:
FeR3+3H+;②常温时,1mol•L-1LiOH溶液的pH=14。回答下列问题:
(1)“有机层”的主要成分为_______ (填化学式,下同);“滤渣1”中含有的物质为_______ ;使用HR萃取剂时,需加入一定量的NaOH进行处理,其目的是______ 。
(2)某种HR的结构简式为 ,该分子中可能与Fe3+形成配位键的原子是
,该分子中可能与Fe3+形成配位键的原子是______ 。
(3)已知Ksp[Ca3(PO4)2]=2.0×10-29,为使溶液中c(Ca2+)≤2.0×10-5mol/L,c(PO )的范围
)的范围_______ 。
(4)“加热”时发生主要反应的离子方程式为_______ 。
(5)Li2CO3与Co3O4在空气中加热可以制备重要的电极材料钴酸锂(LiCoO2)。写出对应的化学方程式_______ 。
(6)钴酸锂(LiCoO2)晶胞结构示意图如图所示,各离子位于晶胞的顶点、棱和体内。该晶胞密度为______ g•cm-3。(写出计算式,阿伏加德罗常数为NA)


已知:①HR为有机萃取剂,难溶于水,可萃取Fe3+,萃取时发生的反应可表示为:Fe3++3HR
 FeR3+3H+;②常温时,1mol•L-1LiOH溶液的pH=14。回答下列问题:
FeR3+3H+;②常温时,1mol•L-1LiOH溶液的pH=14。回答下列问题:(1)“有机层”的主要成分为
(2)某种HR的结构简式为
 ,该分子中可能与Fe3+形成配位键的原子是
,该分子中可能与Fe3+形成配位键的原子是(3)已知Ksp[Ca3(PO4)2]=2.0×10-29,为使溶液中c(Ca2+)≤2.0×10-5mol/L,c(PO
 )的范围
)的范围(4)“加热”时发生主要反应的离子方程式为
(5)Li2CO3与Co3O4在空气中加热可以制备重要的电极材料钴酸锂(LiCoO2)。写出对应的化学方程式
(6)钴酸锂(LiCoO2)晶胞结构示意图如图所示,各离子位于晶胞的顶点、棱和体内。该晶胞密度为

您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
解题方法
【推荐2】钼酸锂(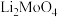 )主要用于溴化锂中央空调的缓冲剂。以精选钼矿(主要成分为
)主要用于溴化锂中央空调的缓冲剂。以精选钼矿(主要成分为 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备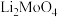 并回收副产品的工艺流程图如下所示:
并回收副产品的工艺流程图如下所示:
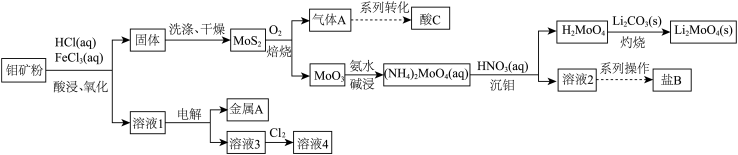
回答下列问题:
(1)酸C是___________ (填化学式,下同),盐B是___________ 。
(2)溶液4可循环用于“酸浸、氧化”,通入氯气的目的是___________ (用离子方程式表示)。
(3)“灼烧”制备钼酸锂的化学方程式为___________ 。
如果在实验室里完成“灼烧”,宜选择___________ (填字母)。
A.石英坩埚 B.铁坩埚 C.陶瓷坩埚 D.蒸发皿
(4)溶液1主要含 、
、 、
、 、
、 、
、 等,“电解”中阴极最先发生的电极反应式为
等,“电解”中阴极最先发生的电极反应式为___________ 。下列试剂不能检验 洗涤干净的是
洗涤干净的是___________ (填序号)。
①铁氰化钾溶液 ②酚酞溶液 ③ 溶液 ④
溶液 ④ 溶液
溶液
(5)钼矿粉在一定量浓度的盐酸、氯化铁混合液中的“浸取率”与温度的关系如图所示。
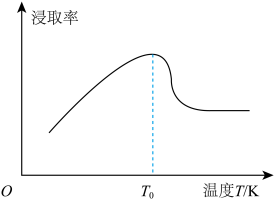
简述温度高于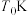 时“浸取率”急剧下降的主要原因:
时“浸取率”急剧下降的主要原因:___________ (答两点)。
(6)已知常温下,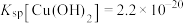 ,
,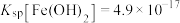 ,若溶液1中
,若溶液1中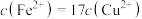 ,
,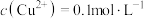 。向溶液1中滴加稀
。向溶液1中滴加稀 溶液使
溶液使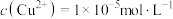 时,此时是否有
时,此时是否有 生成?
生成?___________ (通过计算说明)。
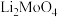 )主要用于溴化锂中央空调的缓冲剂。以精选钼矿(主要成分为
)主要用于溴化锂中央空调的缓冲剂。以精选钼矿(主要成分为 ,含少量
,含少量 等杂质)为原料制备
等杂质)为原料制备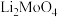 并回收副产品的工艺流程图如下所示:
并回收副产品的工艺流程图如下所示:
回答下列问题:
(1)酸C是
(2)溶液4可循环用于“酸浸、氧化”,通入氯气的目的是
(3)“灼烧”制备钼酸锂的化学方程式为
如果在实验室里完成“灼烧”,宜选择
A.石英坩埚 B.铁坩埚 C.陶瓷坩埚 D.蒸发皿
(4)溶液1主要含
 、
、 、
、 、
、 、
、 等,“电解”中阴极最先发生的电极反应式为
等,“电解”中阴极最先发生的电极反应式为 洗涤干净的是
洗涤干净的是①铁氰化钾溶液 ②酚酞溶液 ③
 溶液 ④
溶液 ④ 溶液
溶液(5)钼矿粉在一定量浓度的盐酸、氯化铁混合液中的“浸取率”与温度的关系如图所示。

简述温度高于
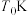 时“浸取率”急剧下降的主要原因:
时“浸取率”急剧下降的主要原因:(6)已知常温下,
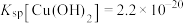 ,
,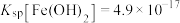 ,若溶液1中
,若溶液1中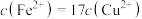 ,
,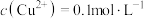 。向溶液1中滴加稀
。向溶液1中滴加稀 溶液使
溶液使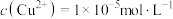 时,此时是否有
时,此时是否有 生成?
生成?
您最近一年使用:0次
【推荐3】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为_______ 。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中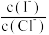 为:
为:_______ ,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) =H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为_______ kJ。
(4)Bodensteins研究了下列反应:2HI(g)⇌H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
①根据上述实验结果,该反应的平衡常数K的计算式为:_______ 。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为_______ (以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=_______ min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_______ (填字母)

(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中
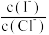 为:
为:(3)已知反应2HI(g) =H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为
(4)Bodensteins研究了下列反应:2HI(g)⇌H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为

您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
【推荐1】二氧化铈( )具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含
)具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)“氧化焙烧”后,Ce元素转化为 和
和 ,写出氧化焙烧的化学方程式
,写出氧化焙烧的化学方程式_______ 。
(2)“酸浸”时,铈的浸出率与温度、 的关系如图所示,应选择的最适宜的条件为
的关系如图所示,应选择的最适宜的条件为_______ (填标号)。不能用盐酸代替硫酸进行酸浸,理由是_______ 。 B.75℃、
B.75℃、 C.85℃、
C.85℃、 D.100℃、
D.100℃、
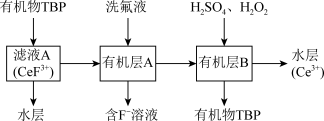
(3)“系列操作”包含以下几个过程: 不能溶于有机物TBP,
不能溶于有机物TBP,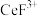 能溶于有机物TBP,且存在反应
能溶于有机物TBP,且存在反应 。
。
“系列操作”在_______ (填仪器名称)中完成,“有机层B”中发生反应的离子方程式为_______ 。
(4)“调pH”中,要使 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于_______ (已知:25℃时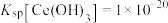 )。
)。
(5)“氧化”中,氧化剂与还原剂的物质的量之比为_______ 。
(6) 具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。
具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。 中位于晶粒表面的
中位于晶粒表面的 具有催化作用。已知
具有催化作用。已知 晶胞边长为
晶胞边长为 ,在边长为
,在边长为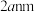 的立方体晶粒中位于表面的
的立方体晶粒中位于表面的 最多有
最多有_______ 个。
②在尾气消除过程中 与
与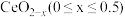 相互转化。
相互转化。 中的Ce为
中的Ce为 、
、 价,测定x的值可判断它们的比例。现取
价,测定x的值可判断它们的比例。现取 固体1.6560g,加入足量硫酸和
固体1.6560g,加入足量硫酸和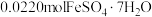 充分溶解,使
充分溶解,使 ⁺全部被还原成
⁺全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性:
标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性: ),则x的值为
),则x的值为_______ ,则此时氧空位率为_______ 。
 )具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含
)具有较强的氧化性,是一种应用非常广泛的稀土氧化物。以氟碳铈矿(主要含 、
、 等)为原料制备
等)为原料制备 的一种工艺流程如图所示。
的一种工艺流程如图所示。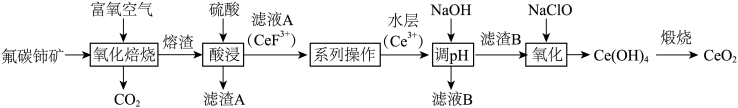
(1)“氧化焙烧”后,Ce元素转化为
 和
和 ,写出氧化焙烧的化学方程式
,写出氧化焙烧的化学方程式(2)“酸浸”时,铈的浸出率与温度、
 的关系如图所示,应选择的最适宜的条件为
的关系如图所示,应选择的最适宜的条件为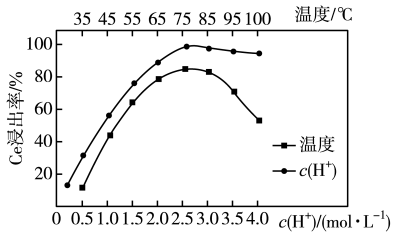
 B.75℃、
B.75℃、 C.85℃、
C.85℃、 D.100℃、
D.100℃、
(3)“系列操作”包含以下几个过程:
 不能溶于有机物TBP,
不能溶于有机物TBP,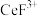 能溶于有机物TBP,且存在反应
能溶于有机物TBP,且存在反应 。
。“系列操作”在
(4)“调pH”中,要使
 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于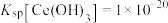 )。
)。(5)“氧化”中,氧化剂与还原剂的物质的量之比为
(6)
 具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。
具有良好的储氧放氧能力,晶胞如图所示,是汽车尾气净化催化剂的关键成分。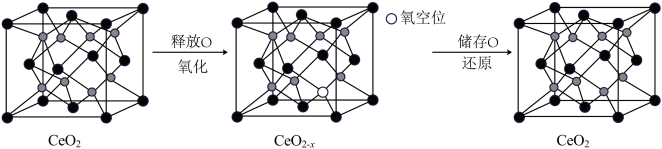
 中位于晶粒表面的
中位于晶粒表面的 具有催化作用。已知
具有催化作用。已知 晶胞边长为
晶胞边长为 ,在边长为
,在边长为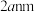 的立方体晶粒中位于表面的
的立方体晶粒中位于表面的 最多有
最多有②在尾气消除过程中
 与
与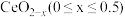 相互转化。
相互转化。 中的Ce为
中的Ce为 、
、 价,测定x的值可判断它们的比例。现取
价,测定x的值可判断它们的比例。现取 固体1.6560g,加入足量硫酸和
固体1.6560g,加入足量硫酸和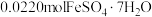 充分溶解,使
充分溶解,使 ⁺全部被还原成
⁺全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性:
标准溶液滴定至终点,重复操作三次,平均消耗标准溶液40.00mL(已知氧化性: ),则x的值为
),则x的值为
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
名校
【推荐2】钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业上利用碘、烧碱和铁屑为原料可生产碘化钠,其生产流程如图所示:
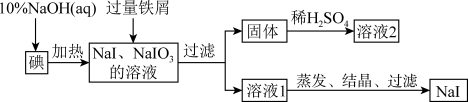
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为________________________________ 。
(2)生产流程中加入过量铁屑的目的是___________________ ,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是_________ 。
(3)溶液2中除含有H+外,一定含有的阳离子是__________________ ;试设计实验证实该金属阳离子的存在:____________________________ 。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:__________________________ ;
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式:________________ 。

(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为
(2)生产流程中加入过量铁屑的目的是
(3)溶液2中除含有H+外,一定含有的阳离子是
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式:
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐3】海水是巨大的化学资源宝库。
Ⅰ.从海水中可以提取氯、溴、碘等卤族元素。
(1)HClO的电子式是_____ 。
(2)已知:X2 (g)+H2(g) 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。
下图表示平衡常数K与温度t的关系。

①ΔH 表示X2与H2反应的焓变,则ΔH_____ 0(填“>”、“<”或“=”)。
②曲线a表示的是___ (填“Cl2”、“Br2”或“I2”)与H2反应时K与t的关系。
Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理。`
(1)通常用明矾[K2SO4·Al2(SO4)3·24H2O]作混凝剂,降低浊度。明矾水解的离子方程式是_____ 。
(2)用下图所示NaClO的发生装置对海水进行消毒和灭藻处理。

①装置中由NaCl转化为NaClO的化学方程式是______ ,______ 。
②海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的离子方程式是_____ 。
③若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。试用电极反应式并结合必要的文字进行解释_____ 。
Ⅰ.从海水中可以提取氯、溴、碘等卤族元素。
(1)HClO的电子式是
(2)已知:X2 (g)+H2(g)
 2HX(g) (X2表示Cl2、Br2和I2)。
2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度t的关系。

①ΔH 表示X2与H2反应的焓变,则ΔH
②曲线a表示的是
Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理。`
(1)通常用明矾[K2SO4·Al2(SO4)3·24H2O]作混凝剂,降低浊度。明矾水解的离子方程式是
(2)用下图所示NaClO的发生装置对海水进行消毒和灭藻处理。

①装置中由NaCl转化为NaClO的化学方程式是
②海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的离子方程式是
③若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。试用电极反应式并结合必要的文字进行解释
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
解题方法
【推荐1】二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,答下列问题:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为:______________________________ ;
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过图1过程制备ClO2:


①电解时发生反应的化学方程式为:______________________________ ;
②除去ClO2中的NH3可选用的试剂是________ (填标号)
a.水b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用图2装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入 3mL 稀硫酸:
Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000mol•L﹣1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(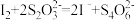 ),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液.在此过程中:
),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液.在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为:______________________________ ;
②滴定至终点的现象是:______________________________ ;
③测得混合气中ClO2的质量为__________ g。
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为:
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过图1过程制备ClO2:


①电解时发生反应的化学方程式为:
②除去ClO2中的NH3可选用的试剂是
a.水b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用图2装置可以测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入 3mL 稀硫酸:
Ⅱ.在玻璃液封装置中加入水.使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中:
Ⅴ.用0.1000mol•L﹣1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(
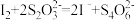 ),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液.在此过程中:
),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液.在此过程中:①锥形瓶内ClO2与碘化钾反应的离子方程式为:
②滴定至终点的现象是:
③测得混合气中ClO2的质量为
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
解题方法
【推荐2】NaClO2·3H2O具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
I.下列是制备NaClO2·3H2O的一种流程:
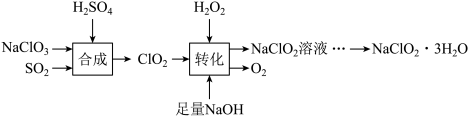
已知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2。
(1)写出“合成”中发生反应的离子方程式:___________________________________________ 。
(2)“转化”过程中反应的化学方程式是______________________________________________ 。
(3)由NaClO2溶液得到NaClO2·3H2O的操作为:蒸发浓缩,___________ ,过滤洗涤,得到NaClO2·3H2O产品。
II.为确定产品的纯度,进行如下实验:
步骤1:取20.00gNaClO2·3H2O样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
步骤2:取出20.00mL配制的溶液于锥形瓶中,加入略过量的1.000mol/LKI溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用2.000mol/LNa2S2O3溶液滴定至终点。
步骤3:重复以上操作2~3次,测得滴定Na2S2O3溶液的平均体积为22.00mL。
已知: +4I-+4H+=Cl-+2I2+2H2O,I2+2
+4I-+4H+=Cl-+2I2+2H2O,I2+2 =2I-+
=2I-+
(4)试计算该NaClO2·3H2O样品的纯度___________ 。
I.下列是制备NaClO2·3H2O的一种流程:

已知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2。
(1)写出“合成”中发生反应的离子方程式:
(2)“转化”过程中反应的化学方程式是
(3)由NaClO2溶液得到NaClO2·3H2O的操作为:蒸发浓缩,
II.为确定产品的纯度,进行如下实验:
步骤1:取20.00gNaClO2·3H2O样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
步骤2:取出20.00mL配制的溶液于锥形瓶中,加入略过量的1.000mol/LKI溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用2.000mol/LNa2S2O3溶液滴定至终点。
步骤3:重复以上操作2~3次,测得滴定Na2S2O3溶液的平均体积为22.00mL。
已知:
 +4I-+4H+=Cl-+2I2+2H2O,I2+2
+4I-+4H+=Cl-+2I2+2H2O,I2+2 =2I-+
=2I-+
(4)试计算该NaClO2·3H2O样品的纯度
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐3】连二硫酸锰(MnS2O6,其中Mn为+2价)是一种常用的果蔬保鲜剂,易溶于水,室温下其水溶液在pH为2.8~3.5时最稳定。回答下列问题:
Ⅰ.制备连二硫酸锰(MnS2O6)
某化学小组利用MnO2悬浊液吸收SO2气体制取连二硫酸锰的装置(部分夹持、加热仪器已省略)如图所示。
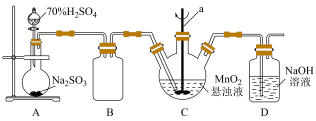
(1)仪器a的名称为________ ,装置B的作用是________ 。
(2)装置C中的反应温度需要控制在0℃左右,控制温度的方法是_______ 。实验时需要向C中通入稍过量的SO2,目的是________ 。
(3)装置C中反应生成等物质的量的MnS2O6和MnSO4,则反应的化学方程式为_______ ,判断反应完成的现象是_______ ,待反应结束后经除杂、减压蒸发浓缩、结晶可得产品MnS2O6•nH2O。
Ⅱ.测定产品中Mn的质量分数
称取ag产品充分加热使其分解为MnSO4,然后加水溶解,用cmol•L-1的KMnO4溶液进行滴定(Mn元素均转化为MnO2)。
(4)滴定时,发生反应的离子方程式为_______ ;若滴定消耗KMnO4溶液的体积为VmL,则产品中Mn的质量分数为_______ 。
(5)下列操作会使得测定结果偏大的是_______ 。
Ⅰ.制备连二硫酸锰(MnS2O6)
某化学小组利用MnO2悬浊液吸收SO2气体制取连二硫酸锰的装置(部分夹持、加热仪器已省略)如图所示。

(1)仪器a的名称为
(2)装置C中的反应温度需要控制在0℃左右,控制温度的方法是
(3)装置C中反应生成等物质的量的MnS2O6和MnSO4,则反应的化学方程式为
Ⅱ.测定产品中Mn的质量分数
称取ag产品充分加热使其分解为MnSO4,然后加水溶解,用cmol•L-1的KMnO4溶液进行滴定(Mn元素均转化为MnO2)。
(4)滴定时,发生反应的离子方程式为
(5)下列操作会使得测定结果偏大的是
| A.滴定前锥形瓶用蒸馏水洗后未用待测MnSO4溶液润洗 |
| B.滴定前平视读数,滴定结束俯视读数 |
| C.滴定前滴定管中尖嘴处有气泡,滴定后气泡消失 |
| D.对连二硫酸锰产品进行加热操作时加热不充分 |
您最近一年使用:0次



