传世名画《千里江山图》的主要取景地是庐山与鄱阳湖,其采用的绿蓝两种颜料——优质孔雀石【Cu2(OH)2CO3】和蓝铜矿【Cu2(OH)2(CO3)2】。
(1)从地表采掘的孔雀石【Cu2(OH)2CO3】,还是古代冶炼铜的原料。流程如下:
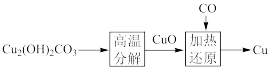
孔雀石【Cu2(OH)2CO3】中铜元素的化合价为___________ ,其高温分解的化学方程式是___________ ;加热还原过程中氧化剂、还原剂分别为___________ 、___________ 。
(2)地表深处的黄铜矿(CuFeS2)被氧气氧化:xCuFeS2+yO2→zCu2++qFe2++nSO ;形成Cu2+流入地表后,遇到石灰石形成孔雀石,同时还有CaSO4和CO2生成。
;形成Cu2+流入地表后,遇到石灰石形成孔雀石,同时还有CaSO4和CO2生成。
①x=___________ ,y=___________ 。
②形成孔雀石的化学方程式是___________ 。
③孔雀石虽然较稳定,遇到足量盐酸则完全溶解,其离子方程式为___________ 。
④Cu2+流入地表后可以形成孔雀石、蓝铜矿或Cu(OH)2三种矿物质,当HCO 浓度相对较大时,产物主要取决于地表水溶液的pH大小。弱酸性水中,一般以
浓度相对较大时,产物主要取决于地表水溶液的pH大小。弱酸性水中,一般以___________ (填化学式)为主;pH>10的碱性水中,一般以___________ (填化学式)为主。
(1)从地表采掘的孔雀石【Cu2(OH)2CO3】,还是古代冶炼铜的原料。流程如下:
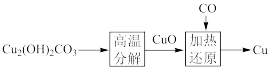
孔雀石【Cu2(OH)2CO3】中铜元素的化合价为
(2)地表深处的黄铜矿(CuFeS2)被氧气氧化:xCuFeS2+yO2→zCu2++qFe2++nSO
 ;形成Cu2+流入地表后,遇到石灰石形成孔雀石,同时还有CaSO4和CO2生成。
;形成Cu2+流入地表后,遇到石灰石形成孔雀石,同时还有CaSO4和CO2生成。①x=
②形成孔雀石的化学方程式是
③孔雀石虽然较稳定,遇到足量盐酸则完全溶解,其离子方程式为
④Cu2+流入地表后可以形成孔雀石、蓝铜矿或Cu(OH)2三种矿物质,当HCO
 浓度相对较大时,产物主要取决于地表水溶液的pH大小。弱酸性水中,一般以
浓度相对较大时,产物主要取决于地表水溶液的pH大小。弱酸性水中,一般以
更新时间:2023-12-05 19:09:27
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】镍废料中主要含有Ni,还有少量的Cu、Fe、Pb等。现从中制取Ni2O3,可用于制造人造卫星、宇宙飞船的高能电池,也可用于制成镍镉碱性电池。生产流程见下:
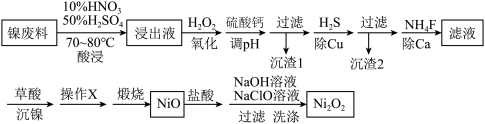
已知0.010 mol/L金属离子在不同pH下的沉淀情况如下:
回答下列问题:
(1)加入碳酸钙调pH的目的是___________________ ,“沉渣2”的主要成分是_____ ,必须先过滤“沉渣1”后再进行“除Cu”的原因是______________ 。
(2)用离子方程式解释加入NH4F “除Ca”的过程________________ 。
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3:2,此时Ni单质所发生的化学方程式为_______ 。
(4)“操作X”是________ 、________
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为__________________ 。
(6)根据上表数据,计算当0.010 mol/L NiSO4溶液中Ni2+完全沉淀时的c(Ni2+)=____ mol/L。

已知0.010 mol/L金属离子在不同pH下的沉淀情况如下:
| Fe3+ | Cu2+ | Ni2+ | Fe2+ | |
| 开始沉淀pH | 3.0 | 5.0 | 7.4 | 9.7 |
| 完全沉淀pH | 4.0 | 6.5 | 9.0 | 11 |
回答下列问题:
(1)加入碳酸钙调pH的目的是
(2)用离子方程式解释加入NH4F “除Ca”的过程
(3)“酸浸”时参与反应的H2SO4与HNO3物质的量比保持为3:2,此时Ni单质所发生的化学方程式为
(4)“操作X”是
(5)向NiO中加入盐酸溶解,待完全溶解后,加入足量NaOH溶液,再加入NaClO溶液,写出其中和NaClO相关的反应的离子方程式为
(6)根据上表数据,计算当0.010 mol/L NiSO4溶液中Ni2+完全沉淀时的c(Ni2+)=
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】砷是生命的第七元素,可形成多种重要化合物,如雌黄(As2S3)、雄黄(As4S4)、砷酸(H3AsO4)和亚砷酸(H3AsO3)等。
(1)雄黄可入药。若0.5mol雄黄与O2反应生成As2O3,转移14mol电子,则另一种产物为______________ (填化学式)。
(2)砷酸(H3AsO4)是一种重要化工产品,可与足量NaOH溶液反应生成Na3AsO4。NaH2AsO4溶液水解反应的Kh=_________ ,该溶液显______ (填“酸”或“碱”)性。若向该溶液中加入少量NaOH固体,则溶液中 将
将_______ (填“增大”、“减小”或“不变”)。(已知:25℃,砷酸的Ka1=5×10-3,Ka2=1.7×10-7)
(3)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态。常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化如图所示。
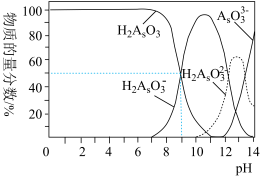
以酚酞为指示剂,将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为红色时停止滴加。该过程中主要反应的离子方程式为_______________ ,pH=8时,溶液中,c(Na+)________ c(H2AsO3-)(填“>”、“<”或“=”)。
(1)雄黄可入药。若0.5mol雄黄与O2反应生成As2O3,转移14mol电子,则另一种产物为
(2)砷酸(H3AsO4)是一种重要化工产品,可与足量NaOH溶液反应生成Na3AsO4。NaH2AsO4溶液水解反应的Kh=
 将
将(3)亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态。常温下,用NaOH溶液滴定H3AsO3时,各种微粒的物质的量分数随pH的变化如图所示。

以酚酞为指示剂,将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为红色时停止滴加。该过程中主要反应的离子方程式为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】钯催化剂(主要成分为Pd、α-Al2O3,还含少量铁、铜等)是石油化工中催化加氢和催化氧化等反应的重要催化剂。一种从废钯催化剂中回收海绵钯的工艺流程如下:

已知:①钯催化剂在使用过程中Pd易被氧化为难溶于酸的PdO而失活;H2PdCl4是一种二元强酸;
②常温下,K[Fe(OH)3]=1x10-38,Kp[Cu(OH)2]=1x10-20。
回答下列问题:
(1)“还原I”过程中加入甲酸的主要目的是还原___________ (填化学式)。
(2)“酸浸”过程中Pd转化的离子方程式为___________ 。
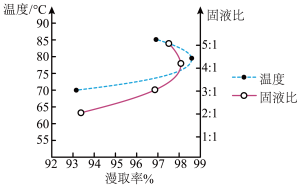
(3)“酸浸”过程中温度、固液比对浸取率的影响如图,则“酸浸”的最佳条件为___________ 。
(4)“离子交换”过程可简单表示为 +2RCl
+2RCl R2PdCl4+2Cl-,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。假设流出液中各金属离子的浓度均为0.01mol·L-1,常温下需调节pH的范围是
R2PdCl4+2Cl-,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。假设流出液中各金属离子的浓度均为0.01mol·L-1,常温下需调节pH的范围是___________ 。
(5)“沉钯”过程钯元素主要发生如下转化:H2PdCl4(稀溶液) [Pd(NH3)4]Cl2(稀溶液)
[Pd(NH3)4]Cl2(稀溶液) Pd(NH3)2Cl2(沉淀)。则滤液中溶质的主要成分为
Pd(NH3)2Cl2(沉淀)。则滤液中溶质的主要成分为___________ (填化学式)。
(6)“还原II”过程中产生无毒无害气体。由Pd(NH3)2Cl2生成海绵钯的化学方程式为______ 。

已知:①钯催化剂在使用过程中Pd易被氧化为难溶于酸的PdO而失活;H2PdCl4是一种二元强酸;
②常温下,K[Fe(OH)3]=1x10-38,Kp[Cu(OH)2]=1x10-20。
回答下列问题:
(1)“还原I”过程中加入甲酸的主要目的是还原
(2)“酸浸”过程中Pd转化的离子方程式为
(3)“酸浸”过程中温度、固液比对浸取率的影响如图,则“酸浸”的最佳条件为

(4)“离子交换”过程可简单表示为
 +2RCl
+2RCl R2PdCl4+2Cl-,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。假设流出液中各金属离子的浓度均为0.01mol·L-1,常温下需调节pH的范围是
R2PdCl4+2Cl-,流出液通入NH3调节pH后过滤,滤液经一系列操作可以得到CuCl2·2H2O。假设流出液中各金属离子的浓度均为0.01mol·L-1,常温下需调节pH的范围是(5)“沉钯”过程钯元素主要发生如下转化:H2PdCl4(稀溶液)
 [Pd(NH3)4]Cl2(稀溶液)
[Pd(NH3)4]Cl2(稀溶液) Pd(NH3)2Cl2(沉淀)。则滤液中溶质的主要成分为
Pd(NH3)2Cl2(沉淀)。则滤液中溶质的主要成分为(6)“还原II”过程中产生无毒无害气体。由Pd(NH3)2Cl2生成海绵钯的化学方程式为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
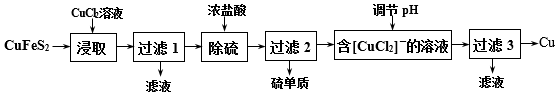
(1)“浸取”时,将黄铜矿进行粉碎的目的是___ 。
(2)“浸取”时,反应生成CuCl、FeCl2和S,该反应化学方程式为____ 。
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是____ 。
(4)“过滤3”所得滤液中可以循环使用的物质有___ 和____ ;为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为___ mol。
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2 2Cu+SO2,此工艺与上述工艺相比,主要缺点有
2Cu+SO2,此工艺与上述工艺相比,主要缺点有_____ 。

(1)“浸取”时,将黄铜矿进行粉碎的目的是
(2)“浸取”时,反应生成CuCl、FeCl2和S,该反应化学方程式为
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是
(4)“过滤3”所得滤液中可以循环使用的物质有
(5)冶炼工艺还可以将精选后的黄铜矿砂与空气在高温下煅烧,使其转变为铜,化学方程式为:6CuFeS2+13O2
 3Cu2S+2Fe3O4+9SO2、Cu2S+O2
3Cu2S+2Fe3O4+9SO2、Cu2S+O2 2Cu+SO2,此工艺与上述工艺相比,主要缺点有
2Cu+SO2,此工艺与上述工艺相比,主要缺点有
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】已知有一白色粉末是由Na2CO3、NaCl、Na2SO4、CuSO4、MgCl2中的一种或几种组成。欲探究这一粉末的组成,甲同学做了如下实验:
①取少量粉末,加水溶解,得无色透明溶液;
②取①中溶液少量,加入NaOH溶液,无明显现象发生;
③另取少量粉末,加入稀盐酸,无明显现象发生。
(1)根据实验①,能得到的结论是__________ 。
(2)甲同学根据以上实验现象,推测这一粉末的可能组成是__________ 。
(3)乙同学在甲同学实验基础上设计了后续实验,确认该粉末只含有Na2SO4,请你在下表中填写乙同学所做的实验。[可供选择的试剂有:BaCl2溶液、AgNO3溶液、稀HNO3、NaOH溶液、Na2CO3溶液、Ba(NO3)2溶液、稀盐酸]
注:填写实验现象、离子方程式和结论要与相应的实验步骤一一对应。
①取少量粉末,加水溶解,得无色透明溶液;
②取①中溶液少量,加入NaOH溶液,无明显现象发生;
③另取少量粉末,加入稀盐酸,无明显现象发生。
(1)根据实验①,能得到的结论是
(2)甲同学根据以上实验现象,推测这一粉末的可能组成是
(3)乙同学在甲同学实验基础上设计了后续实验,确认该粉末只含有Na2SO4,请你在下表中填写乙同学所做的实验。[可供选择的试剂有:BaCl2溶液、AgNO3溶液、稀HNO3、NaOH溶液、Na2CO3溶液、Ba(NO3)2溶液、稀盐酸]
| 实验步骤 | 实验现象 | 反应的离子方程式和结论 |
您最近半年使用:0次
【推荐3】一水硫酸四氨合铜[Cu(NH3)4SO4·H2O]是一种易溶于水,难溶于乙醇的绛蓝色晶体,可作高效安全的广谱杀菌剂。成外某兴趣小组查阅资料后设计实验方案制备出该晶体并对制备出的晶体进行成分检验和性质探究。
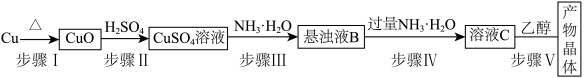
I.制备少量Cu(NH3)4SO4·H2O晶体:___________ (填仪器名称)。___________ 。
(3)步骤Ⅲ的离子方程式为___________ 。
(4)有同学查阅资料得知:(NH4)2SO4也难溶于乙醇。故对于制备出的晶体的成分,该同学提出如下假设:
假设一:只有(NH4)2SO4
假设二:只有Cu(NH3)4SO4·H2O
假设三:(NH4)2SO4和Cu(NH3)4SO4·H2O两种成分都有
已知产物晶体为蓝色,则无需实验即可排除___________ 。(填“假设一”、“假设二”、“假设三”)
Ⅱ.对制备出的晶体的成分进行检验和性质探究
(5)检验该晶体中阴离子的方法:___________ 。
(6)用所得晶体加水得到深蓝色溶液。取三份1L试样,分别加入一定量的水、稀硫酸、热的浓氢氧化钠溶液,实验现象记录如下:
结合化学用语,解释加入稀硫酸后出现的现象的原因___________ 。请补充完整加入热的浓氢氧化钠溶液后的现象:___________ 。
(7)晶体中N含量的测定
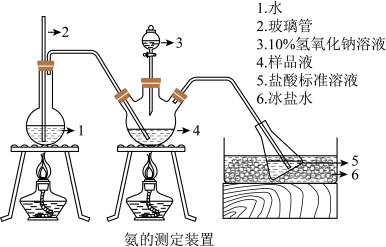
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,并用蒸馏水冲洗导管内壁,用V1mLc1mol/L的盐酸标准溶液完全吸收。取下接收瓶,用c2mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗V2mL溶液。___________ ,样品中N的质量分数的表达式为___________ ,最终通过N的质量分数确定了样品的成分。
I.制备少量Cu(NH3)4SO4·H2O晶体:
(3)步骤Ⅲ的离子方程式为
(4)有同学查阅资料得知:(NH4)2SO4也难溶于乙醇。故对于制备出的晶体的成分,该同学提出如下假设:
假设一:只有(NH4)2SO4
假设二:只有Cu(NH3)4SO4·H2O
假设三:(NH4)2SO4和Cu(NH3)4SO4·H2O两种成分都有
已知产物晶体为蓝色,则无需实验即可排除
Ⅱ.对制备出的晶体的成分进行检验和性质探究
(5)检验该晶体中阴离子的方法:
(6)用所得晶体加水得到深蓝色溶液。取三份1L试样,分别加入一定量的水、稀硫酸、热的浓氢氧化钠溶液,实验现象记录如下:
| 加入试剂 | 水 | 稀硫酸 | 热的氢氧化钠溶液 |
| 现象 | 深蓝色稍变浅 | 溶液颜色变成浅蓝色且与同浓度硫酸铜颜色相当 | 溶液最终变为无色 |
(7)晶体中N含量的测定
精确称取mg晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入VmL10%NaOH溶液,通入水蒸气,并用蒸馏水冲洗导管内壁,用V1mLc1mol/L的盐酸标准溶液完全吸收。取下接收瓶,用c2mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗V2mL溶液。
您最近半年使用:0次



