在室温下,下列叙述正确的是
| A.将1 mL1.0×10-5 mol/L盐酸稀释到1000 mL,稀释后溶液的pH=8 |
| B.将1 mLpH=3的一元酸溶液稀释到10 mL,若溶液的pH<4,则此酸为弱酸 |
| C.用pH=1的盐酸分别中和1 mLpH=13NaOH溶液和氨水,NaOH消耗盐酸的体积大 |
D.pH=2的盐酸与pH=1的硫酸比较,c(Cl-)=c(SO ) ) |
更新时间:2023-12-11 22:15:35
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.25℃, 的 的 溶液中 溶液中 的数目为 的数目为 |
B.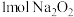 与足量二氧化碳(C18O2)反应生成 与足量二氧化碳(C18O2)反应生成 分子数为 分子数为 |
C.室温下 的 的 溶液 溶液 ,由水电离出的 ,由水电离出的 数目为 数目为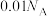 |
D.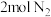 和 和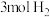 在密闭容器中充分反应得到 在密闭容器中充分反应得到 个 个 分子 分子 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】化学上常用AG表示溶液中的lg 。25℃时,用0.100 mol·L-1的NaOH溶液滴定0.100 mol·L-1的HNO2溶液(20.00 mL),滴定过程中AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100 mol·L-1的NaOH溶液滴定0.100 mol·L-1的HNO2溶液(20.00 mL),滴定过程中AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
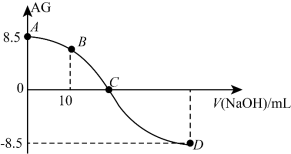
 。25℃时,用0.100 mol·L-1的NaOH溶液滴定0.100 mol·L-1的HNO2溶液(20.00 mL),滴定过程中AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
。25℃时,用0.100 mol·L-1的NaOH溶液滴定0.100 mol·L-1的HNO2溶液(20.00 mL),滴定过程中AG与所加NaOH溶液的体积(V)的关系如图所示,下列说法不正确的是
| A.A点溶液的pH = 2.75,从C点往后的过程中,水的电离程度先变大再变小 |
B.B点溶液中存在:c(H+)-c(OH-)>c(NO )-c(HNO2) )-c(HNO2) |
| C.C点加入NaOH溶液的体积小于20 mL,溶质为HNO2和NaNO2 |
| D.25℃时,HNO2的电离常数Ka约为1.0×10-4.5 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】某温度下水中存在电离平衡H2O H++OH-,H2O的离子积常数=1.0×10-12,该温度下有关分析不正确的是
H++OH-,H2O的离子积常数=1.0×10-12,该温度下有关分析不正确的是
 H++OH-,H2O的离子积常数=1.0×10-12,该温度下有关分析不正确的是
H++OH-,H2O的离子积常数=1.0×10-12,该温度下有关分析不正确的是| A.0.01 mol NaOH溶于水配制成1 L溶液,pH=10 |
| B.将pH为4的HCl的水溶液稀释100倍,所得溶液pH为6 |
| C.向30 mL 0.5 mol/LNaOH的水溶液中加入20 mL 0.5 mol/LHCl的水溶液,所得溶液pH=11 |
| D.此温度下pH=7的溶液呈碱性 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是( )
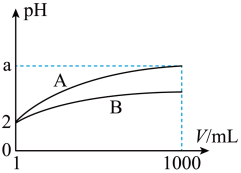
| A.A、B两酸溶液的物质的量浓度一定相等 |
| B.稀释后,A酸溶液的酸性比B酸溶液的酸性强 |
| C.a=5时,A是强酸,B是弱酸 |
| D.一定有关系:5>a>2 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】25℃时,下列说法正确的是
| A.分别取20.00mL0.1000mol/L的盐酸和醋酸溶液,以酚酞作指示剂,用0.1000mol/LNaOH标准溶液滴定至终点时,两者消耗的NaOH溶液体积相等 |
| B.将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| C.均为0.1mol/L的Na2SO3、Na2CO3、H2SO4溶液中阴离子的浓度依次减小 |
| D.常温下pH=11的碱溶液中水电离产生的c(H+)是纯水电离产生的c(H+)的104倍 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】向醋酸溶液中滴加NaOH溶液,则
| A.醋酸的电离平衡向左移动 | B.溶液的pH减小 |
| C.醋酸的浓度减小 | D.醋酸根离子的物质的量减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】室温条件下,下列实验可以证明甲酸(HCOOH)是弱电解质的是
①甲酸易挥发;②0.01 mol/L的甲酸钠溶液的pH大于7;③在相同条件下,0.01 mol/L甲酸的导电性比0.1 mol/L盐酸的弱;④0.01 mol/L的甲酸pH大于2。
①甲酸易挥发;②0.01 mol/L的甲酸钠溶液的pH大于7;③在相同条件下,0.01 mol/L甲酸的导电性比0.1 mol/L盐酸的弱;④0.01 mol/L的甲酸pH大于2。
| A.①② | B.②④ | C.③④ | D.①④ |
您最近一年使用:0次

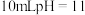 的氨水的说法中,错误的是
的氨水的说法中,错误的是 固体,溶液中
固体,溶液中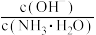 变小
变小 的电离程度增大,溶液导电性增强
的电离程度增大,溶液导电性增强 ,溶液中:
,溶液中:
 的盐酸等体积混合后,溶液使甲基橙显黄色
的盐酸等体积混合后,溶液使甲基橙显黄色

