根据要求回答下列问题:
(1)在第二周期主族元素,第一电离能介于B和N之间的元素有___________ 种。
(2)嫦娥五号实现了我国首次地外天体采样返回,带回的月壤中包含了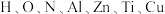 等多种元素,N的第一电离能大于O的,请说明理由:
等多种元素,N的第一电离能大于O的,请说明理由:_______ 。
(3)已知电离能: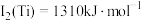 ,
,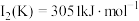 ,
,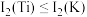 ,其原因为
,其原因为___________ 。
(4)橙红色晶体羰基钴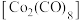 的熔点为
的熔点为 ,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为
,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为_________ (填元素符号)。配体 中
中 键与
键与 键数目之比是
键数目之比是___________ 。
(5) 中键与键之间的夹角为
中键与键之间的夹角为 ,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为
,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为___________ ,1个分子中含有___________ 个 键。
键。
(6)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与 互为等电子体的分子有
互为等电子体的分子有___________ 、___________ 。
(1)在第二周期主族元素,第一电离能介于B和N之间的元素有
(2)嫦娥五号实现了我国首次地外天体采样返回,带回的月壤中包含了
 等多种元素,N的第一电离能大于O的,请说明理由:
等多种元素,N的第一电离能大于O的,请说明理由:(3)已知电离能:
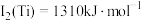 ,
,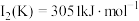 ,
,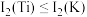 ,其原因为
,其原因为(4)橙红色晶体羰基钴
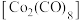 的熔点为
的熔点为 ,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为
,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为 中
中 键与
键与 键数目之比是
键数目之比是(5)
 中键与键之间的夹角为
中键与键之间的夹角为 ,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为
,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为 键。
键。(6)此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与
 互为等电子体的分子有
互为等电子体的分子有
2023高三·全国·专题练习 查看更多[3]
更新时间:2023-12-15 20:39:45
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】我国是世界稀土资源大国,稀土元素是镧系、钪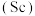 、钇
、钇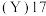 种元素的总称,它们位于元素周期表中同一副族。
种元素的总称,它们位于元素周期表中同一副族。
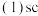 原子的价层电子排布式为
原子的价层电子排布式为______ ,第一电离能Sc______ Y 填“大于”或“小于”
填“大于”或“小于” 。
。
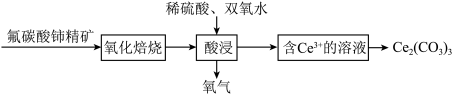
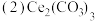 是生产铈的中间化合物,它可由氟碳酸铈
是生产铈的中间化合物,它可由氟碳酸铈
 精矿制得:
精矿制得:
 中,Ce的化合价为
中,Ce的化合价为______ 。
 氧化焙烧生成二氧化铈
氧化焙烧生成二氧化铈 ,其在酸浸时发生反应的离子方程式为
,其在酸浸时发生反应的离子方程式为______ 。
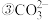 离子的立体构型的名称为
离子的立体构型的名称为______ ,中心原子的杂化方式为______ ,分子或离子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数
键的电子数 如苯分子中的大
如苯分子中的大 键可表示为
键可表示为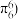 ,则
,则 中的大
中的大 键应表示为
键应表示为______ 。
 常温、常压下
常温、常压下 是铈最稳定的化合物,广泛用于玻璃、原子能、电子管等工业。
是铈最稳定的化合物,广泛用于玻璃、原子能、电子管等工业。 晶胞是立方萤石型,则铈离子的配位数为
晶胞是立方萤石型,则铈离子的配位数为______ ,如图中离子坐标参数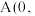 0,
0, ;
;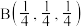 :
: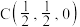 ,若将B选为晶胞顶点坐标参数
,若将B选为晶胞顶点坐标参数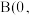 0,
0, ,则D离子处于
,则D离子处于______ 位置,坐标参数为______ 。已知该晶胞的棱长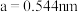 ,其密度为
,其密度为______ 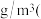 列出计算式即可
列出计算式即可 。
。

 、钇
、钇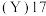 种元素的总称,它们位于元素周期表中同一副族。
种元素的总称,它们位于元素周期表中同一副族。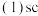 原子的价层电子排布式为
原子的价层电子排布式为 填“大于”或“小于”
填“大于”或“小于” 。
。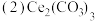 是生产铈的中间化合物,它可由氟碳酸铈
是生产铈的中间化合物,它可由氟碳酸铈
 精矿制得:
精矿制得:
 中,Ce的化合价为
中,Ce的化合价为 氧化焙烧生成二氧化铈
氧化焙烧生成二氧化铈 ,其在酸浸时发生反应的离子方程式为
,其在酸浸时发生反应的离子方程式为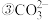 离子的立体构型的名称为
离子的立体构型的名称为 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数
键的电子数 如苯分子中的大
如苯分子中的大 键可表示为
键可表示为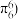 ,则
,则 中的大
中的大 键应表示为
键应表示为 常温、常压下
常温、常压下 是铈最稳定的化合物,广泛用于玻璃、原子能、电子管等工业。
是铈最稳定的化合物,广泛用于玻璃、原子能、电子管等工业。 晶胞是立方萤石型,则铈离子的配位数为
晶胞是立方萤石型,则铈离子的配位数为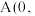 0,
0, ;
;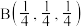 :
: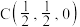 ,若将B选为晶胞顶点坐标参数
,若将B选为晶胞顶点坐标参数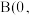 0,
0, ,则D离子处于
,则D离子处于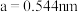 ,其密度为
,其密度为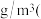 列出计算式即可
列出计算式即可 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】以 、
、 等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是___________ 。
(2)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁锌分子为平面结构,其结构如图,分子中各元素第一电离能由大到小顺序是___________ ,N原子的杂化轨道类型为___________ 。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是___________ 。

(3)金属Zn表面的氧化锌能溶于氨水,能促进锌与氨水反应生成以氨为配体,配位数为4的配离子,写出Zn与氨水反应的离子方程式___________ 。
(4) 晶体中部分O原子被N原子替代后可以改善半导体的性能,
晶体中部分O原子被N原子替代后可以改善半导体的性能, 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是___________ 。
(5)下图为某 晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。abcd为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。abcd为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面___________ 。

 、
、 等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是
(2)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁锌分子为平面结构,其结构如图,分子中各元素第一电离能由大到小顺序是
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(3)金属Zn表面的氧化锌能溶于氨水,能促进锌与氨水反应生成以氨为配体,配位数为4的配离子,写出Zn与氨水反应的离子方程式
(4)
 晶体中部分O原子被N原子替代后可以改善半导体的性能,
晶体中部分O原子被N原子替代后可以改善半导体的性能, 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是(5)下图为某
 晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。abcd为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。abcd为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】如图是部分元素的第一电离能随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。
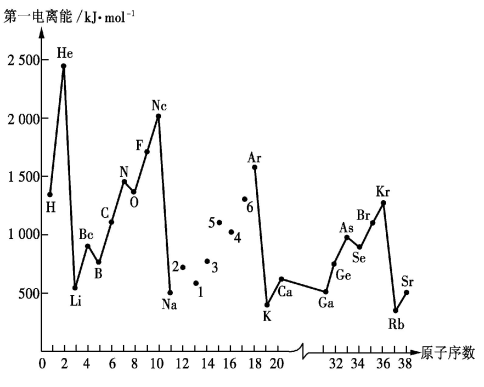
请回答下列问题:
(1)请写出ds区铜原子基态电子排布式_______
(2)同主族元素的第一电离能的变化规律是_______ 。
(3)图中第一电离能最小的元素在周期表中的位置是_______ 。
(4)根据对角线规则,Be、Al的最高价氧化物对应水化物的性质相似,它们都具有_______ 性,能证明 该性质的实验结论是
该性质的实验结论是______________ 。
(5)Na~Ar元素中,某元素M电离能如表所示:
①由此判断该元素是_______ ;
②分析图中同周期元素第一电离能的变化规律,推断:I1(Mg)_______ I1(M),其原因是_______ 。

请回答下列问题:
(1)请写出ds区铜原子基态电子排布式
(2)同主族元素的第一电离能的变化规律是
(3)图中第一电离能最小的元素在周期表中的位置是
(4)根据对角线规则,Be、Al的最高价氧化物对应水化物的性质相似,它们都具有
 该性质的实验结论是
该性质的实验结论是(5)Na~Ar元素中,某元素M电离能如表所示:
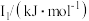 |  | 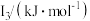 | 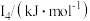 | 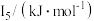 |
| 578 | 1817 | 2745 | 11575 | 14830 |
①由此判断该元素是
②分析图中同周期元素第一电离能的变化规律,推断:I1(Mg)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】能源、材料与生产生活和社会发展密切相关。
I.光伏材料是指能将太阳能直接转换成电能的材料。光伏材料又称太阳能材料,只有半导体材料具有这种功能。可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe等。
(1)写出31号元素镓(Ga)的原子结构示意图:_______ 。
(2)P、S、Ga电负性从大到小的顺序为_______ 。
(3)As元素的第一电离能_______ (填“大于”“小于”或“等于”)Se元素的第一电离能。
(4)写出原子序数最小的第VIII族元素基态原子的核外电子排布式:_______ 。
(5)写出3p轨道上只有2个未成对电子的元素的符号:_______ 、_______ 。
II.从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程。在化学反应过程中,断裂化学键需要消耗能量,形成化学键又会释放能量。
(6)已知:
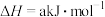 ,根据上表中所列键能数据可计算出a=
,根据上表中所列键能数据可计算出a=_______ 。
I.光伏材料是指能将太阳能直接转换成电能的材料。光伏材料又称太阳能材料,只有半导体材料具有这种功能。可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe等。
(1)写出31号元素镓(Ga)的原子结构示意图:
(2)P、S、Ga电负性从大到小的顺序为
(3)As元素的第一电离能
(4)写出原子序数最小的第VIII族元素基态原子的核外电子排布式:
(5)写出3p轨道上只有2个未成对电子的元素的符号:
II.从化学键的角度分析,化学反应的过程就是反应物的化学键断裂和生成物的化学键形成的过程。在化学反应过程中,断裂化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H—H | N—H | N≡N |
| 键能/(kJ/mol) | 436 | 391 | 945 |

 ,根据上表中所列键能数据可计算出a=
,根据上表中所列键能数据可计算出a=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】根据下列表格,回答有关问题:

(1)上表中,第一电离能最小的元素是____ (填元素名称,下同),电负性最大的元素是___
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是_____ (填化学式,下同),碱性最强的是_____ 。
(3)某元素最高价氧化物对应的水化物呈两性,则该元素是_____ (填对应的字母),该元素与c元素形成的化合物能否与NaOH溶液反应(若能,写出相应的离子方程式;若不能,则填“否”)________ 。
(4)在e~k元素的原子中,原子半径最小的是_____ (填元素符号),其价电子排布式为______ ;未成对电子数最多的是____ (填元素符号),其最高价氧化物对应水化物的化学式为_____ ;有两个未成对电子的元素是________ (填元素符号);M层有两个空轨道的是____ (填元素符号),其阳离子结构示意图为____ 。

(1)上表中,第一电离能最小的元素是
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是
(3)某元素最高价氧化物对应的水化物呈两性,则该元素是
(4)在e~k元素的原子中,原子半径最小的是
您最近一年使用:0次
【推荐3】太阳能的开发利用在新能源研究领域中占据重要地位。单晶硅太阳能电池片在加工时,一般掺杂微量的铜、硼、镓、硒、钛、矾等。回答下列问题:
(1)基态钒原子的电子排布式为___________ ,其中能量最高的电子所占据能级的原子轨道有_________ 个伸展方向。
(2)VO2+与 可形成配合物。
可形成配合物。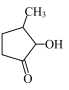 中,第二周期元素的第一电离能由大到小的顺序为
中,第二周期元素的第一电离能由大到小的顺序为_________ (用元素符号表示)。
(3)镓与硒相比,电负性更大的是________ (填元素符号)。
(4)已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构角度解释其原因:________________________________________ 。
(5)与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的有_________ (填元素符号,下同)。
(6)在第二周期元素中,第一电离能介于B和N两元素之间的有_________ 。
(7)硒、硅均能与氢元素形成气态氢化物,若“Si—H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为 Se_________ (填“>”或“<”) Si 。与 Si 同周期的部分元素的电离能如图所示,其中a、b和c分别代表_________ (填字母)。
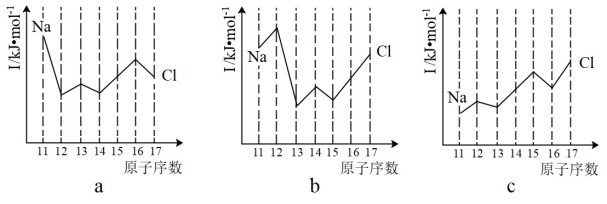
A. a为 ,b为
,b为 ,c为I3 B. a为
,c为I3 B. a为 ,b为
,b为 ,c为
,c为
C. a为 ,b为
,b为 ,c为I1 D. a为
,c为I1 D. a为 ,b为
,b为 ,c为
,c为
(1)基态钒原子的电子排布式为
(2)VO2+与
 可形成配合物。
可形成配合物。 中,第二周期元素的第一电离能由大到小的顺序为
中,第二周期元素的第一电离能由大到小的顺序为(3)镓与硒相比,电负性更大的是
(4)已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构角度解释其原因:
(5)与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的有
(6)在第二周期元素中,第一电离能介于B和N两元素之间的有
(7)硒、硅均能与氢元素形成气态氢化物,若“Si—H”中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性相对大小为 Se

A. a为
 ,b为
,b为 ,c为I3 B. a为
,c为I3 B. a为 ,b为
,b为 ,c为
,c为
C. a为
 ,b为
,b为 ,c为I1 D. a为
,c为I1 D. a为 ,b为
,b为 ,c为
,c为
您最近一年使用:0次
填空题
|
适中
(0.65)
真题
名校
【推荐1】生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式___ 。
(2)根据等电子原理,写出CO分子的结构式_________ 。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O 沉淀。
①甲醇的沸点比甲醛的高,其主要原因是____________________ ;
甲醛分子中碳原子轨道的杂化类型为_________ 。
②甲醛分子的空间构型是_________ ;
1mol甲醛分子中σ键的数目为_____ 。
③在1个Cu2O 晶胞中(结构如图所示),_______ 。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式
(2)根据等电子原理,写出CO分子的结构式
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O 沉淀。
①甲醇的沸点比甲醛的高,其主要原因是
甲醛分子中碳原子轨道的杂化类型为
②甲醛分子的空间构型是
1mol甲醛分子中σ键的数目为
③在1个Cu2O 晶胞中(结构如图所示),

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】如图所示是甲烷和白磷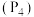 分子的空间结构示意图,请你把认为是化学键的改为实线(在图上改即可)。把碳原子涂成实心小圆球
分子的空间结构示意图,请你把认为是化学键的改为实线(在图上改即可)。把碳原子涂成实心小圆球_____ 。甲烷分子的空间结构是__________ (填“甲”或“乙”)图。从图中可看出,每个甲烷分子中有__________ 对共用电子对,而白磷分子中形成__________ 个共价键。

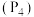 分子的空间结构示意图,请你把认为是化学键的改为实线(在图上改即可)。把碳原子涂成实心小圆球
分子的空间结构示意图,请你把认为是化学键的改为实线(在图上改即可)。把碳原子涂成实心小圆球
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】填写下列空白:
(1) 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为___________ ;  的空间构型为
的空间构型为___________ (用文字描述)。
(2)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+,NO以N原子与Fe2+形成配位键,请在指出[Fe(NO)(H2O)5]2+的配位体是___________ ,配位数为___________ 。
(3)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间结构为___________ ,C原子的杂化形式为___________ 。
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于苯,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500 ℃
试推断它们的晶体类型:A、___________ ;B、___________ ;C、___________ ;D、___________ 。
(1)
 中心原子轨道的杂化类型为
中心原子轨道的杂化类型为 的空间构型为
的空间构型为(2)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+,NO以N原子与Fe2+形成配位键,请在指出[Fe(NO)(H2O)5]2+的配位体是
(3)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间结构为
(4)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于苯,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500 ℃
试推断它们的晶体类型:A、
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为SO42-和NO3-,NOx也可在其他条件下被还原为N2。
(1)SO42-中心原子轨道的杂化类型为______ ;NO3-的空间构型为_____ (用文字描述)。
(2)Fe2+基态核外电子排布式为_______ 。
(3)与O3分子互为等电子体的一种阴离子为________ (填化学式)。
(4)(CN)2分子中σ键与π键的数目比n(σ)∶n(π)=________ 。
(1)SO42-中心原子轨道的杂化类型为
(2)Fe2+基态核外电子排布式为
(3)与O3分子互为等电子体的一种阴离子为
(4)(CN)2分子中σ键与π键的数目比n(σ)∶n(π)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】氮(N)形成的单质及它形成的化合物有重要的研究和应用价值,回答下列问题:
(1)已知NO 与CO2互为等电子体,NO
与CO2互为等电子体,NO 的结构式为
的结构式为_______ ,中心原子N的杂化方式为_______ 。
(2)NH4BF4(四氟硼酸铵)可用作铝或铜的焊接助熔剂,能腐蚀玻璃,有重要的化工用途。下列说法正确的是________ 。
(3)向硫酸铜溶液中通入过量氨气,得到深蓝色溶液,生成配合物[Cu(NH3)4]SO4,其中1mol阳离子[Cu(NH3)4]2+中含有σ键数目为________ 。向该深蓝色溶液中加入乙醇,得到深蓝色晶体,该深蓝色晶体为________ (填化学式)。
(4)请从结构角度解释HNO3的酸性比HNO2强的原因________ 。
(1)已知NO
 与CO2互为等电子体,NO
与CO2互为等电子体,NO 的结构式为
的结构式为(2)NH4BF4(四氟硼酸铵)可用作铝或铜的焊接助熔剂,能腐蚀玻璃,有重要的化工用途。下列说法正确的是
| A.核素15N的中子数为7 | B.F元素位于元素周期表p区 |
C.BF 的空间构型为正四面体形 的空间构型为正四面体形 | D.NH4BF4中存在离子键、共价键、氢键和范德华力 |
(4)请从结构角度解释HNO3的酸性比HNO2强的原因
您最近一年使用:0次


 +NH3。
+NH3。

