 催化剂可以催化
催化剂可以催化 脱除烟气中的
脱除烟气中的 。
。反应为:
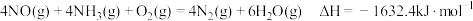
已知:①
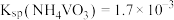 ;
;②草酸
 能与含钒粒子形成易溶于水的配合物。
能与含钒粒子形成易溶于水的配合物。(1)催化剂的制备。称取一定量的
 和
和 ,加入草酸溶液完全溶解。取一定量的
,加入草酸溶液完全溶解。取一定量的 粉末浸渍于上述混合溶液中,在
粉末浸渍于上述混合溶液中,在 水浴中搅拌、静置、过滤、焙烧、研磨后得到
水浴中搅拌、静置、过滤、焙烧、研磨后得到 催化剂。
催化剂。①焙烧时
 分解产生
分解产生 的化学方程式为
的化学方程式为②
 的作用是
的作用是(2)催化剂的应用。将模拟烟气以一定流速通过装有
 催化剂的反应管,反应相同时间,测得
催化剂的反应管,反应相同时间,测得 的转化率随温度的变化如题图1所示。
的转化率随温度的变化如题图1所示。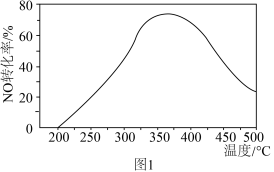
①反应温度高于
 ,
, 转化率下降的原因可能是
转化率下降的原因可能是②若烟气中含有
 ,则会导致催化剂失活,原因可能是
,则会导致催化剂失活,原因可能是(3)
 的回收。回收
的回收。回收 的过程可表示为:
的过程可表示为: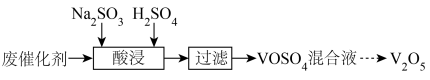
①酸浸时,投料完成后提高原料浸出率的措施有
②酸浸过程中,
 转化成
转化成 ,该反应的离子方程式为
,该反应的离子方程式为③水溶液中
 以
以 形式存在,如题图2所示给出了该离子部分结构,在
形式存在,如题图2所示给出了该离子部分结构,在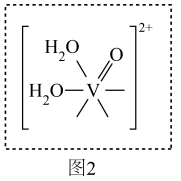
更新时间:2024-01-20 09:09:04
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】氮的化合物是造成大气污染的主要物质,研究有关反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g) 2NO2(g)△H,上述反应分两步完成,其反应历程如图所示:回答下列问题:
2NO2(g)△H,上述反应分两步完成,其反应历程如图所示:回答下列问题:

①写出反应I的热化学方程式______________ 。
②升高温度发现总反应2NO(g)+O2(g) 2NO2(g)的速率反而变慢,结合上图判断下列说法中正确的有
2NO2(g)的速率反而变慢,结合上图判断下列说法中正确的有_______ (反应未使用催化剂)。
A 反应I是快反应,反应II是慢反应 B 总反应的速率由反应I决定
C 升高温度平衡I、II均向逆反应方向移动 D 对于反应II,浓度的影响大于温度的影响
(2)用焦炭还原NO2的反应为2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
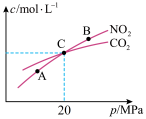
①A、B两点的浓度平衡常数关系:Kc(A)___ Kc(B)(填“<”“>”或“=”)
②A、B、C三点中NO2的转化率最低的是___ (填“A”“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=_______ (Kp是用平衡分压代替平衡浓度计算)
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入0.05 mol·L−1的Ca(OH)2乳浊液中,发生的反应为:3NO2 + 2OH-= NO +2NO3-+ H2O;NO + NO2 +2OH-= 2NO2- + H2O。改变 ,NOx的去除率如图所示:
,NOx的去除率如图所示:

① 的合适范围是
的合适范围是____ 。
②当 大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是
大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是____ 。
③O3和NO发生的主要反应为:NO + O3 = NO2 + O2。保持NO的初始浓度不变,改变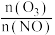 ,将反应后的混合气体通入0.05mol·L−1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则
,将反应后的混合气体通入0.05mol·L−1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则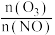 合适的值约为
合适的值约为_________ 。
a 0.6 b 0.8 c 1.4
(1)NO在空气中存在如下反应:2NO(g)+O2(g)
 2NO2(g)△H,上述反应分两步完成,其反应历程如图所示:回答下列问题:
2NO2(g)△H,上述反应分两步完成,其反应历程如图所示:回答下列问题:
①写出反应I的热化学方程式
②升高温度发现总反应2NO(g)+O2(g)
 2NO2(g)的速率反而变慢,结合上图判断下列说法中正确的有
2NO2(g)的速率反而变慢,结合上图判断下列说法中正确的有A 反应I是快反应,反应II是慢反应 B 总反应的速率由反应I决定
C 升高温度平衡I、II均向逆反应方向移动 D 对于反应II,浓度的影响大于温度的影响
(2)用焦炭还原NO2的反应为2NO2(g)+2C(s)
 N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B两点的浓度平衡常数关系:Kc(A)
②A、B、C三点中NO2的转化率最低的是
③计算C点时该反应的压强平衡常数Kp(C)=
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入0.05 mol·L−1的Ca(OH)2乳浊液中,发生的反应为:3NO2 + 2OH-= NO +2NO3-+ H2O;NO + NO2 +2OH-= 2NO2- + H2O。改变
 ,NOx的去除率如图所示:
,NOx的去除率如图所示:
①
 的合适范围是
的合适范围是②当
 大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是
大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是③O3和NO发生的主要反应为:NO + O3 = NO2 + O2。保持NO的初始浓度不变,改变
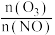 ,将反应后的混合气体通入0.05mol·L−1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则
,将反应后的混合气体通入0.05mol·L−1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则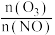 合适的值约为
合适的值约为a 0.6 b 0.8 c 1.4
您最近一年使用:0次
【推荐2】乙烯是重要的化工原料,常用来衡量石油化工发展水平。工业上有多种获得方式。
Ⅰ. 催化加氢法制乙烯:
催化加氢法制乙烯: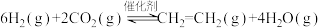

(1)已知: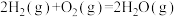
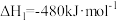 ;
;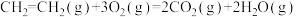
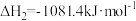 。则上述
。则上述 催化加氢反应中
催化加氢反应中
_______  。
。
(2)在三个容积均为1L的密闭容器中以不同的氢碳比[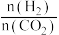 ]充入
]充入 和
和 ,在一定条件下发生上述反应:
,在一定条件下发生上述反应: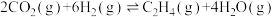 ,
, 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。 的平衡转化率随温度的升高而降低,其原因是
的平衡转化率随温度的升高而降低,其原因是_______ 氢碳比①_______ ②(填“>”“<”或“=”,下同),P、Q两点的化学平衡常数
_______ 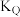 。
。
Ⅱ.电解法制乙烯:以铅蓄电池(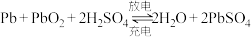 )为电源可将
)为电源可将 转化为乙烯,其原理如下图所示,电解所用电极材料均为惰性电极。
转化为乙烯,其原理如下图所示,电解所用电极材料均为惰性电极。_______ ,每生成0.5mol乙烯,理论上需消耗铅蓄电池中_______ mol硫酸。
Ⅲ.乙烷裂解制乙烯: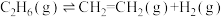
(4)乙烷裂解制乙烯时易发生副反应: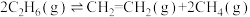 。已知在一定温度下,在恒容密闭容器中充入
。已知在一定温度下,在恒容密闭容器中充入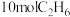 进行反应,达到平衡时
进行反应,达到平衡时 和
和 的体积分数均为
的体积分数均为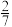 ,则乙烷的总转化率为
,则乙烷的总转化率为_______ ,将裂解产物通过足量溴水后,再完全燃烧,将生成的气体通入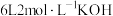 溶液中,所得溶液中
溶液中,所得溶液中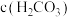
_______ 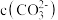 。(填“>”“<”或“=”)
。(填“>”“<”或“=”)
Ⅰ.
 催化加氢法制乙烯:
催化加氢法制乙烯: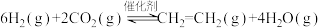

(1)已知:
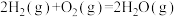
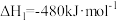 ;
;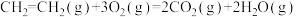
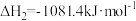 。则上述
。则上述 催化加氢反应中
催化加氢反应中
 。
。(2)在三个容积均为1L的密闭容器中以不同的氢碳比[
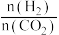 ]充入
]充入 和
和 ,在一定条件下发生上述反应:
,在一定条件下发生上述反应: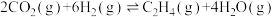 ,
, 的平衡转化率随温度的变化如图所示。
的平衡转化率随温度的变化如图所示。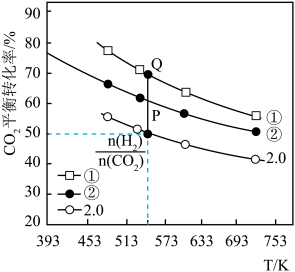
 的平衡转化率随温度的升高而降低,其原因是
的平衡转化率随温度的升高而降低,其原因是
 。
。Ⅱ.电解法制乙烯:以铅蓄电池(
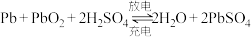 )为电源可将
)为电源可将 转化为乙烯,其原理如下图所示,电解所用电极材料均为惰性电极。
转化为乙烯,其原理如下图所示,电解所用电极材料均为惰性电极。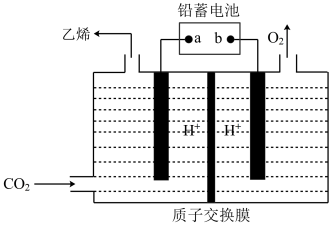
Ⅲ.乙烷裂解制乙烯:
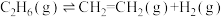
(4)乙烷裂解制乙烯时易发生副反应:
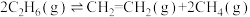 。已知在一定温度下,在恒容密闭容器中充入
。已知在一定温度下,在恒容密闭容器中充入 进行反应,达到平衡时
进行反应,达到平衡时 和
和 的体积分数均为
的体积分数均为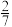 ,则乙烷的总转化率为
,则乙烷的总转化率为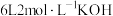 溶液中,所得溶液中
溶液中,所得溶液中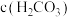
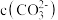 。(填“>”“<”或“=”)
。(填“>”“<”或“=”)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】开发、使用清洁能源发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:
①2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH1= -1275.6 kJ·mol-1
②2CO(g)+O2(g) = 2CO2(g) ΔH2= -566.0 kJ·mol-1
③H2O(g) = H2O(l) ΔH3= -44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______ 。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0
①该反应的平衡常数表达式K=_______ ,一定条件下CH4的平衡转化率与温度、压强的关系如图。则T1_______ T2 (填“<”或“>”或“=”)。
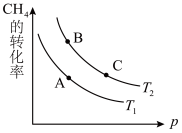
②120℃时,将1 mol CH4和2 mol H2O(g)通入容积为1 L的密闭容器中发生反应,不能 说明该反应已经达到平衡状态的是_______ 。
a.容器内气体密度恒定
b.混合气体的相对分子质量恒定
c.容器内的压强恒定
d.3V正(CH4)=V逆(H2)
e.单位时间内消耗0.3 mol CH4同时生成0.9mol H2
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图所示的电池装置,则该电池负极的电极反应式为_______ 。当有4mol电子通过导线时,消耗标准状况下的O2体积为_______ L。

(1)已知:
①2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g) ΔH1= -1275.6 kJ·mol-1
②2CO(g)+O2(g) = 2CO2(g) ΔH2= -566.0 kJ·mol-1
③H2O(g) = H2O(l) ΔH3= -44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(2)生产甲醇的原料CO和H2来源于:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0
①该反应的平衡常数表达式K=

②120℃时,将1 mol CH4和2 mol H2O(g)通入容积为1 L的密闭容器中发生反应,
a.容器内气体密度恒定
b.混合气体的相对分子质量恒定
c.容器内的压强恒定
d.3V正(CH4)=V逆(H2)
e.单位时间内消耗0.3 mol CH4同时生成0.9mol H2
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图所示的电池装置,则该电池负极的电极反应式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】某兴趣小组用铝箔制备纳米Al2O3、AlCl3·6H2O及铵明矾晶体【NH4Al(SO4)2•12H2O,摩尔质量为453g•mol-1】,具体流程如图:
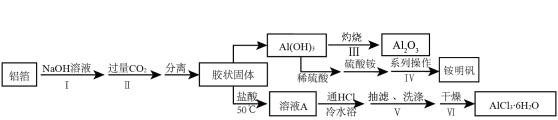
已知:a.AlCl3·6H2O易溶于水、乙醇及乙醚;
b.铵明矾晶体无色、透明,可溶于水、不溶于乙醇。120℃时失去结晶水,280℃以上分解。
请回答:
(1)步骤Ⅰ的离子方程式为______ 。
(2)下列操作或描述正确的是_____ 。
A.步骤IV制备铵明矾利用了物质的溶解度差异
B.步骤III灼烧时需将氢氧化铝放在蒸发皿里用高温炉灼烧至恒重
C.步骤II生成的固体可用抽滤法分离,为加快过滤速度,可用玻璃棒轻轻搅拌
D.步骤IV中可以选择乙醇洗涤晶体,如果在常压下快速干燥,温度选择低于120℃
(3)由溶液A制备AlCl3·6H2O的过程中要通入HCl气体,其作用是______ (写两条)。
(4)步骤V抽滤时不能用滤纸,原因是_____ 。若用如图装置图进行抽滤,则抽滤结束时应进行的操作是______ 。

(5)用电子天平称取2.760g的铵明矾粗产品,用水溶解后取相同体积的两份溶液。第一份用EDTA滴定法测得n(Al3+)为0.002900mol;第二份用BaCl2溶液滴定法测得n(SO42-)为0.006300mol。则该试样中铵明矾的纯度为______ 。

已知:a.AlCl3·6H2O易溶于水、乙醇及乙醚;
b.铵明矾晶体无色、透明,可溶于水、不溶于乙醇。120℃时失去结晶水,280℃以上分解。
请回答:
(1)步骤Ⅰ的离子方程式为
(2)下列操作或描述正确的是
A.步骤IV制备铵明矾利用了物质的溶解度差异
B.步骤III灼烧时需将氢氧化铝放在蒸发皿里用高温炉灼烧至恒重
C.步骤II生成的固体可用抽滤法分离,为加快过滤速度,可用玻璃棒轻轻搅拌
D.步骤IV中可以选择乙醇洗涤晶体,如果在常压下快速干燥,温度选择低于120℃
(3)由溶液A制备AlCl3·6H2O的过程中要通入HCl气体,其作用是
(4)步骤V抽滤时不能用滤纸,原因是

(5)用电子天平称取2.760g的铵明矾粗产品,用水溶解后取相同体积的两份溶液。第一份用EDTA滴定法测得n(Al3+)为0.002900mol;第二份用BaCl2溶液滴定法测得n(SO42-)为0.006300mol。则该试样中铵明矾的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】亚硝酸和亚硝酸盐在生产、医药等领域有着广泛应用。某校化学兴趣小组用下图所示仪器(夹持装置已省略)及药品,探究硫酸与亚硝酸钠反应生成气体的成分。已知 和NO液化温度分别为21℃和-152℃。
和NO液化温度分别为21℃和-152℃。
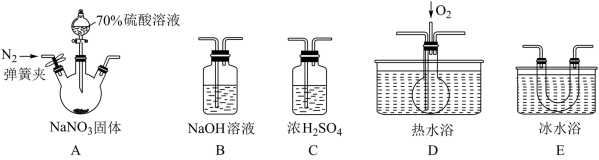
请回答下列问题:
(1)反应前通入氮气的目的是___________ 。装置的连接顺序(按左→右连接)为A→___________ →___________ →___________ →B。
(2)在关闭弹簧夹,打开分液漏斗活塞、滴入70%硫酸溶液后,A中产生红棕色气体。确认A中产生的气体含有 依据的现象是
依据的现象是___________ 。
(3)装置A中反应的化学方程式为___________ 。
(4)如果没有装置C,对实验结论造成的影响是___________ 。
 和NO液化温度分别为21℃和-152℃。
和NO液化温度分别为21℃和-152℃。
请回答下列问题:
(1)反应前通入氮气的目的是
(2)在关闭弹簧夹,打开分液漏斗活塞、滴入70%硫酸溶液后,A中产生红棕色气体。确认A中产生的气体含有
 依据的现象是
依据的现象是(3)装置A中反应的化学方程式为
(4)如果没有装置C,对实验结论造成的影响是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】实验室由铁泥(主要成分为铁的氧化物)制备软磁性材料α-Fe2O3。其主要实验流程如下:

(1)酸浸。用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有_________ (填序号)。
A.适当升高酸浸温度 B.适当缩短酸浸时间 C.适当加快搅拌速度
(2)还原。向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成_______ (填化学式);检验Fe3+是否还原完全的实验操作是_______ 。
(3)除杂。向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是_________ 。[Ksp(CaF2)=5.3×10-9、Ka(HF)=6.3×10-4]
(4)沉铁。将提纯后的FeSO4溶液与NH3·H2O-NH4HCO3混合溶液反应,生成FeCO3沉淀。生成FeCO3沉淀的离子方程式为____________________________________ 。

(1)酸浸。用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有
A.适当升高酸浸温度 B.适当缩短酸浸时间 C.适当加快搅拌速度
(2)还原。向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成
(3)除杂。向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低、将会导致CaF2沉淀不完全,其原因是
(4)沉铁。将提纯后的FeSO4溶液与NH3·H2O-NH4HCO3混合溶液反应,生成FeCO3沉淀。生成FeCO3沉淀的离子方程式为
您最近一年使用:0次



