学习“化学反应的速率和化学平衡”内容后,联系工业生产实际所发表的观点,你认为正确的是
| A.化学反应速率理论可指导怎样提高原料的平衡转化率 |
| B.化学平衡理论可指导怎样使用有限原料多出产品 |
| C.温度升高,分子动能增加,反应所需活化能减少,反应速率增大 |
| D.增大压强能提高活化分子的百分率,提高单位时间内分子有效碰撞次数 |
更新时间:2024-01-24 06:53:45
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】下列说法不正确 的是
| A.其他条件不变时,加入反应物,活化分子百分数增大,化学反应速率增大 |
| B.其他条件不变时,升高温度,活化分子百分数增大,化学反应速率增大 |
| C.其他条件不变时,增大气体压强,活化分子百分数不变,化学反应速率增大 |
| D.其他条件不变时,使用催化剂,活化分子百分数增大,化学反应速率增大 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】对于在一定条件下进行的化学反应,改变下列条件,可以提高反应物中的活化分子百分数的是
①升高温度②加入催化剂③增大体系压强④增大反应物浓度
①升高温度②加入催化剂③增大体系压强④增大反应物浓度
| A.①② | B.②③ | C.③④ | D.①④ |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】在常温常压下,向FeCl3溶液中滴入KSCN溶液,发生以下反应:FeCl3+3KSCN⇌Fe(SCN)3+3KCl,所得溶液显红色。改变下列条件,能使平衡逆向移动的是
| A.向溶液中加入少量KCl晶体 | B.向溶液中加入少量NaOH溶液 |
| C.向溶液中滴入数滴浓FeCl3溶液 | D.设法移走溶液中少量水 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列事实可以用勒夏特列原理解释的是
| A.高锰酸钾溶液与草酸发生化学反应刚开始缓慢,随后反应迅速加快 |
B.实验室采用排饱和食盐水的方法收集氯气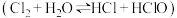 |
C. 左右的温度比室温更有利于合成氮反应 左右的温度比室温更有利于合成氮反应 |
| D.氯化铁溶液加铁粉后颜色变浅 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】工业合成氨和制硫酸中SO2催化氧化的生产过程的说法中,错误的是
| A.都使用了催化剂 | B.都选择了较高温度 |
| C.都按方程式的系数比投料 | D.合成氨采用高压;合成SO3采用常压 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】对于反应2SO2(g)+O2(g)  2SO3(g);ΔH=-196.6 kJ·mol−1,下列说法正确的是
2SO3(g);ΔH=-196.6 kJ·mol−1,下列说法正确的是
 2SO3(g);ΔH=-196.6 kJ·mol−1,下列说法正确的是
2SO3(g);ΔH=-196.6 kJ·mol−1,下列说法正确的是| A.反应物的总键能大于生成物的总键能 |
B.反应的平衡常数可表示为K=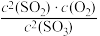 |
| C.从平衡体系中分离出SO3,正反应速率变快 |
| D.工业生产采用常压操作,可能是因为常压下SO2的转化率已经很高了 |
您最近一年使用:0次




 的平衡转化率:历程II>历程I
的平衡转化率:历程II>历程I

