卤素在高分子材料及电子电气等领域都有广泛应用。
(1)卤族元素位于元素周期表的___________ 区,基态溴原子的价层电子排布式为___________ 。
(2)比较键角大小:NH3___________ NF3(填“>”“<”或“=”)。
(3)已知下列5种羧酸:①CF3COOH②CH3COOH③CH2FCOOH④CH2ClCOOH⑤CH3CH2COOH,其酸性由强到弱的顺序为①___________ (填序号)。
(4)已知:由于 中甲基的推电子诱导效应,π电子离1号碳更近,H+倾向于与电子密度更高的1号碳结合,丙烯与HCl加成的主产物为CH3CHClCH3.,CF3CH=CH2与HCl加成反应主产物的结构简式为
中甲基的推电子诱导效应,π电子离1号碳更近,H+倾向于与电子密度更高的1号碳结合,丙烯与HCl加成的主产物为CH3CHClCH3.,CF3CH=CH2与HCl加成反应主产物的结构简式为___________ 。
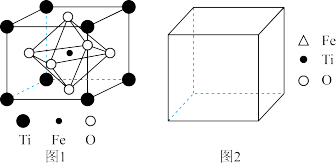
(5)图1为气态氯化铍,图2为固态氯化铍。
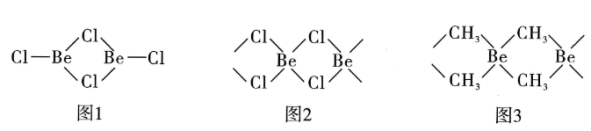
①气态氯化铍为___________ (填“极性”或“非极性”)分子。氯化铍由气态转化为固态,Be的杂化方式由___________ 转化为___________ 。
②若将固态氯化铍中的Cl原子替换为甲基,可形成如图3化合物。1个甲基与2个Be原子形成共价键时所提供的电子数为___________ 。
(1)卤族元素位于元素周期表的
(2)比较键角大小:NH3
(3)已知下列5种羧酸:①CF3COOH②CH3COOH③CH2FCOOH④CH2ClCOOH⑤CH3CH2COOH,其酸性由强到弱的顺序为①
(4)已知:由于
 中甲基的推电子诱导效应,π电子离1号碳更近,H+倾向于与电子密度更高的1号碳结合,丙烯与HCl加成的主产物为CH3CHClCH3.,CF3CH=CH2与HCl加成反应主产物的结构简式为
中甲基的推电子诱导效应,π电子离1号碳更近,H+倾向于与电子密度更高的1号碳结合,丙烯与HCl加成的主产物为CH3CHClCH3.,CF3CH=CH2与HCl加成反应主产物的结构简式为(5)图1为气态氯化铍,图2为固态氯化铍。

①气态氯化铍为
②若将固态氯化铍中的Cl原子替换为甲基,可形成如图3化合物。1个甲基与2个Be原子形成共价键时所提供的电子数为
更新时间:2024-02-19 14:45:56
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】铝、铁、铜等金属在日常生活中应用广泛,钛由于其特殊的性能被誉为“未来世纪的金属”。
(1)下列有关说法正确的是_______。
(2)氯化铝熔点很低,加热容易升华。
①基态Al原子的价层电子排布式为_______ 。
②固态 加热升华后以二聚物
加热升华后以二聚物 形式存在,
形式存在, 中铝原子的杂化形式为
中铝原子的杂化形式为_______ 。
(3)甘氨酸亚铁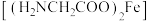 可用于改善缺铁性贫血。
可用于改善缺铁性贫血。 中电子占据最高能级的空间运动状态有
中电子占据最高能级的空间运动状态有_______ 个。甘氨酸亚铁中位于第二周期的非金属元素的第一电离能由大到小的顺序为_______ 。
(4)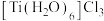 和
和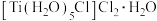 是
是 六水合物的两种晶体,这两种晶体所含元素的电负性由大到小的顺序为
六水合物的两种晶体,这两种晶体所含元素的电负性由大到小的顺序为_______ 。
(5) 晶体的晶胞如图所示:
晶体的晶胞如图所示:
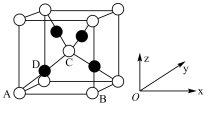
该晶胞中原子坐标参数A为 ;B为
;B为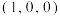 ;C为
;C为 。则D的原子坐标参数为
。则D的原子坐标参数为_______ 。
(1)下列有关说法正确的是_______。
| A.铜元素焰色反应的光谱为吸收光谱 |
| B.铝晶体中的作用力没有方向性和饱和性 |
| C.在单质或化合物中,铁的配位数都是6 |
| D.四水合铜离子中,配位原子的VSEPR模型为V形 |
①基态Al原子的价层电子排布式为
②固态
 加热升华后以二聚物
加热升华后以二聚物 形式存在,
形式存在, 中铝原子的杂化形式为
中铝原子的杂化形式为(3)甘氨酸亚铁
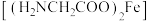 可用于改善缺铁性贫血。
可用于改善缺铁性贫血。 中电子占据最高能级的空间运动状态有
中电子占据最高能级的空间运动状态有(4)
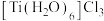 和
和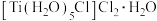 是
是 六水合物的两种晶体,这两种晶体所含元素的电负性由大到小的顺序为
六水合物的两种晶体,这两种晶体所含元素的电负性由大到小的顺序为(5)
 晶体的晶胞如图所示:
晶体的晶胞如图所示:
该晶胞中原子坐标参数A为
 ;B为
;B为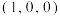 ;C为
;C为 。则D的原子坐标参数为
。则D的原子坐标参数为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】元素周期表中第四周期的某些元素在生产、生活中有着广泛的应用。
(1)硒常用作光敏材料,基态硒原子的价电子排布图为__________ ;与硒同周期的p区元素中第一电离能大于硒的元素有__________ 种;SeO3的空间构型是_______________ 。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu—Ni—Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________________________________ 。
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2。(SCN)2分子中硫原子的杂化方式是__________________ ,σ键和π键数目之比为_____________ 。
(4)Co(NH3)5Cl3是钴的一种配合物,向100mL0.2mol·L-1该配合物的溶液中加入足量AgNO3溶液,生成5.74g白色沉淀,则该配合物的化学式为_____________ ,中心离子的配位数为________________ 。
(5)已知:r(Fe2+)为61pm,r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是__________________________________ 。
(6)某离子型铁的氧化物晶胞如下图所示,它由X、Y组成,则该氧化物的化学式为________________________ 。已知该晶体的密度为dg·cm-3,阿伏伽德罗常数的值为NA,则该晶体的晶胞参数a=_______ pm(用含d和NA的代数式表示)。

(1)硒常用作光敏材料,基态硒原子的价电子排布图为
(2)科学家在研究金属矿物质组分的过程中,发现了Cu—Ni—Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2。(SCN)2分子中硫原子的杂化方式是
(4)Co(NH3)5Cl3是钴的一种配合物,向100mL0.2mol·L-1该配合物的溶液中加入足量AgNO3溶液,生成5.74g白色沉淀,则该配合物的化学式为
(5)已知:r(Fe2+)为61pm,r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是
(6)某离子型铁的氧化物晶胞如下图所示,它由X、Y组成,则该氧化物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,近年来,人们对这些颜料的成分进行了研究,发现其成分主要为BaCuSi4O10、BaCuSi2O6
(1)颜料中含有Cu元素,基态Cu原子的价电子排布式为___________ ;Si、O、Ba元素电负性由大到小的顺序为_____ ,干冰、Si、SiC熔点由高到低的顺序为_____________ 。
(2)“中国蓝”的发色中心是以Cu2+为中心离子的配位化合物,其中提供孤电子对的是_______ 元素。
(3)铜可作CH3CH2OH氧化生成CH3CHO的催化剂。乙醇的沸点高于乙醛,其主要原因是_____________________________ 。
(4)C、N元素与颜料中的氧元素同周期。
①写出CO的一种常见等电子体分子的电子式________________ ;C、N、O的第一电离能由大到小的顺序为__________________________________ 。
②C、N元素能形成一种类石墨的聚合物半导体g-C3N4其单层平面结构如图1,晶胞结构如图2。
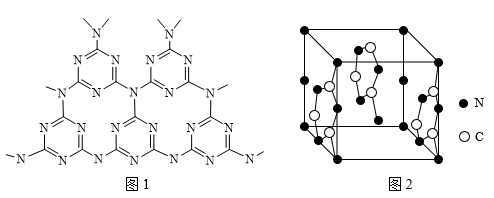
ⅰ.g-C3N4中氮原子的杂化类型是___________________ 。
ⅱ.根据图2,在图1中用平行四边形画出一个最小重复单元_____________ 。
ⅲ.已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g- C3N4的密度为___________________ 。
(1)颜料中含有Cu元素,基态Cu原子的价电子排布式为
(2)“中国蓝”的发色中心是以Cu2+为中心离子的配位化合物,其中提供孤电子对的是
(3)铜可作CH3CH2OH氧化生成CH3CHO的催化剂。乙醇的沸点高于乙醛,其主要原因是
(4)C、N元素与颜料中的氧元素同周期。
①写出CO的一种常见等电子体分子的电子式
②C、N元素能形成一种类石墨的聚合物半导体g-C3N4其单层平面结构如图1,晶胞结构如图2。

ⅰ.g-C3N4中氮原子的杂化类型是
ⅱ.根据图2,在图1中用平行四边形画出一个最小重复单元
ⅲ.已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g- C3N4的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】四方晶系CuFeTe2晶体是一种p型半导体,在太阳能半导体薄膜中具有巨大的潜在应用价值,其晶胞示意图如图a、图b所示。
(1)基态Cu原子的价电子排布式为___________ ;
(2)H2S中S的杂化方式为___________ ;H2O、H2Te、H2S沸点依次降低的原因是___________ 。
(3)CuFeTe2中元素的电负性由大到小的顺序为___________ ;Te的配位数为___________ 。
(4)向CuFeTe2中掺杂S原子会改善半导体性能。由图(c)可知x=___________ ;掺杂后晶胞参数分别为apm,apm,cpm,设NA为阿伏加德罗常数的值。晶体CuFe(SxTe1-x)的密度为___________ g/cm3(用含a、c和NA的代数式表示)。
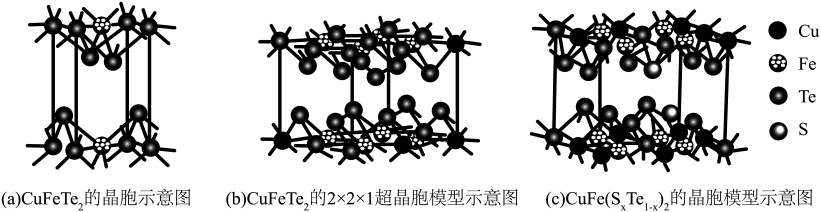
(1)基态Cu原子的价电子排布式为
(2)H2S中S的杂化方式为
(3)CuFeTe2中元素的电负性由大到小的顺序为
(4)向CuFeTe2中掺杂S原子会改善半导体性能。由图(c)可知x=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】12月 17日凌晨,嫦娥五号完成“ 挖土” 之旅返回地球。查阅资料,月球玄武岩是构成月球的岩石之一,主要由辉石(主要成分硅酸盐)和钛铁矿(主要成分 FeTiO3)等组成。回答下列问题:
(1)基态铁原子的价电子排布式为:______ 。
(2)与 Fe同周期,且最外层电子数相同的主族元素是______ (填元素符号)。
(3)基态 Ti原子核外电子占据的最高能层符号为______ ;其最外层电子的电子云轮廓图为______ 。
(4)1molFe3[Fe(CN)6]2中含有 σ键数为______ ,[Fe(CN)6]3-中配体为______ ,其中 C原子的杂化轨道类型为______ ,H、C、N、Si四种元素的电负性由大到小的顺序为______ 。
(5)FeTiO3的结构如图 1所示,其中由 O围成的______ (填“ 四面体空隙” 或“ 八面体空隙” )被 Fe占据。在图 2中画出 FeTiO3结构的另一种表示______ (要求:Fe处于晶胞的顶点),Ti的配位数为______ 。
(6)已知该晶胞的密度为 ρg/cm3,NA表示阿伏加德罗常数的值。计算晶胞参数 a=______ pm。(列出计算表达式)
(1)基态铁原子的价电子排布式为:
(2)与 Fe同周期,且最外层电子数相同的主族元素是
(3)基态 Ti原子核外电子占据的最高能层符号为
(4)1molFe3[Fe(CN)6]2中含有 σ键数为
(5)FeTiO3的结构如图 1所示,其中由 O围成的
(6)已知该晶胞的密度为 ρg/cm3,NA表示阿伏加德罗常数的值。计算晶胞参数 a=

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】铁、钴、镍三种元素位于元素周期表中第4周期第Ⅷ族,通常将铁钴镍三种元素称为铁系元素,请回答:
(1)基态镍原子的价层电子排布式___________
(2)已知无水三氯化铁熔点为307.6℃,沸点约为306℃,可以升华,400℃以下的气态氯化铁主要通过配位键以二聚体形式存在,据此判断氯化铁的晶体类型___________ ,氯化铁二聚体的结构式是___________
(3)铁系元素易通过配位键形成各种多环系化合物,钴酞菁是其中的一种。图1是酞菁和钴酞菁的分子结构,酞菁分子中所有原子共平面,下列说法正确的是___________

(4)邻苯二甲酸酐(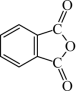 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(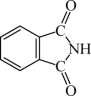 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是___________ 。
(5)下图为一种常见锂离子电池电极材料的六棱柱结构单元及其沿垂直底面方向的投影图,其底面是正六边形 。
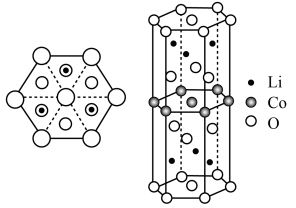
①该电极材料物质的化学式为___________ 。
②该晶体中Li原子周围距离最近且相等的O原子有___________ 个。
(1)基态镍原子的价层电子排布式
(2)已知无水三氯化铁熔点为307.6℃,沸点约为306℃,可以升华,400℃以下的气态氯化铁主要通过配位键以二聚体形式存在,据此判断氯化铁的晶体类型
(3)铁系元素易通过配位键形成各种多环系化合物,钴酞菁是其中的一种。图1是酞菁和钴酞菁的分子结构,酞菁分子中所有原子共平面,下列说法正确的是___________

| A.标注①②的N原子的杂化方式是sp2,③的N原子的杂化方式sp3 |
| B.钴酞菁中元素的电负性由大到小顺序为:N>C>H>Co |
| C.钴酞菁中钴元素的化合价是+2 |
| D.钴酞菁中的作用力有:离子键、氢键、配位键、π键、σ键 |
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是(5)下图为一种常见锂离子电池电极材料的六棱柱结构单元及其沿垂直底面方向的投影图,其底面是

①该电极材料物质的化学式为
②该晶体中Li原子周围距离最近且相等的O原子有
您最近一年使用:0次
【推荐1】[选修3——物质结构与性质] 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)在Y的最高价氧化物分子中,Y原子轨道的杂化类型是_______________ 。
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是_______________________ ;Z的氢化物在固态时的密度比在液态时还小,其原因是_________
(3)Y与Z可形成YZ42-。
①YZ42-的空间构型为________________ (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式:_________________ 。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为_______ 。
(5)X与Y所形成化合物晶体的晶胞如图所:
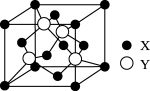
①在该晶体中,X离子的配位数为__________ ,与Y距离最近且距离相等的Y原子的数目为________ 。
②该晶胞的边长为a cm,该晶体的密度为__________________ g·cm-3。
(1)在Y的最高价氧化物分子中,Y原子轨道的杂化类型是
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是
(3)Y与Z可形成YZ42-。
①YZ42-的空间构型为
②写出一种与YZ42-互为等电子体的分子的化学式:
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为
(5)X与Y所形成化合物晶体的晶胞如图所:

①在该晶体中,X离子的配位数为
②该晶胞的边长为a cm,该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】翡翠是一类名贵的装饰品,其主要成分为硅酸铝钠(NaAlSi2O6),常含微量Cr、Ni、Mn等元素。回答下列问题:
(1)基态硅原子的电子排布式为__ ;基态铬原子的价电子排布图不能写成 形式,其原因是违背了
形式,其原因是违背了___ 。
(2)NaAlSi2O6中四种元素第一电离能由大到小的顺序为___ (填元素符号),灼烧硅酸铝钠时,当钠元素的价电子由__ (填“激发态”或“基态”)跃迁到另一状态时产生黄色火焰。
(3)工业上冶炼金属铝的方程式为__ 。硅与碳类似,能与氢元素形成SiH4、Si2H4、Si3H8,此三种分子中硅原子为sp3杂化的有___ ;分子空间构型属于正四面体的是__ 。
(4)已知氧化钠、氧化铝的熔点分别为1132℃、2054℃,从结构的角度解释导致这种差异的主要原因:___ 。
(5)某N、Cr元素组成的化合物具有高的硬度和良好的耐磨性,是一种很受重视的耐磨涂层,其晶胞结构如图甲,图乙为晶胞沿z轴投影图,该化合物的化学式为__ 。知该晶体密度为ρg·cm-3。晶体中Cr原子和N的最近核间距为___ pm(NA表示阿伏加德罗常数值)。
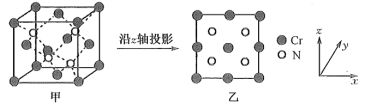
(1)基态硅原子的电子排布式为
 形式,其原因是违背了
形式,其原因是违背了(2)NaAlSi2O6中四种元素第一电离能由大到小的顺序为
(3)工业上冶炼金属铝的方程式为
(4)已知氧化钠、氧化铝的熔点分别为1132℃、2054℃,从结构的角度解释导致这种差异的主要原因:
(5)某N、Cr元素组成的化合物具有高的硬度和良好的耐磨性,是一种很受重视的耐磨涂层,其晶胞结构如图甲,图乙为晶胞沿z轴投影图,该化合物的化学式为

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】二氯化二硫(S2Cl2)在工业上常用作橡胶的低温硫化剂。某小组利用单质S与少量Cl2在110-140℃条件下反应合成S2Cl2,查阅有关资料后,得到如下信息:
设计如图所示实验装置(部分夹持装置、加热装置均已略去):
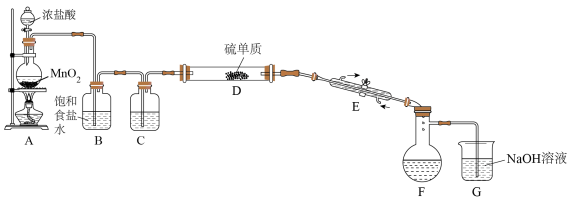
回答下列问题:
(1)仪器E的名称为___________
(2)实验过程中,需要控制装置D的温度,温度不宜过高的原因是___________
判断反应已进行完全的实验现象是___________
(3)S2Cl2与H2O2结构相似,推测S2Cl2为___________ 分子(填“极性”“非极性”),S的杂化类型为___________
(4)有同学认为该装置存在一定的缺陷,指出存在的问题并提出改进方案:___________
(5)取F中黄色液体mg于锥形瓶,加水至反应完全(假设杂质均不与水反应),向所得液中加入过量的c1mol/L的AgNO3溶液V1mL,再向锥形瓶中加入硝基苯,将生成的沉淀覆盖,加入适量Fe(NO3)3作指示剂,用c2mol/LNaSCN溶液滴定至终点,消耗NaSCN溶液V2mL(滴定过程发生反应:Ag++SCN-=AgSCN↓)
①S2Cl2遇水反应,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原色,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式:___________
②滴定终点的现象为___________
③S2Cl2的纯度为___________ (写出表达式),滴定过程中加入硝基苯将生成的沉淀覆盖,这样操作的目的是___________ 。
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 113 | 445 | ___________ |
| S2Cl2 | -80 | 138 | ①常温下,为黄红色液体,能与水反应 ②300℃以上完全分解 ③在加热条件下会被Cl2氧化成+2价硫 |

回答下列问题:
(1)仪器E的名称为
(2)实验过程中,需要控制装置D的温度,温度不宜过高的原因是
判断反应已进行完全的实验现象是
(3)S2Cl2与H2O2结构相似,推测S2Cl2为
(4)有同学认为该装置存在一定的缺陷,指出存在的问题并提出改进方案:
(5)取F中黄色液体mg于锥形瓶,加水至反应完全(假设杂质均不与水反应),向所得液中加入过量的c1mol/L的AgNO3溶液V1mL,再向锥形瓶中加入硝基苯,将生成的沉淀覆盖,加入适量Fe(NO3)3作指示剂,用c2mol/LNaSCN溶液滴定至终点,消耗NaSCN溶液V2mL(滴定过程发生反应:Ag++SCN-=AgSCN↓)
①S2Cl2遇水反应,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原色,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式:
②滴定终点的现象为
③S2Cl2的纯度为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】锗广泛应用于现代高新技术产业。某科研小组用氧化锌烟尘(主要成分为ZnO,含有ZnFe2O4、PbO、GeO2、GeS2、SiO2及少量As的化合物等)制取锗并回收锌的一种流程如下:
(1)浸渣的主要成分有S、PbSO4和___________ ;“浸出”后,锗元素以Ge4+形式存在于溶液中,写出“浸出”时GeS2所发生的离子反应方程式___________ 。
(2)单宁酸(H2L)“沉锗”时主要发生反应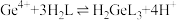 ,最佳pH=2.5,pH过低会导致
,最佳pH=2.5,pH过低会导致___________ ,使沉锗率下降;为提高沉锗速率,可采取的措施有___________ (写一种即可)。
(3)“蒸馏”得到的粗GeCl4中混有少量AsCl3杂质,二者均为分子晶体,AsCl3的空间结构为___________ ,其沸点高于GeCl4,原因是___________ 。(相对分子质量GeCl4:214.6,AsCl3:181.4)。
(4)碱浸“电解”法可生产出高质量的锌粉:先加入浓NaOH溶液将Zn2+转化为 ,再电解得到锌,
,再电解得到锌, 中与Zn2+配位的原子是
中与Zn2+配位的原子是___________ ,写出电解析出锌的电极反应___________ 。

(1)浸渣的主要成分有S、PbSO4和
(2)单宁酸(H2L)“沉锗”时主要发生反应
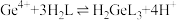 ,最佳pH=2.5,pH过低会导致
,最佳pH=2.5,pH过低会导致(3)“蒸馏”得到的粗GeCl4中混有少量AsCl3杂质,二者均为分子晶体,AsCl3的空间结构为
(4)碱浸“电解”法可生产出高质量的锌粉:先加入浓NaOH溶液将Zn2+转化为
 ,再电解得到锌,
,再电解得到锌, 中与Zn2+配位的原子是
中与Zn2+配位的原子是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】第四周期的过渡元素许多金属能形成配合物,请回答下列问题:
(1)Mn的核外价电子排布式为___________ 。
(2)向 溶液中滴入
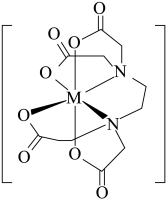
溶液中滴入 (乙二胺四乙酸)(配体为
(乙二胺四乙酸)(配体为 价阴离子)试剂(调节一定的PH)可得配合物A,其配离子结构如图所示,(M代表Zn)则一个
价阴离子)试剂(调节一定的PH)可得配合物A,其配离子结构如图所示,(M代表Zn)则一个 与
与___________ 个原子之间形成的配位键,图中配体的化学式为___________ 。
(3)配合物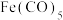 的熔点为
的熔点为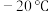 ,沸点为
,沸点为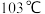 。可用于制备纯铁。
。可用于制备纯铁。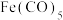 的结构如图所示。下列关于
的结构如图所示。下列关于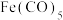 的说法正确的是___________(填字母)。
的说法正确的是___________(填字母)。
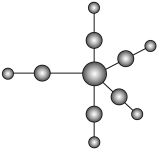
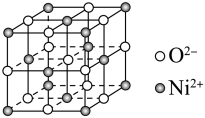
(4)已知NiO的晶体结构(如图所示), ,
, 的离子半径分别为69pm和14pm,已知邻近同种离子不相切,异种离子相切,则图中
的离子半径分别为69pm和14pm,已知邻近同种离子不相切,异种离子相切,则图中___________ (填“可以”或“不可以”)看作8个晶胞堆积而成,NiO晶体的密度是___________  (列出计算式即可)。
(列出计算式即可)。
(1)Mn的核外价电子排布式为
(2)向
 溶液中滴入
溶液中滴入 (乙二胺四乙酸)(配体为
(乙二胺四乙酸)(配体为 价阴离子)试剂(调节一定的PH)可得配合物A,其配离子结构如图所示,(M代表Zn)则一个
价阴离子)试剂(调节一定的PH)可得配合物A,其配离子结构如图所示,(M代表Zn)则一个 与
与
(3)配合物
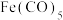 的熔点为
的熔点为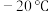 ,沸点为
,沸点为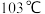 。可用于制备纯铁。
。可用于制备纯铁。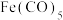 的结构如图所示。下列关于
的结构如图所示。下列关于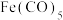 的说法正确的是___________(填字母)。
的说法正确的是___________(填字母)。
| A.C的电负性小于O |
B.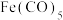 是非极性分子,CO是极性分子 是非极性分子,CO是极性分子 |
C.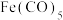 中Fe原子以 中Fe原子以 杂化方式与CO成键 杂化方式与CO成键 |
D.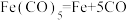 反应中没有新化学键生成 反应中没有新化学键生成 |
 ,
, 的离子半径分别为69pm和14pm,已知邻近同种离子不相切,异种离子相切,则图中
的离子半径分别为69pm和14pm,已知邻近同种离子不相切,异种离子相切,则图中 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】W、X、Y、Z、R为原子序数依次增大的短周期主族元素,W的核外电子只有一种自旋方向;Y、Z、R在元素周期表中相邻,X的核外电子数与Y的价层电子数相等,R2是氧化性最强的单质,回答下列问题:
(1)由X原子核形成的三种微粒,电子排布式分别为:①1s22s2、②1s22s22p1、③1s22s12p2,有关这些微粒的叙述正确的是___________ (填标号)。
a.得电子能力:②>① b.表示基态原子(或离子)的是:①②
c.微粒半径:①>② d.电离一个电子所需最低能量:①>②>③
(2)YR3是一种重要的电子工业材料。分子的极性:YR3___________ XR3(填“>”或“<”或“=”);YR3与YW3结构相似,YW3易与过渡金属阳离子形成配离子而YR3不能,原因是___________ 。
(3)同周期元素中,第一电离能比Z大的元素有_________ 种;Z与Y形成的固态Y2Z5由YZ 和YZ
和YZ 两种离子组成,固态Y2Z5中Y原子的杂化方式为
两种离子组成,固态Y2Z5中Y原子的杂化方式为_________ ,YZ 的电子式为
的电子式为_________ 。
(4)X与Z可形成多种结构形式的阴离子,已知阴离子X3Z 结构中只有一个正六元环,则n=
结构中只有一个正六元环,则n=___________ ,该阴离子的结构式为___________ 。
(1)由X原子核形成的三种微粒,电子排布式分别为:①1s22s2、②1s22s22p1、③1s22s12p2,有关这些微粒的叙述正确的是
a.得电子能力:②>① b.表示基态原子(或离子)的是:①②
c.微粒半径:①>② d.电离一个电子所需最低能量:①>②>③
(2)YR3是一种重要的电子工业材料。分子的极性:YR3
(3)同周期元素中,第一电离能比Z大的元素有
 和YZ
和YZ 两种离子组成,固态Y2Z5中Y原子的杂化方式为
两种离子组成,固态Y2Z5中Y原子的杂化方式为 的电子式为
的电子式为(4)X与Z可形成多种结构形式的阴离子,已知阴离子X3Z
 结构中只有一个正六元环,则n=
结构中只有一个正六元环,则n=
您最近一年使用:0次



