氟元素可形成多种有工业价值和科研价值的化合物,如 等。
等。
(1)基态F原子核外电子有___________ 种空间运动状态,下列为氟原子激发态的电子排布式的是___________ (填序号)。
A. B.
B. C.
C.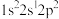 D.
D.
(2) 通入稀
通入稀 溶液中可生成
溶液中可生成 ,
, 分子的构型为
分子的构型为___________ ,其中氧原子的杂化方式为___________ 。
(3) 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的熔点(192℃),其原因是
的熔点(192℃),其原因是___________ 。
(4)石墨与 在450℃反应,石墨层间插入F得到层状结构化合物
在450℃反应,石墨层间插入F得到层状结构化合物 ,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,
,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性___________ (填“增强”或“减弱”), 中
中 键的键长比石墨中
键的键长比石墨中 键的
键的___________ (填“长”或“短”)。 及清洗剂
及清洗剂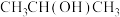 ,三种物质中除H外的各元素的电负性由大到小的顺序为
,三种物质中除H外的各元素的电负性由大到小的顺序为___________ , 氟硼酸铵(
氟硼酸铵( )中含有
)中含有___________ mol配位键。
(6)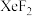 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为 ,已知
,已知 键的键长为rpm,则B点原子的分数坐标为
键的键长为rpm,则B点原子的分数坐标为___________ ;晶胞中A、B间的距离
___________ pm(用含a、c、r的计算式表示)。
 等。
等。(1)基态F原子核外电子有
A.
 B.
B. C.
C.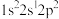 D.
D.
(2)
 通入稀
通入稀 溶液中可生成
溶液中可生成 ,
, 分子的构型为
分子的构型为(3)
 的熔点为1090℃,远高于
的熔点为1090℃,远高于 的熔点(192℃),其原因是
的熔点(192℃),其原因是(4)石墨与
 在450℃反应,石墨层间插入F得到层状结构化合物
在450℃反应,石墨层间插入F得到层状结构化合物 ,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比,
,该物质仍具有润滑性,其单层局部结构如图所示。与石墨相比, 的导电性
的导电性 中
中 键的键长比石墨中
键的键长比石墨中 键的
键的
 及清洗剂
及清洗剂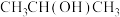 ,三种物质中除H外的各元素的电负性由大到小的顺序为
,三种物质中除H外的各元素的电负性由大到小的顺序为 氟硼酸铵(
氟硼酸铵( )中含有
)中含有(6)
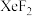 晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为
晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为 ,已知
,已知 键的键长为rpm,则B点原子的分数坐标为
键的键长为rpm,则B点原子的分数坐标为

23-24高三下·四川成都·开学考试 查看更多[3]
更新时间:2024-02-25 10:55:36
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】卤素可形成许多结构和性质特殊的化合物。回答下列问题:
(1)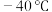 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为___________ , 水解反应的产物为
水解反应的产物为___________ (填化学式)。
(2) 中心原子为
中心原子为 ,
, 原子的轨道杂化方式
原子的轨道杂化方式___________ , 的分子空间构型为
的分子空间构型为___________ 。 中心原子为
中心原子为 ,其分子空间构型与
,其分子空间构型与 相同,但
相同,但 中存在大
中存在大 键(
键( )。
)。 中
中 键角
键角___________  中
中 键角(填“
键角(填“ ”、“
”、“ ”或“
”或“ ”)。比较
”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因___________ 。
(3)已知: 易溶于
易溶于 溶液,发生反应:
溶液,发生反应: (红棕色);
(红棕色); 和
和 氧化性几乎相同。将等体积的
氧化性几乎相同。将等体积的 溶液加入到
溶液加入到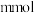 铜粉和
铜粉和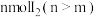 的固体混合物中,振荡。
的固体混合物中,振荡。
实验记录如下:
结合实验Ⅲ,推测实验Ⅰ和Ⅱ中的白色沉淀可能是 ,实验Ⅰ中铜被氧化的化学方程式是
,实验Ⅰ中铜被氧化的化学方程式是___________ 。分别取实验Ⅰ和Ⅱ充分反应后的固体,洗涤后得到白色沉淀,加入浓 溶液,
溶液,___________ (填实验现象),观察到少量红色的铜。分析铜未完全反应的原因是___________ 。
(4)一定条件下, 、
、 和
和 反应生成
反应生成 和化合物
和化合物 。
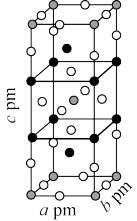
。 的晶胞结构如图所示其中
的晶胞结构如图所示其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为___________ 。
(1)
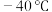 时,
时, 与冰反应生成
与冰反应生成 和
和 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为 水解反应的产物为
水解反应的产物为(2)
 中心原子为
中心原子为 ,
, 原子的轨道杂化方式
原子的轨道杂化方式 的分子空间构型为
的分子空间构型为 中心原子为
中心原子为 ,其分子空间构型与
,其分子空间构型与 相同,但
相同,但 中存在大
中存在大 键(
键( )。
)。 中
中 键角
键角 中
中 键角(填“
键角(填“ ”、“
”、“ ”或“
”或“ ”)。比较
”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(3)已知:
 易溶于
易溶于 溶液,发生反应:
溶液,发生反应: (红棕色);
(红棕色); 和
和 氧化性几乎相同。将等体积的
氧化性几乎相同。将等体积的 溶液加入到
溶液加入到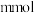 铜粉和
铜粉和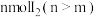 的固体混合物中,振荡。
的固体混合物中,振荡。实验记录如下:
 | 实验现象 | |
| 实验Ⅰ |  | 极少量 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 溶解,溶液为淡红色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为淡红色 |
| 实验Ⅱ |  | 部分 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 溶解,溶液为红棕色;充分反应后,红色的铜粉转化为白色沉淀,溶液仍为红棕色 |
| 实验Ⅲ |  |  完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 完全溶解,溶液为深红棕色;充分反应后,红色的铜粉完全溶解,溶液为深红棕色 |
 ,实验Ⅰ中铜被氧化的化学方程式是
,实验Ⅰ中铜被氧化的化学方程式是 溶液,
溶液,(4)一定条件下,
 、
、 和
和 反应生成
反应生成 和化合物
和化合物 。
。 的晶胞结构如图所示其中
的晶胞结构如图所示其中 化合价为
化合价为 。上述反应的化学方程式为
。上述反应的化学方程式为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】我国科学家利用锰族催化剂(Mn4CaOx,x代表氧原子数)解密光合作用。锰簇在S3Yz·态的可逆结构异构化如图。
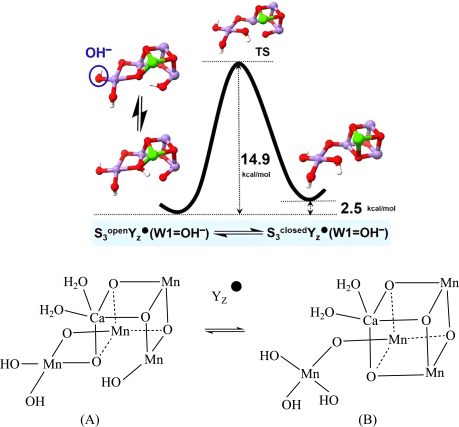
请回答下列问题:
(1)基态锰原子电子排布式为______ 。
(2)锰族催化剂Mn4CaOx中所含元素电负性由大到小的顺序为______ (用元素符号表示),Mn元素位于元素周期表第______ 周期第______ 族。
(3)根据上图可知,稳定性:A______ B(填“>”“<”或“=”)。
(4)1molA含______ molH-Oσ键。
(5)CaO晶胞与NaCl晶胞属于同种类型,如图所示。

①前者的熔点明显高于后者,其主要原因是______ 。
②该晶胞中含有Ca2+的数目为______ ,距离O2-最近的Ca2+的数目有______ 个。
③已知:Ca2+和O2-的核间距为apm,NA为阿伏加德罗常数的值。则CaO晶体密度为______ g/cm3.

请回答下列问题:
(1)基态锰原子电子排布式为
(2)锰族催化剂Mn4CaOx中所含元素电负性由大到小的顺序为
(3)根据上图可知,稳定性:A
(4)1molA含
(5)CaO晶胞与NaCl晶胞属于同种类型,如图所示。

①前者的熔点明显高于后者,其主要原因是
②该晶胞中含有Ca2+的数目为
③已知:Ca2+和O2-的核间距为apm,NA为阿伏加德罗常数的值。则CaO晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】过渡金属及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布图为___ ,与钛同周期的过渡元素中,基态原子的成对电子数与钛相同的还有__ 种。
(2)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的晶体,该晶体中两种配体的物质的量之比为2∶4,则由该配合离子组成的晶体化学式还可以写为___ 。
(3)航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如图反应实现铜离子的富集,进行回收。

①M所含元素的第一电离能最大的是___ (用元素符号表示)。
②X化合物中中心原子铜的配位数是__ ,上述反应中断裂和生成的化学键有___ 。
(4)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于___ 晶体。已知:立方氮化硼密度为dg·cm-3,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率(晶胞中原子的体积占晶胞体积的百分率)为___ (列出计算式即可,不用化简)。

(1)基态钛原子的价电子排布图为
(2)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的晶体,该晶体中两种配体的物质的量之比为2∶4,则由该配合离子组成的晶体化学式还可以写为
(3)航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如图反应实现铜离子的富集,进行回收。

①M所含元素的第一电离能最大的是
②X化合物中中心原子铜的配位数是
(4)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】2022年9月,中国科学家首次在嫦娥五号带回的月壤中发现新矿物,并命名为“嫦娥石”。“嫦娥石”属于陨磷钠镁钙石族,其中一种物质的化学式为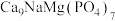 。请回答下列问题:
。请回答下列问题:
(1)钠在火焰上灼烧的黄光是一种_______ (填字母)。
A.吸收光谱 B.发射光谱
(2)某同学把 原子价电子的轨道表示式写成了以下形式:
原子价电子的轨道表示式写成了以下形式: ,这种写法违背了
,这种写法违背了_______ 。
(3) 原子最高能级电子的电子云轮廓形状为
原子最高能级电子的电子云轮廓形状为_______ ,电负性P_______ O(填“>”或“<”)。
(4) 分子空间结构为
分子空间结构为_______ , 与
与 反应生成
反应生成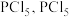 结构为
结构为 ,
, 是
是_______ 分子(填“极性”或“非极性”),其中P原子的杂化类型是_______ (填字母)。
A.sp B. C.
C. D.
D.
氟化镁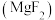 晶体广泛应用在光学、冶金、国防、医疗等领域。氟化镁晶胞是长方体,其结构如下图所示:
晶体广泛应用在光学、冶金、国防、医疗等领域。氟化镁晶胞是长方体,其结构如下图所示: 晶胞示意图中:
晶胞示意图中: ,结合离子结构示意图解释原因:
,结合离子结构示意图解释原因:_______ 。
一种由 制备
制备 的工艺流程如下。
的工艺流程如下。
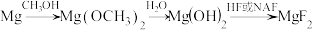
已知:i. 易溶于甲醇;
易溶于甲醇;
ii.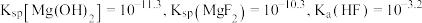
(6)比较相同条件下化学反应速率的大小:① 与
与 ;②
;② 与
与 。小组同学预测化学反应速率:①<②。实验表明化学反应速率:①>②。分析其原因可能是
。小组同学预测化学反应速率:①<②。实验表明化学反应速率:①>②。分析其原因可能是_______ 。
(7)上述流程中Mg(OH)2开始转化为MgF2所需氟化物的浓度:c(HF)_______ c(NaF)。
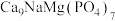 。请回答下列问题:
。请回答下列问题:(1)钠在火焰上灼烧的黄光是一种
A.吸收光谱 B.发射光谱
(2)某同学把
 原子价电子的轨道表示式写成了以下形式:
原子价电子的轨道表示式写成了以下形式: ,这种写法违背了
,这种写法违背了(3)
 原子最高能级电子的电子云轮廓形状为
原子最高能级电子的电子云轮廓形状为(4)
 分子空间结构为
分子空间结构为 与
与 反应生成
反应生成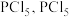 结构为
结构为 ,
, 是
是A.sp B.
 C.
C. D.
D.
氟化镁
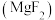 晶体广泛应用在光学、冶金、国防、医疗等领域。氟化镁晶胞是长方体,其结构如下图所示:
晶体广泛应用在光学、冶金、国防、医疗等领域。氟化镁晶胞是长方体,其结构如下图所示: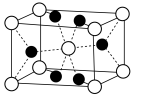
 晶胞示意图中:
晶胞示意图中:a. 表示
表示
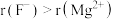 ,结合离子结构示意图解释原因:
,结合离子结构示意图解释原因:一种由
 制备
制备 的工艺流程如下。
的工艺流程如下。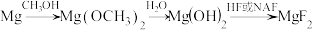
已知:i.
 易溶于甲醇;
易溶于甲醇;ii.
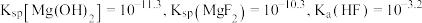
(6)比较相同条件下化学反应速率的大小:①
 与
与 ;②
;② 与
与 。小组同学预测化学反应速率:①<②。实验表明化学反应速率:①>②。分析其原因可能是
。小组同学预测化学反应速率:①<②。实验表明化学反应速率:①>②。分析其原因可能是(7)上述流程中Mg(OH)2开始转化为MgF2所需氟化物的浓度:c(HF)
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】美国某大学一课题组在金属有机框架(MOF)中成功构筑了含有双核镍氢中心 的新型催化剂,用以催化有机物的选择性氢化反应。回答下列问题:
的新型催化剂,用以催化有机物的选择性氢化反应。回答下列问题: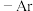 ,
, 为芳烃基,
为芳烃基, ,
,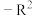 为烃基。
为烃基。
(1)基态镍原子的价层电子排布式为___________ 。
(2)甲、乙、丙、丁四种物质中,碳原子共有___________ 种杂化类型,这四种物质都含有的化学键类型为___________ (填标号)。
A.σ键和π键 B.氢键 C.极性键 D.非极性键
(3)双镍催化剂中,镍原子提供___________ (填“空轨道”或“孤电子对”,下同),氮原子提供___________ 形成配位键。
(4)上述物质所含第二周期元素中,第一电离能由大到小的顺序为___________ (填元素符号,下同),电负性由小到大的顺序为___________ 。
(5)一种镍铌合金的晶胞结构如图所示。镍、铌原子的最近距离为___________ pm。该晶体密度为___________  。已知:
。已知: 为阿伏加德罗常数的值,c>2a。
为阿伏加德罗常数的值,c>2a。
 的新型催化剂,用以催化有机物的选择性氢化反应。回答下列问题:
的新型催化剂,用以催化有机物的选择性氢化反应。回答下列问题: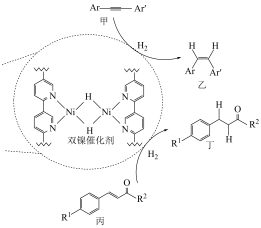
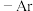 ,
, 为芳烃基,
为芳烃基, ,
,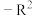 为烃基。
为烃基。(1)基态镍原子的价层电子排布式为
(2)甲、乙、丙、丁四种物质中,碳原子共有
A.σ键和π键 B.氢键 C.极性键 D.非极性键
(3)双镍催化剂中,镍原子提供
(4)上述物质所含第二周期元素中,第一电离能由大到小的顺序为
(5)一种镍铌合金的晶胞结构如图所示。镍、铌原子的最近距离为
 。已知:
。已知: 为阿伏加德罗常数的值,c>2a。
为阿伏加德罗常数的值,c>2a。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】黄铜矿(主要成分为 )是一种较常见的铜矿物,是炼铜的主要矿物原料。回答下列问题:
)是一种较常见的铜矿物,是炼铜的主要矿物原料。回答下列问题:
(1)基态 的价电子排布式是
的价电子排布式是_________ 。
(2)分析下表,Cu的第一电离能(I1)小于Zn的第一电离能,而Cu的第二电离能(I2)却大于Zn的第二电离能,其主要原因是_______ 。
(3) 的晶体结构与
的晶体结构与 相似,S原子与Cu原子配位数不同,影响这一结果的是离子晶体的
相似,S原子与Cu原子配位数不同,影响这一结果的是离子晶体的________ (填“几何”“电荷”或“键性”)因素。
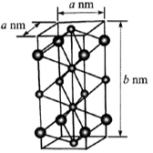
(4)四方晶系的 晶胞结构如图1所示。
晶胞结构如图1所示。

① 中各元素电负性从小到大的顺序为
中各元素电负性从小到大的顺序为___________ ,晶胞中S原子的杂化方式为___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,若图1中原子1的分数坐标为( ),则原子2的分数坐标为
),则原子2的分数坐标为____ 。晶体中距离Fe最近的S有_____ 个。
③晶胞中Cu和Fe的投影位置如图2所示。设阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为______  。
。

 )是一种较常见的铜矿物,是炼铜的主要矿物原料。回答下列问题:
)是一种较常见的铜矿物,是炼铜的主要矿物原料。回答下列问题:(1)基态
 的价电子排布式是
的价电子排布式是(2)分析下表,Cu的第一电离能(I1)小于Zn的第一电离能,而Cu的第二电离能(I2)却大于Zn的第二电离能,其主要原因是
电离能 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
(3)
 的晶体结构与
的晶体结构与 相似,S原子与Cu原子配位数不同,影响这一结果的是离子晶体的
相似,S原子与Cu原子配位数不同,影响这一结果的是离子晶体的(4)四方晶系的
 晶胞结构如图1所示。
晶胞结构如图1所示。
①
 中各元素电负性从小到大的顺序为
中各元素电负性从小到大的顺序为②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,若图1中原子1的分数坐标为(
 ),则原子2的分数坐标为
),则原子2的分数坐标为③晶胞中Cu和Fe的投影位置如图2所示。设阿伏加德罗常数的值为
 ,则该晶体的密度为
,则该晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】卤族元素形成的单质及其化合物有广泛的应用。请回答:
(1)基态Br原子的电子排布式为___________ ;与其位于同周期且基态原子未成对电子数相同的过渡元素为___________ (填元素符号)。
(2)F、Cl、Br形成的简单氢化物的沸点由高到低的顺序为___________ ,分析其原因为___________ 。
(3)F、H可分别与N形成NF3和NH3.NH3可与Cu2+形成配离子,但NF3却不易形成,其原因为___________ 。
(4)氯元素可形成 、
、 和
和 等多种含氧酸根离子,上述三种离子中键角由大到小的顺序为
等多种含氧酸根离子,上述三种离子中键角由大到小的顺序为___________ 。
(5)Cl和Na可形成多种化合物。
①NaCl与CsCl的晶体结构不同,主要原因为___________ 。
②Cl和Na在高压下形成的一种晶体的晶胞如图所示(大球代表氯,小球代表钠)。该晶体的化学式为___________ ;已知阿伏加德罗常数的值为NA,则该晶体的密度为___________ g/cm3(列出计算式)。
(1)基态Br原子的电子排布式为
(2)F、Cl、Br形成的简单氢化物的沸点由高到低的顺序为
(3)F、H可分别与N形成NF3和NH3.NH3可与Cu2+形成配离子,但NF3却不易形成,其原因为
(4)氯元素可形成
 、
、 和
和 等多种含氧酸根离子,上述三种离子中键角由大到小的顺序为
等多种含氧酸根离子,上述三种离子中键角由大到小的顺序为(5)Cl和Na可形成多种化合物。
①NaCl与CsCl的晶体结构不同,主要原因为
②Cl和Na在高压下形成的一种晶体的晶胞如图所示(大球代表氯,小球代表钠)。该晶体的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】石墨因其自身和石墨烯在多方应用上的突出表现,而再次成为化学科学研究的热门。
(1)石墨晶体是层状结构(如图甲),在层与层之间,靠___________ 结合;在层内,每一个碳原子都跟其他3个碳原子结合,图乙是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子总数是___________ 个。图丙是石墨晶体的晶胞图,一个这样的晶胞占有___________ 个碳原子。 图丁是金刚石晶体 (一部分)的结构示意图,石墨晶体与金刚石晶体对比,碳原子的杂化方式前者是___________ 杂化,后者是___________ 杂化。

(2)石墨烯是一种由单层碳原子构成的平面结构新型导电材料,靠层上各个碳原子(如下图甲中的1号碳原子) 2p上的一个___________ (填 “已参与杂化”或“未参与杂化”)的电子形成大π共轭体系,石墨烯中碳碳键的键能要比金刚石中碳碳键的键能___________ (填“强”或“弱”)。石墨烯中部分碳原子被氧化后,其平面结构将发生改变,转化为氧化石墨烯(如下图乙),氧化石墨烯中键角
___________ (填“>”“<”或“=”)键角β,原因是___________ 。
(3)石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子围成的正六边形中(如下图丙)。此石墨间隙化合物可用化学式CxK表示,其中x=___________ 。

(4)石墨烯可转化为富勒烯(C60),图甲是富勒烯的结构示意图,一个C60中有___________ 根共价键,富勒烯的熔点比石墨___________ (填“高”或“低”)。富勒烯也能与K形成新型化合物,其晶胞如图乙所示,晶胞棱长为a nm,该晶体的密度(用含a的代数式表示)_____ g/cm-3

(1)石墨晶体是层状结构(如图甲),在层与层之间,靠

(2)石墨烯是一种由单层碳原子构成的平面结构新型导电材料,靠层上各个碳原子(如下图甲中的1号碳原子) 2p上的一个

(3)石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原子围成的正六边形中(如下图丙)。此石墨间隙化合物可用化学式CxK表示,其中x=

(4)石墨烯可转化为富勒烯(C60),图甲是富勒烯的结构示意图,一个C60中有

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】VA族元素原子核外电子排布有着特殊性,能与其他元素组成结构,性质各异的化合物。回答下列问题:
(1)氮原子可以提供孤电子对与氧原子形成配位键,基态氧原子的价层电子发生重排提供一个空轨道,则重排后的氧原子价电子排布图为___________ ,基态氧原子的价层电子不是重排结构,原因是不符合___________ (填“泡利不相容原理”或“洪特规则”)。
(2)沸点:
___________  (填“>”或“<”,下同),理由是:
(填“>”或“<”,下同),理由是:___________ 。键角:
___________  ,理由是:
,理由是:___________ 。
(3)As、Ge、Se三种元素的第一电离能由大到小的顺序是___________ 。
(4)基态As原子的最高能级组的电子排布式为___________ 。
(5) 晶胞中的少量Ti被Al代替后的立方晶胞结构如图所示。该晶胞中,距离Ti最近的Al有
晶胞中的少量Ti被Al代替后的立方晶胞结构如图所示。该晶胞中,距离Ti最近的Al有___________ 个;原子①与原子②的距离为___________ nm(已知晶体密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。

(1)氮原子可以提供孤电子对与氧原子形成配位键,基态氧原子的价层电子发生重排提供一个空轨道,则重排后的氧原子价电子排布图为
(2)沸点:

 (填“>”或“<”,下同),理由是:
(填“>”或“<”,下同),理由是:
 ,理由是:
,理由是:(3)As、Ge、Se三种元素的第一电离能由大到小的顺序是
(4)基态As原子的最高能级组的电子排布式为
(5)
 晶胞中的少量Ti被Al代替后的立方晶胞结构如图所示。该晶胞中,距离Ti最近的Al有
晶胞中的少量Ti被Al代替后的立方晶胞结构如图所示。该晶胞中,距离Ti最近的Al有 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】乙烯是制造塑料、橡胶和纤维的基本原料,利用CO2和H2合成乙烯: ΔH。回答下列问题:
ΔH。回答下列问题:
(1)在恒容密闭容器中,起始压强相同,反应温度、投料比[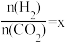 ]对CO2平衡转化率的影响如下图甲所示。则:
]对CO2平衡转化率的影响如下图甲所示。则:

①ΔH___________ 0(填“>””或“<”,下同)
②a___________ 3;
③M、N两点的化学平衡常数KM___________ KN。
(2)上述反应的Arrhenius 经验公式实验数据如图乙中曲线a所示,已知Arrhenius经验公式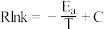 (Ea为活化能,k为速率常数,R和C为常数)。反应的活化能Ea=
(Ea为活化能,k为速率常数,R和C为常数)。反应的活化能Ea=___________ kJ·mol。

(3)金属铌的晶胞如图所示,

①每个铌原子最近且等距的铌原子有___________ 个。
②若晶胞中两个最近的铌原子之间的距离为apm,则金属铌的密度为___________  (列出计算式)
(列出计算式)
③原子空间利用率 ,球体积为金属原子的总体积。则金属铌晶体的原子空间利用率=
,球体积为金属原子的总体积。则金属铌晶体的原子空间利用率=___________ (列出计算式)。
 ΔH。回答下列问题:
ΔH。回答下列问题:(1)在恒容密闭容器中,起始压强相同,反应温度、投料比[
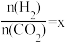 ]对CO2平衡转化率的影响如下图甲所示。则:
]对CO2平衡转化率的影响如下图甲所示。则:
①ΔH
②a
③M、N两点的化学平衡常数KM
(2)上述反应的Arrhenius 经验公式实验数据如图乙中曲线a所示,已知Arrhenius经验公式
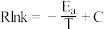 (Ea为活化能,k为速率常数,R和C为常数)。反应的活化能Ea=
(Ea为活化能,k为速率常数,R和C为常数)。反应的活化能Ea=
(3)金属铌的晶胞如图所示,

①每个铌原子最近且等距的铌原子有
②若晶胞中两个最近的铌原子之间的距离为apm,则金属铌的密度为
 (列出计算式)
(列出计算式)③原子空间利用率
 ,球体积为金属原子的总体积。则金属铌晶体的原子空间利用率=
,球体积为金属原子的总体积。则金属铌晶体的原子空间利用率=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】已知A、B、C、D、E为元素周期表中前四周期元素,且原子序数依次增大。A是原子半径最小的主族元素,B是空气中含量最多的元素:C元素2p能级有两个未成对电子且没有空轨道;D是29号元素;E元素的价电子排布式为ns2np2.回答下列问题:
(1)基态D原子的外围电子排布式为_____ ,B、C两种元素的第一电离能最大的是___________ (用元素符号表示)。
(2)BC 微粒的空间构型为
微粒的空间构型为_____ ,1个[D(A2C)4]2+中含有的σ键数目为_____ 个。
(3)A、D两种元素分别与C元素形成的简单化合物,熔点较高的是_____ ,原因是_____ 。
(4)BA3在一定条件下容易得到一个A+,形成BA .下列对上述过程的描述不合理的是
.下列对上述过程的描述不合理的是_____ 。
A.B原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角减小
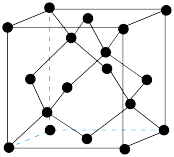
(5)E单质的晶体具有金刚石结构,其中微粒之间存在的作用力是,如图为E单质晶体的晶胞,已知晶胞的密度为dg/cm3,则晶胞的边长为_____ pm(列出计算式即可)。
(1)基态D原子的外围电子排布式为
(2)BC
 微粒的空间构型为
微粒的空间构型为(3)A、D两种元素分别与C元素形成的简单化合物,熔点较高的是
(4)BA3在一定条件下容易得到一个A+,形成BA
 .下列对上述过程的描述不合理的是
.下列对上述过程的描述不合理的是A.B原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角减小
(5)E单质的晶体具有金刚石结构,其中微粒之间存在的作用力是,如图为E单质晶体的晶胞,已知晶胞的密度为dg/cm3,则晶胞的边长为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】三草酸合铁酸钾{K3[Fe(C2O4)3]·3H2O}是制备铁触媒的主要原料,在光照下能分解:2 K3[Fe(C2O4)3]·3H2O 3K2C2O4+2FeC2O4+2CO2↑+6H2O。回答下列问题:
3K2C2O4+2FeC2O4+2CO2↑+6H2O。回答下列问题:
(1)基态Fe原子的电子排布式为___________ ,基态Fe2+与Fe3+中未成对电子的数目之比为___________ 。
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是___________ (填元素符号,下同),电负性最大的是___________ 。
(3)H2O分子的立体构型为___________ 。
(4)金刚石的晶胞结构如图1所示,碳原子分别位于顶点、面心和体内。
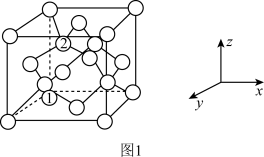
若图中原子1的坐标为(0,0,0),则原子2的坐标为___________ 。若金刚石的晶胞边长为apm,则其中碳碳键的键长d___________ (用含a的代数式表示)pm。
(5)铁有δ、γ、α三种同素异形体(如图2),三种晶体在不同温度下能发生转化。
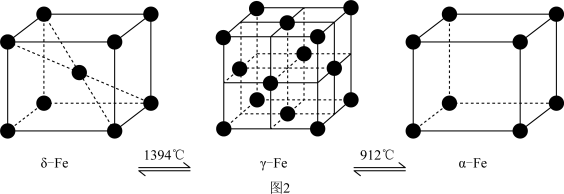
①δ、γ、α三种晶体晶胞中铁原子的配位数之比为___________ 。
②若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶胞的密度之比为___________ (用含a、b的代数式表示)。
 3K2C2O4+2FeC2O4+2CO2↑+6H2O。回答下列问题:
3K2C2O4+2FeC2O4+2CO2↑+6H2O。回答下列问题:(1)基态Fe原子的电子排布式为
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是
(3)H2O分子的立体构型为
(4)金刚石的晶胞结构如图1所示,碳原子分别位于顶点、面心和体内。

若图中原子1的坐标为(0,0,0),则原子2的坐标为
(5)铁有δ、γ、α三种同素异形体(如图2),三种晶体在不同温度下能发生转化。

①δ、γ、α三种晶体晶胞中铁原子的配位数之比为
②若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶胞的密度之比为
您最近一年使用:0次



