Balanol是一种蛋白激酶C的抑制剂,其前体的合成路线如下:
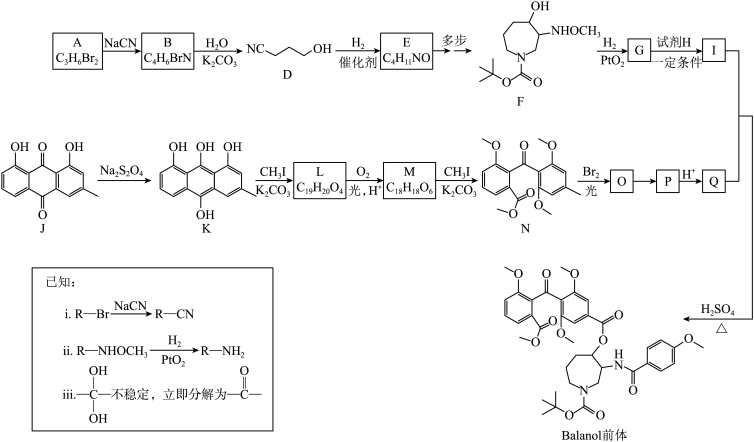
回答下列问题:
(1)A的官能团名称是________ 。
(2)B→D的反应中K2CO3的作用是________ 。
(3)D→E的化学方程式是________ 。
(4)已知试剂H能与NaHCO3反应,则G→I的化学方程式是________ 。
(5)已知J→K的反应中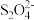 被氧化为
被氧化为 ,则J与Na2S2O4的物质的量之比为
,则J与Na2S2O4的物质的量之比为________ 。
(6)N→O的化学方程式是________ 。
(7)下列说法正确的是________ 。
a. A→B的反应中NaCN使用应过量,提高B的产率
b. J存在分子内氢键,且能发生显色反应
c. O→P的反应条件是NaOH水溶液加热
(8)L→M的过程如下:其中经历了含过氧键 的中间体L1,L→L1的过程是O2(O=O)与L的加成。
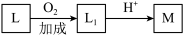
已知L1含多于3个的六元环,且其中2个是苯环。请写出中间体L1的结构简式____________ 。

回答下列问题:
(1)A的官能团名称是
(2)B→D的反应中K2CO3的作用是
(3)D→E的化学方程式是
(4)已知试剂H能与NaHCO3反应,则G→I的化学方程式是
(5)已知J→K的反应中
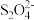 被氧化为
被氧化为 ,则J与Na2S2O4的物质的量之比为
,则J与Na2S2O4的物质的量之比为(6)N→O的化学方程式是
(7)下列说法正确的是
a. A→B的反应中NaCN使用应过量,提高B的产率
b. J存在分子内氢键,且能发生显色反应
c. O→P的反应条件是NaOH水溶液加热
(8)L→M的过程如下:其中经历了含

已知L1含多于3个的六元环,且其中2个是苯环。请写出中间体L1的结构简式
2024·北京·模拟预测 查看更多[1]
(已下线)2023-2024学年度第二学期高三化学零模试卷
更新时间:2024-03-20 17:51:28
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】工业合成氨是人类科学技术的一项重大突破,我国目前氨的生产能力位居世界首位。合成氨反应为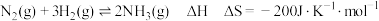 。回答下列问题:
。回答下列问题:
(1)已知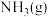 和
和 的燃烧热(
的燃烧热( )分别为
)分别为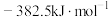 和
和 ,则合成氨反应的
,则合成氨反应的
_______ ;合成氨反应的逆过程能自发进行的最低温度为_______  。
。
(2)在合成氨过程中,需要不断分离出氨的原因为_______ (填字母)。
A.有利于平衡正向移动 B.防止催化剂中毒 C.提高正反应速率
(3)某温度下,在容积为 的恒容密闭容器中模拟工业合成氨,充入
的恒容密闭容器中模拟工业合成氨,充入 和
和 的总物质的量为
的总物质的量为 ,容器内起始压强为标准压强
,容器内起始压强为标准压强 ,容器内各组分的物质的量分数与反应时间
,容器内各组分的物质的量分数与反应时间 的关系如图所示:
的关系如图所示:_______ (填物质名称)的物质的量分数的变化情况。
② 内,平均反应速率
内,平均反应速率
_______  。
。
③达平衡时容器内压强为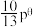 ,则标准平衡常数
,则标准平衡常数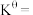
_______ [对于反应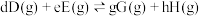 ,标准平衡常数
,标准平衡常数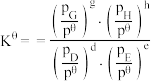 ,其中
,其中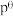 为标准压强,
为标准压强, 、
、 、
、 、
、 为各组分的平衡分压,分压
为各组分的平衡分压,分压 总压
总压 物质的量分数]。
物质的量分数]。
(4)利用热再生氨电池可实现 电镀废液的浓缩再生。该电池的工作原理如图所示,甲、乙两室均预加相同的
电镀废液的浓缩再生。该电池的工作原理如图所示,甲、乙两室均预加相同的 电镀废液,向甲室中加入足量氨气后电池开始工作。
电镀废液,向甲室中加入足量氨气后电池开始工作。_______ 。
②理论上每转移 电子,乙室中溶液的质量变化为
电子,乙室中溶液的质量变化为_______ g。
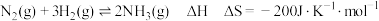 。回答下列问题:
。回答下列问题:(1)已知
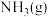 和
和 的燃烧热(
的燃烧热( )分别为
)分别为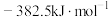 和
和 ,则合成氨反应的
,则合成氨反应的
 。
。(2)在合成氨过程中,需要不断分离出氨的原因为
A.有利于平衡正向移动 B.防止催化剂中毒 C.提高正反应速率
(3)某温度下,在容积为
 的恒容密闭容器中模拟工业合成氨,充入
的恒容密闭容器中模拟工业合成氨,充入 和
和 的总物质的量为
的总物质的量为 ,容器内起始压强为标准压强
,容器内起始压强为标准压强 ,容器内各组分的物质的量分数与反应时间
,容器内各组分的物质的量分数与反应时间 的关系如图所示:
的关系如图所示: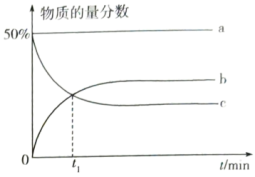
②
 内,平均反应速率
内,平均反应速率
 。
。③达平衡时容器内压强为
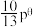 ,则标准平衡常数
,则标准平衡常数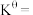
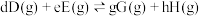 ,标准平衡常数
,标准平衡常数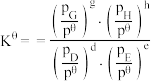 ,其中
,其中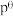 为标准压强,
为标准压强, 、
、 、
、 、
、 为各组分的平衡分压,分压
为各组分的平衡分压,分压 总压
总压 物质的量分数]。
物质的量分数]。(4)利用热再生氨电池可实现
 电镀废液的浓缩再生。该电池的工作原理如图所示,甲、乙两室均预加相同的
电镀废液的浓缩再生。该电池的工作原理如图所示,甲、乙两室均预加相同的 电镀废液,向甲室中加入足量氨气后电池开始工作。
电镀废液,向甲室中加入足量氨气后电池开始工作。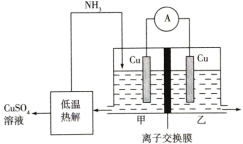
②理论上每转移
 电子,乙室中溶液的质量变化为
电子,乙室中溶液的质量变化为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】废旧电池中含有Fe、Ni、Cd、Co等重金属和电解液、有机粘结剂、碳粉等物质。从废旧电池中回收金属的新工艺,其流程如下图所示。
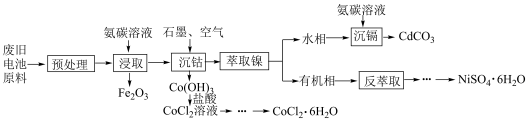
请回答以下问题:
(1)上述四种重金属元素中___________ 元素与其它几种元素不属于同一族。画出 的价层电子轨道表示式
的价层电子轨道表示式___________ 。
(2)预处理中关键一步是焙烧。焙烧除了将金属转化为金属氧化物外,另一目的是___________ 。
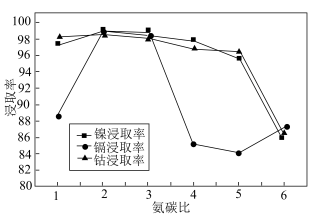
(3)用氨碳溶液浸取时是将一定比例的 和
和 混合通入溶液中浸取金属氧化物,氨碳比与浸取率的关系图如下,其中氨碳比最合适的范围是
混合通入溶液中浸取金属氧化物,氨碳比与浸取率的关系图如下,其中氨碳比最合适的范围是___________ ;
(4)“沉钴”过程中, 在石墨催化下被氧气氧化为
在石墨催化下被氧气氧化为 沉淀,往该沉淀中加入盐酸后被还原为
沉淀,往该沉淀中加入盐酸后被还原为 ,请写出加入盐酸后的离子反应方程式
,请写出加入盐酸后的离子反应方程式___________ 。
(5)①萃取和反萃取的反应原理分别为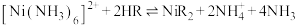 、
、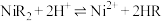 ,则反萃取时加入的试剂为
,则反萃取时加入的试剂为___________ ;
A.NaOH B. C.
C. D.
D.
②从反萃取液中获取 的操作是
的操作是___________ 、过滤。
(6)“沉镉”时加入一定比例的氨碳溶液发生反应: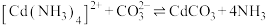 ,研究发现氨碳比约为2:1时沉镉效果最好,从平衡移动的角度分析其原因
,研究发现氨碳比约为2:1时沉镉效果最好,从平衡移动的角度分析其原因___________ 。
(7)“萃取镍”用煤油进行萃取,萃取前水相中镍的浓度为amol/L,一次萃取后的萃取率为90%,则4次萃取后,水相中镍的浓度为___________ mol/L(萃取率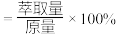 )。
)。

请回答以下问题:
(1)上述四种重金属元素中
 的价层电子轨道表示式
的价层电子轨道表示式(2)预处理中关键一步是焙烧。焙烧除了将金属转化为金属氧化物外,另一目的是
(3)用氨碳溶液浸取时是将一定比例的
 和
和 混合通入溶液中浸取金属氧化物,氨碳比与浸取率的关系图如下,其中氨碳比最合适的范围是
混合通入溶液中浸取金属氧化物,氨碳比与浸取率的关系图如下,其中氨碳比最合适的范围是
(4)“沉钴”过程中,
 在石墨催化下被氧气氧化为
在石墨催化下被氧气氧化为 沉淀,往该沉淀中加入盐酸后被还原为
沉淀,往该沉淀中加入盐酸后被还原为 ,请写出加入盐酸后的离子反应方程式
,请写出加入盐酸后的离子反应方程式(5)①萃取和反萃取的反应原理分别为
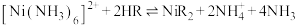 、
、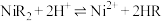 ,则反萃取时加入的试剂为
,则反萃取时加入的试剂为A.NaOH B.
 C.
C. D.
D.
②从反萃取液中获取
 的操作是
的操作是(6)“沉镉”时加入一定比例的氨碳溶液发生反应:
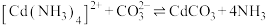 ,研究发现氨碳比约为2:1时沉镉效果最好,从平衡移动的角度分析其原因
,研究发现氨碳比约为2:1时沉镉效果最好,从平衡移动的角度分析其原因(7)“萃取镍”用煤油进行萃取,萃取前水相中镍的浓度为amol/L,一次萃取后的萃取率为90%,则4次萃取后,水相中镍的浓度为
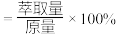 )。
)。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】三氧化二镍(Ni2O3)可用于制造镍氢电池,工业上利用含镍废料(主要成分为镍、铝、铁及其氧化物、碳等)回收其中的镍并制备Ni2O3的工艺流程如下:
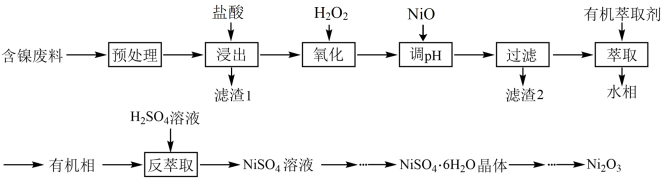
已知:①NiCl2易溶于水,在该实验条件下H2O2、Fe3+不能氧化Ni2+
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
(1)“预处理”操作目的是除去镍废料表面的油脂,可选用试剂为___________ (填字母代号)。
A.水 B.饱和食盐水 C.NaOH溶液
(2)“酸浸”时温度过高,镍的浸出率下降,主要原因可能是___________ (答一点即可)。
(3)“氧化”时主要反应的离子方程式是___________ 。
(4)若“氧化”后的溶液中Ni2+浓度为0.01mol/L,则“调pH”应控制的pH范围是___________ 。
(5)反萃取的反应原理为 ,向有机相中加入H2SO4溶液能进行反萃取的原因为
,向有机相中加入H2SO4溶液能进行反萃取的原因为___________ (用化学平衡移动原理解释)。
(6)有机相提取的Ni2+再生时可用于制备镍氢电池(碱性),该电池充电时的总反应为 ,则放电时负极的电极反应式为
,则放电时负极的电极反应式为___________ 。
(7)确定Ni2O3固体是晶体的最可靠的科学方法是___________(填字母代号)。

已知:①NiCl2易溶于水,在该实验条件下H2O2、Fe3+不能氧化Ni2+
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.010mol/L)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
完全沉淀时(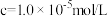 )的pH )的pH | 8.7 | 4.7 | 3.2 | 9.0 |
A.水 B.饱和食盐水 C.NaOH溶液
(2)“酸浸”时温度过高,镍的浸出率下降,主要原因可能是
(3)“氧化”时主要反应的离子方程式是
(4)若“氧化”后的溶液中Ni2+浓度为0.01mol/L,则“调pH”应控制的pH范围是
(5)反萃取的反应原理为
 ,向有机相中加入H2SO4溶液能进行反萃取的原因为
,向有机相中加入H2SO4溶液能进行反萃取的原因为(6)有机相提取的Ni2+再生时可用于制备镍氢电池(碱性),该电池充电时的总反应为
 ,则放电时负极的电极反应式为
,则放电时负极的电极反应式为(7)确定Ni2O3固体是晶体的最可靠的科学方法是___________(填字母代号)。
| A.测定熔、沸点 | B.观察外形 |
| C.对固体进行X射线衍射测定 | D.对比硬度 |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】兴趣小组查阅文献后,设计实验对苯酚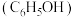 的性质进行探究,回答以下问题。
的性质进行探究,回答以下问题。
已知:ⅰ. 25℃,相关弱酸的电离平衡常数如下:Ka1(H2CO3)=4.2×10−7,Ka2(H2CO3)=5.6×10−11,Ka(C6H5OH)=1.3×10−10。
ⅱ.苯酚与 显色反应的化学方程式为:Fe3++6C6H5OH
显色反应的化学方程式为:Fe3++6C6H5OH [Fe(C6H5O)6]3−(紫色)+6H+。
[Fe(C6H5O)6]3−(紫色)+6H+。
Ⅰ.探究苯酚酸性的强弱
(1)苯酚的电离方程式为___________ 。
(2)兴趣小组按如图装置进行实验,证明酸性强弱顺序为CH3COOH>H2CO3> C6H5OH,所依据的实验现象为___________ ,C中反应的化学方程式为___________ 。
兴趣小组对以上实验的现象提出猜想。
猜想1: 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。
猜想2: 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。
(3)向实验1反应后溶液中继续加入 固体,若溶液颜色无变化,则可得出的结论是
固体,若溶液颜色无变化,则可得出的结论是___________ 。
(4)向实验1反应后溶液中加入___________ 固体(填化学式),若溶液颜色变为浅紫色,说明猜想2成立。
(5)兴趣小组同学提出猜想3:溶液的 会影响显色效果,并设计如下实验进行验证。
会影响显色效果,并设计如下实验进行验证。
①实验4中生成的红褐色沉淀是___________ (填化学式)。
②实验5中滴加盐酸至过量,溶液由紫色变为浅黄色,结合平衡移动原理解释原因___________ 。
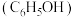 的性质进行探究,回答以下问题。
的性质进行探究,回答以下问题。已知:ⅰ. 25℃,相关弱酸的电离平衡常数如下:Ka1(H2CO3)=4.2×10−7,Ka2(H2CO3)=5.6×10−11,Ka(C6H5OH)=1.3×10−10。
ⅱ.苯酚与
 显色反应的化学方程式为:Fe3++6C6H5OH
显色反应的化学方程式为:Fe3++6C6H5OH [Fe(C6H5O)6]3−(紫色)+6H+。
[Fe(C6H5O)6]3−(紫色)+6H+。Ⅰ.探究苯酚酸性的强弱
(1)苯酚的电离方程式为
(2)兴趣小组按如图装置进行实验,证明酸性强弱顺序为CH3COOH>H2CO3> C6H5OH,所依据的实验现象为
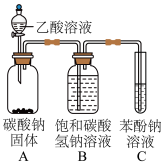
| 实验1 | 实验2 |
|
|
猜想1:
 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。猜想2:
 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。(3)向实验1反应后溶液中继续加入
 固体,若溶液颜色无变化,则可得出的结论是
固体,若溶液颜色无变化,则可得出的结论是(4)向实验1反应后溶液中加入
(5)兴趣小组同学提出猜想3:溶液的
 会影响显色效果,并设计如下实验进行验证。
会影响显色效果,并设计如下实验进行验证。| 实验 | 操作 | 现象 |
| 3 | 向2mL苯酚溶液(调节 )中滴加0.1mol/LFeCl3溶液 )中滴加0.1mol/LFeCl3溶液 | 溶液显紫色 |
| 4 | 向2mL苯酚溶液(调节 )中滴加0.1mol/LFeCl3溶液 )中滴加0.1mol/LFeCl3溶液 | 生成红褐色沉淀 |
| 5 | 向实验4所得悬浊液中逐滴加入0.1mol/L盐酸至过量 | 沉淀逐渐溶解,溶液变为紫色;继续滴加盐酸,溶液由紫色变为浅黄色 |
②实验5中滴加盐酸至过量,溶液由紫色变为浅黄色,结合平衡移动原理解释原因
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
【推荐2】酚醛树脂是应用广泛的高分子材料,可用酚类与醛类在酸或碱的催化下相互缩合而成,类似的合成过程如:
反应①: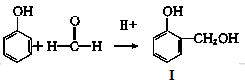
反应②: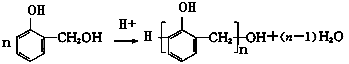
(1)化合物I的分子式____________ 。
(2)苯酚与浓溴水反应的化学方程式为___________________________ 。
(3)化合物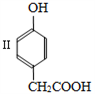 也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为
也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为_______________________________ ;有机物Ⅲ发生类似反应②的反应,生成高分子化合物IV的结构简式为_____________________ 。
(4)有关化合物Ⅱ和Ⅲ的说法正确的有_________ (填字母)。
A.都属于芳香烃
B.都能与FeCl3溶液发生显色反应
C.都能与NaHCO3溶液反应放出CO2
D.l mol的Ⅱ或Ⅲ都能与2mol的NaOH完全反应
反应①:

反应②:

(1)化合物I的分子式
(2)苯酚与浓溴水反应的化学方程式为
(3)化合物
 也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为
也能与CH3CHO发生类似反应①的反应,生成有机物Ⅲ,该反应化学方程式为(4)有关化合物Ⅱ和Ⅲ的说法正确的有
A.都属于芳香烃
B.都能与FeCl3溶液发生显色反应
C.都能与NaHCO3溶液反应放出CO2
D.l mol的Ⅱ或Ⅲ都能与2mol的NaOH完全反应
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
【推荐3】沙罗特美是一种长效平喘药,其合成的部分路线如下:
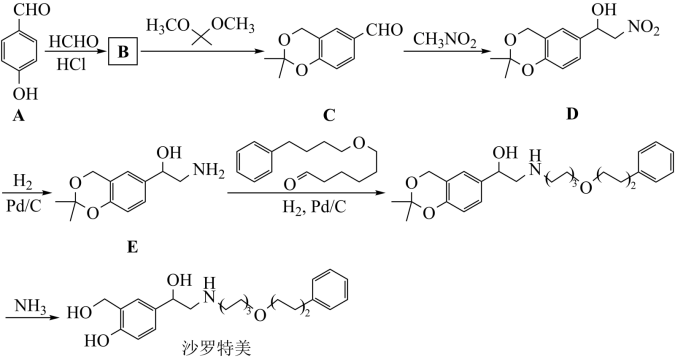
(1)A中的官能团名称为______ 。
(2)C→D的反应类型为______ 。
(3)B的分子式为C8H8O3。B→C发生取代反应,另一产物为CH3OH,写出B的结构简式______ 。
(4)写出A→B的化学方程式______ 。
(5)写出同时满足下列条件的E的2种同分异构体的结构简式______ 。
①分子中含有苯环,不能与FeCl3发生显色反应
②能发生水解反应,水解产物之一是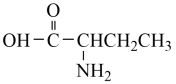 ,另一水解产物分子中只有5种不同化学环境的氢
,另一水解产物分子中只有5种不同化学环境的氢
(6)请写出以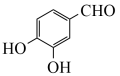 、(CH3)2C(OCH3)2、CH3NO2为原料制备
、(CH3)2C(OCH3)2、CH3NO2为原料制备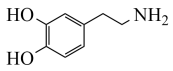 的合成路线流程图
的合成路线流程图______ (无机试剂任用,合成路线流程图示例见本题题干)。

(1)A中的官能团名称为
(2)C→D的反应类型为
(3)B的分子式为C8H8O3。B→C发生取代反应,另一产物为CH3OH,写出B的结构简式
(4)写出A→B的化学方程式
(5)写出同时满足下列条件的E的2种同分异构体的结构简式
①分子中含有苯环,不能与FeCl3发生显色反应
②能发生水解反应,水解产物之一是
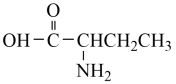 ,另一水解产物分子中只有5种不同化学环境的氢
,另一水解产物分子中只有5种不同化学环境的氢(6)请写出以
 、(CH3)2C(OCH3)2、CH3NO2为原料制备
、(CH3)2C(OCH3)2、CH3NO2为原料制备 的合成路线流程图
的合成路线流程图
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
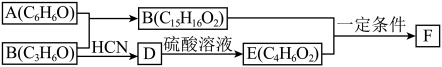
【推荐1】有机物F(Bisphenol A dimethacrylate)是一种交联单体。合成F的一种路线如图:
已知:①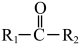 +HCN
+HCN
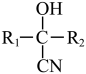
②B不能发生银镜反应。
③C能与FeCl3发生显色反应,核磁共振氢谱显示有4种不同化学环境的氢。
④E既能使溴水褪色又能使石蕊试液显红色。
⑤1 mol F最多可与4 mol NaOH反应。
回答下列问题:
(1)A的名称为_______ 。E中含氧官能团的名称为______ 。
(2)B的结构简式为______ 。B→D的反应类型为_________ 。
(3)C与E反应生成F的化学反应方程式为______ 。
(4)C的同分异构体中含有萘环(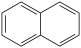 )结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的同分异构体共有
)结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的同分异构体共有_____ 种(不考虑立体异构),其中核磁共振氢谱有8组峰的是_______ (写出其中一种的结构简式)。
(5)A经如下步骤可合成环己烯甲酸: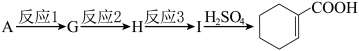 ,反应2所选择的试剂为
,反应2所选择的试剂为____________ 。

已知:①
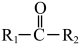 +HCN
+HCN

②B不能发生银镜反应。
③C能与FeCl3发生显色反应,核磁共振氢谱显示有4种不同化学环境的氢。
④E既能使溴水褪色又能使石蕊试液显红色。
⑤1 mol F最多可与4 mol NaOH反应。
回答下列问题:
(1)A的名称为
(2)B的结构简式为
(3)C与E反应生成F的化学反应方程式为
(4)C的同分异构体中含有萘环(
 )结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的同分异构体共有
)结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的同分异构体共有(5)A经如下步骤可合成环己烯甲酸:
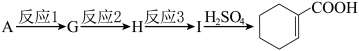 ,反应2所选择的试剂为
,反应2所选择的试剂为
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
【推荐2】黄酮醋酸类化合物具有黄酮类化合物抗菌、消炎、降血压、保肝等多种生理活性和药理作用,尤其是近年来报道此类化合物具有独特抗癌活性。下面的方法采用对甲酚作为起始原料,通过一系列反应合成化合物黄酮F(化学式为C18H12O2NBr),为黄酮醋酸的前体化合物)。其进一步水解即得黄酮醋酸。合成路线如下:

A是酯;F分子中存在3个六元环,E和F在化学式上相差2个H原子。
已知①RCH2Cl+HCN发生取代生成RCH2CN,RCH2CN进一步水解得RCH2COOH;②由于溴苯的溴原子参与苯环的共轭,溴苯在强碱性溶液中水解过程十分困难,需要在高温(300℃)、以铜离子作催化剂的条件下进行。
⑴ 请画出A、D、F的结构简式:A_________ 、D_______ 、F_____________ ;
⑵ B有多种同分异构体,请写出一种含苯环且苯环上二元取代、含有醛基且能使FeCl3溶液变紫色的同分异构体:________________ 。
⑶ A可能发生的化学反应的类型有____________________ 。(写出二种)
⑷ 写出化合物 与新制的Cu(OH)2强碱性悬浊液共热至573K时发生反应的化学方程式
与新制的Cu(OH)2强碱性悬浊液共热至573K时发生反应的化学方程式______________________________ 。
⑸ D经过水解后的产物可通过缩聚反应生成高分子化合物,写出该缩聚反应的方程式__________________________________________________________ 。

A是酯;F分子中存在3个六元环,E和F在化学式上相差2个H原子。
已知①RCH2Cl+HCN发生取代生成RCH2CN,RCH2CN进一步水解得RCH2COOH;②由于溴苯的溴原子参与苯环的共轭,溴苯在强碱性溶液中水解过程十分困难,需要在高温(300℃)、以铜离子作催化剂的条件下进行。
⑴ 请画出A、D、F的结构简式:A
⑵ B有多种同分异构体,请写出一种含苯环且苯环上二元取代、含有醛基且能使FeCl3溶液变紫色的同分异构体:
⑶ A可能发生的化学反应的类型有
⑷ 写出化合物
 与新制的Cu(OH)2强碱性悬浊液共热至573K时发生反应的化学方程式
与新制的Cu(OH)2强碱性悬浊液共热至573K时发生反应的化学方程式⑸ D经过水解后的产物可通过缩聚反应生成高分子化合物,写出该缩聚反应的方程式
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
【推荐3】合成某药物的中间体G的流程如图:
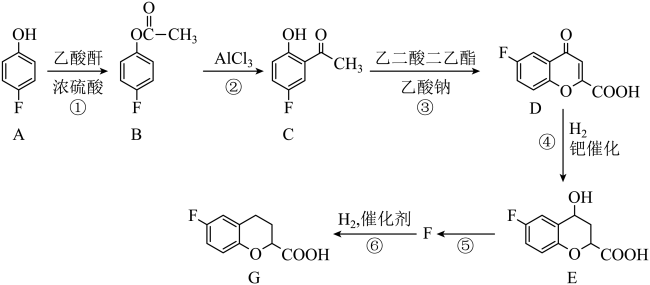
请回答下列问题:
(1)A的名称为_______ (系统命名法),反应①的反应类型是_______ 。
(2)C中含氧官能团的名称为_______ 。
(3)写出反应⑤的化学方程式:_______ 。
(4)写出满足下列条件的E的同分异构体的结构简式:_______ 。
①苯环上只有三个取代基;②核磁共振氢谱图中吸收峰面积比为4:2:2:1;
③1mol该物质与足量NaHCO3溶液反应生成2molCO2。
(5)根据已有知识并结合相关信息,写出以C6H5-OOCCH2CH3为原料制备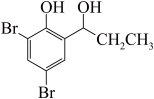 的合成路线流程图(无机试剂任选)。
的合成路线流程图(无机试剂任选)。_______ 。

请回答下列问题:
(1)A的名称为
(2)C中含氧官能团的名称为
(3)写出反应⑤的化学方程式:
(4)写出满足下列条件的E的同分异构体的结构简式:
①苯环上只有三个取代基;②核磁共振氢谱图中吸收峰面积比为4:2:2:1;
③1mol该物质与足量NaHCO3溶液反应生成2molCO2。
(5)根据已有知识并结合相关信息,写出以C6H5-OOCCH2CH3为原料制备
 的合成路线流程图(无机试剂任选)。
的合成路线流程图(无机试剂任选)。
您最近一年使用:0次





