在催化剂作用下,汽车尾气净化器中的主要反应: ,某科研小组在 2 L 恒容密闭容器中充入 5mol CO 和 5 mol NO,对该反应进行一系列的研究,在一定温度下测得 c(CO2)随时间(t)变化的曲线如图所示。
,某科研小组在 2 L 恒容密闭容器中充入 5mol CO 和 5 mol NO,对该反应进行一系列的研究,在一定温度下测得 c(CO2)随时间(t)变化的曲线如图所示。
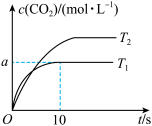
(1)反应达到平衡时,增大压强,反应向__________ 反应方向移动,T1 _____ T2(填“>”“<”或“=”),该反应的 H
H ___________ 0(填“>”“<”或“=”)。
(2)下列能说明该反应达到平衡状态的依据是___________ 。
A.NO 和 CO 的浓度之比为 1:1 B.混合气体平均相对分子质量不再改变
C.CO 和 N2浓度之比不再改变 D.混合气体密度不变
E. N2的浓度不再变化 F. 断裂 2 mol 氮氧键的同时,断裂 1 mol 氮氮三键
(3)在温度为 T1 ℃时,若反应到 10 s 时 N2的浓度为 1 mol·L-1,则 a=_________ ;NO 的转化率为___________ 。
(4)此反应的速率变化曲线如下图:
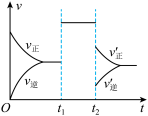
其它条件不变,只改变一种条件,则t1时刻改变的外界条件可能是____________ ,t 2 时刻改变的外界条件可能是 ___________ 。(不定项)
A.加入催化剂 B.压缩容器体积 C.升温 D.降温
E.扩大容器体积 F.恒容下,减少CO的用量 G.恒容下,移走部分CO2
 ,某科研小组在 2 L 恒容密闭容器中充入 5mol CO 和 5 mol NO,对该反应进行一系列的研究,在一定温度下测得 c(CO2)随时间(t)变化的曲线如图所示。
,某科研小组在 2 L 恒容密闭容器中充入 5mol CO 和 5 mol NO,对该反应进行一系列的研究,在一定温度下测得 c(CO2)随时间(t)变化的曲线如图所示。
(1)反应达到平衡时,增大压强,反应向
 H
H (2)下列能说明该反应达到平衡状态的依据是
A.NO 和 CO 的浓度之比为 1:1 B.混合气体平均相对分子质量不再改变
C.CO 和 N2浓度之比不再改变 D.混合气体密度不变
E. N2的浓度不再变化 F. 断裂 2 mol 氮氧键的同时,断裂 1 mol 氮氮三键
(3)在温度为 T1 ℃时,若反应到 10 s 时 N2的浓度为 1 mol·L-1,则 a=
(4)此反应的速率变化曲线如下图:

其它条件不变,只改变一种条件,则t1时刻改变的外界条件可能是
A.加入催化剂 B.压缩容器体积 C.升温 D.降温
E.扩大容器体积 F.恒容下,减少CO的用量 G.恒容下,移走部分CO2
更新时间:2024-03-24 14:22:26
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】合成气(CO+H2)可利用甲烷与水蒸气重整反应制得。
(1)已知:①
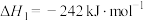
②

③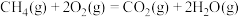
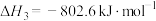
则甲烷和水蒸气重整反应:

_______  。该反应的活化能
。该反应的活化能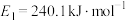 ,则逆反应的活化能
,则逆反应的活化能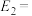
_______  。
。
(2)重整反应中 的平衡转化率与温度、压强的关系[其中
的平衡转化率与温度、压强的关系[其中 ]如图1所示。
]如图1所示。

①A点的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),比较A、B、C三点的平衡常数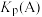 、
、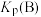 、
、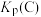 由大到小的顺序为
由大到小的顺序为_______ 。
②压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为_______ ,理由是_______ 。
(3)在恒容密闭容器中充入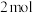 的
的 和
和 混合气体,且
混合气体,且 和
和 的物质的量之比为x,相同温度下测得
的物质的量之比为x,相同温度下测得 平衡产率与x的关系如图2所示。
平衡产率与x的关系如图2所示。
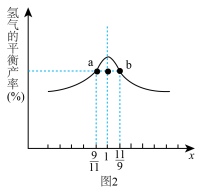
①比较a、b两点 的转化率:a点
的转化率:a点_______ b点(填“>”、“<”或“=”,下同),a点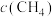
_______ b点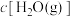 。
。
②当 时,下列叙述正确的是
时,下列叙述正确的是_______ (填字母)。
A.平衡常数K最大 B. 的转化率最大
的转化率最大
C.氢气的产率最大 D.合成气的浓度最大
(1)已知:①

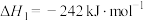
②


③
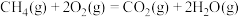
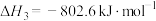
则甲烷和水蒸气重整反应:


 。该反应的活化能
。该反应的活化能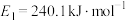 ,则逆反应的活化能
,则逆反应的活化能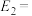
 。
。(2)重整反应中
 的平衡转化率与温度、压强的关系[其中
的平衡转化率与温度、压强的关系[其中 ]如图1所示。
]如图1所示。
①A点的平衡常数

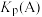 、
、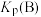 、
、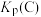 由大到小的顺序为
由大到小的顺序为②压强
 、
、 、
、 由大到小的顺序为
由大到小的顺序为(3)在恒容密闭容器中充入
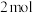 的
的 和
和 混合气体,且
混合气体,且 和
和 的物质的量之比为x,相同温度下测得
的物质的量之比为x,相同温度下测得 平衡产率与x的关系如图2所示。
平衡产率与x的关系如图2所示。
①比较a、b两点
 的转化率:a点
的转化率:a点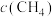
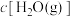 。
。②当
 时,下列叙述正确的是
时,下列叙述正确的是A.平衡常数K最大 B.
 的转化率最大
的转化率最大C.氢气的产率最大 D.合成气的浓度最大
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为: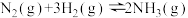 △H
△H
(1)已知每破坏1mol有关化学键需要的能量如下表:
则△H=___________ 。
(2)已知在400℃时,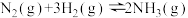 的K=0.5。
的K=0.5。
①在400℃时,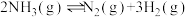 的K=
的K=___________ (填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应ν正(N2)___________ ν逆(N2)(填“>”、“<”或“=”)。
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡___________ 移动(填“向左”、“向右”或“不”);反应速率将___________ (填“增大”、“减小”或“不变”)。
(3)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中,投入H2NCOONH4(s),发生反应: ,写出平衡常数的表达式K=
,写出平衡常数的表达式K=___________ ,下列能说明该反应达到平衡状态的是___________ (填序号)。
①NH3分子中断裂2NA个N-H键,同时CO2分子中形成2NA个C=O键
②混合气体的密度保持不变
③反应体系的总压强保持不变
④NH3和CO2的浓度之比保持不变
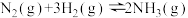 △H
△H(1)已知每破坏1mol有关化学键需要的能量如下表:
| H-H | N-H | N-N | N N N |
| 435.9KJ | 390.8kJ | 192.8kJ | 945.8kJ |
则△H=
(2)已知在400℃时,
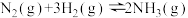 的K=0.5。
的K=0.5。①在400℃时,
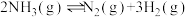 的K=
的K=②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应ν正(N2)
③若在恒温、恒压条件下向平衡体系中通入氩气,则合成氨反应的平衡
(3)H2NCOONH4是工业由氨气合成尿素的中间产物。在一定温度下、体积不变的密闭容器中,投入H2NCOONH4(s),发生反应:
 ,写出平衡常数的表达式K=
,写出平衡常数的表达式K=①NH3分子中断裂2NA个N-H键,同时CO2分子中形成2NA个C=O键
②混合气体的密度保持不变
③反应体系的总压强保持不变
④NH3和CO2的浓度之比保持不变
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ.回答下列问题:
(1)用括号内的字母代号填空:中和热测定实验时,若用环形铜丝代替环形玻璃搅拌棒,会导致测定的数值___________ (A.偏高;B.偏低)
Ⅱ.甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH=-206.0kJ·mol-1。该过程可分为以下两步反应完成:
CH3OCH3(g)+H2O(g) ΔH=-206.0kJ·mol-1。该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:2CO(g)+4H2(g) 2CH3OH(g) ΔH=-182.0 kJ·mol-1
2CH3OH(g) ΔH=-182.0 kJ·mol-1
ⅱ.甲醇脱水反应:
(2)请写出ⅱ中甲醇脱水反应的热化学方程式:___________ 。
(3)在一定条件下,将CO和H2按体积比1∶2充入恒容 密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列不能说明该反应达到平衡状态的是___________(填字母)。
(4)生产甲醚的过程中还存在以下副反应,与甲醇脱水反应形成竞争:CH3OH(g)+H2O(g)  CO2(g)+3H2(g) ΔH=+48.8 kJ·mol-1,将反应物混合气按进料比n(CO)∶n(H2)=1∶2通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。
CO2(g)+3H2(g) ΔH=+48.8 kJ·mol-1,将反应物混合气按进料比n(CO)∶n(H2)=1∶2通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。
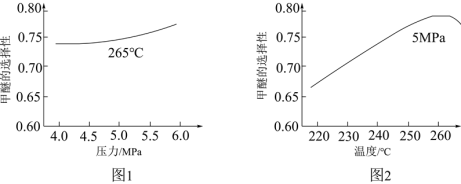
资料:甲醚的选择性是指转化为甲醚的CO在全部CO反应物中所占的比例。
①图1中,温度一定,压强增大,甲醚选择性增大的原因是___________ 。
②图2中,温度高于265℃后,甲醚选择性降低的原因是___________ 。
(1)用括号内的字母代号填空:中和热测定实验时,若用环形铜丝代替环形玻璃搅拌棒,会导致测定的数值
Ⅱ.甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g) ΔH=-206.0kJ·mol-1。该过程可分为以下两步反应完成:
CH3OCH3(g)+H2O(g) ΔH=-206.0kJ·mol-1。该过程可分为以下两步反应完成:ⅰ.甲醇合成反应:2CO(g)+4H2(g)
 2CH3OH(g) ΔH=-182.0 kJ·mol-1
2CH3OH(g) ΔH=-182.0 kJ·mol-1ⅱ.甲醇脱水反应:
(2)请写出ⅱ中甲醇脱水反应的热化学方程式:
(3)在一定条件下,将CO和H2按体积比1∶2充入
| A.混合气体的总物质的量保持不变 |
| B.混合气体的密度保持不变 |
| C.CH3OCH3(g)和H2O(g)的物质的量之比保持不变 |
| D.每生成1 mol CH3OCH3(g),同时生成2 mol CO |
 CO2(g)+3H2(g) ΔH=+48.8 kJ·mol-1,将反应物混合气按进料比n(CO)∶n(H2)=1∶2通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。
CO2(g)+3H2(g) ΔH=+48.8 kJ·mol-1,将反应物混合气按进料比n(CO)∶n(H2)=1∶2通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。
资料:甲醚的选择性是指转化为甲醚的CO在全部CO反应物中所占的比例。
①图1中,温度一定,压强增大,甲醚选择性增大的原因是
②图2中,温度高于265℃后,甲醚选择性降低的原因是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】“一氧化碳变换”是化工生产中的重要反应。研究表明,温度和催化剂是CO变换最重要的工艺条件,某工厂采用“一氧化碳中温−低温−低温串联变换法”,其工艺流程如图所示,图中的“1、2、3”为采用不同温度和催化剂的变换炉,变换炉之间为间壁式换热器。其中发生的主要反应为H2O(g)+CO(g)⇌CO2(g)+H2(g)
已知:①该反应用四氧化三铁作催化剂。其反应历程如下:
Ⅰ、Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)∆H=-13.6kJ/mol
Ⅱ、3Fe(s)+4H2O(g)⇌Fe3O4(s)+4H2(g)∆H=-151.2kJ/mol
②水分子首先被催化剂表面吸附并分解为氢气及吸附态的氧原子,当一氧化碳分子撞击到氧原子吸附层时被氧化为二氧化碳离开吸附剂表面。
③“汽气比”(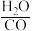 )指通入变换炉原料气中水蒸气与一氧化碳的体积比。
)指通入变换炉原料气中水蒸气与一氧化碳的体积比。
请回答:

(1)利于提高CO平衡转化率的条件有___
A.低温B.高温C.低压D.高压E.催化剂
(2)维持体系总压强p恒定,体积为V,在温度T时,在变换器通入总物质的量为n、汽气比为3的水蒸气和一氧化碳混合气体发生反应,已知一氧化碳的平衡转化率为α,则在该温度下反应的平衡常数K=___ 。(用α等符号表示)
(3)由于CO还原性较强,若将四氧化三铁还原成Fe,并以铁的形式大量存在于体系中,会使得催化剂催化活性明显降低,还会发生另外的催化反应等,实际生产中催化剂一般不会发生催化剂失去活性的情况。请说明理由___ 。
(4)实际生产中变换炉1中常用工艺条件为:使用铁基催化剂,控制温度在300℃∼400℃,汽气比3∼5,图1是实际生产中,在一定温度和不同汽气比条件下(其他条件一定)的一氧化碳转化率曲线。
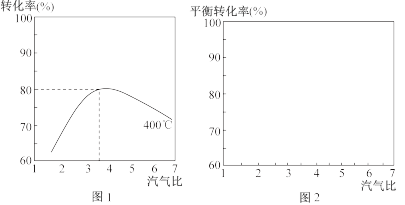
①分析说明当汽气比过大时,CO转化率下降的原因为___
②在图2中画出300℃时汽气比为2-5的CO平衡转化率曲线(不考虑副反应的影响)。______
③关于一氧化碳变换工艺的下列理解,正确的是___
A.反应Ⅰ受压强影响小,是因为该反应的△S=0
B.工业上可采用稍高于常压的条件,以加快反应速率
C.催化剂分段加装是为了增大接触面积,加快化学反应速率
D.可以研究适合更低温条件的催化剂,能降低能耗并提高一氧化碳转化率
E.适当增大汽气比有利于减少积炭
已知:①该反应用四氧化三铁作催化剂。其反应历程如下:
Ⅰ、Fe3O4(s)+4CO(g)⇌3Fe(s)+4CO2(g)∆H=-13.6kJ/mol
Ⅱ、3Fe(s)+4H2O(g)⇌Fe3O4(s)+4H2(g)∆H=-151.2kJ/mol
②水分子首先被催化剂表面吸附并分解为氢气及吸附态的氧原子,当一氧化碳分子撞击到氧原子吸附层时被氧化为二氧化碳离开吸附剂表面。
③“汽气比”(
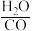 )指通入变换炉原料气中水蒸气与一氧化碳的体积比。
)指通入变换炉原料气中水蒸气与一氧化碳的体积比。请回答:

(1)利于提高CO平衡转化率的条件有
A.低温B.高温C.低压D.高压E.催化剂
(2)维持体系总压强p恒定,体积为V,在温度T时,在变换器通入总物质的量为n、汽气比为3的水蒸气和一氧化碳混合气体发生反应,已知一氧化碳的平衡转化率为α,则在该温度下反应的平衡常数K=
(3)由于CO还原性较强,若将四氧化三铁还原成Fe,并以铁的形式大量存在于体系中,会使得催化剂催化活性明显降低,还会发生另外的催化反应等,实际生产中催化剂一般不会发生催化剂失去活性的情况。请说明理由
(4)实际生产中变换炉1中常用工艺条件为:使用铁基催化剂,控制温度在300℃∼400℃,汽气比3∼5,图1是实际生产中,在一定温度和不同汽气比条件下(其他条件一定)的一氧化碳转化率曲线。

①分析说明当汽气比过大时,CO转化率下降的原因为
②在图2中画出300℃时汽气比为2-5的CO平衡转化率曲线(不考虑副反应的影响)。
③关于一氧化碳变换工艺的下列理解,正确的是
A.反应Ⅰ受压强影响小,是因为该反应的△S=0
B.工业上可采用稍高于常压的条件,以加快反应速率
C.催化剂分段加装是为了增大接触面积,加快化学反应速率
D.可以研究适合更低温条件的催化剂,能降低能耗并提高一氧化碳转化率
E.适当增大汽气比有利于减少积炭
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】一定条件下,发生如下反应:2C(g) 2A(g)+B(g)△H。
2A(g)+B(g)△H。
(1)若在容积为2.0L的恒容密闭容器中,A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如表:
根据表中数据,完成下列填空:
①在实验1中反应在20至30min内,此反应的平均速率v(B)=___ 。
②800℃时,此反应的平衡常数K=___ 。
③与实验1相比较,实验2采取的措施可能是___ 。
④若测得实验1到达平衡时___ (填“放出”或“吸收”)的热量为100kJ,试写出此反应的热化学方程式(不必注明温度与压强):___ 。
(2)在另一容器中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是___ 。
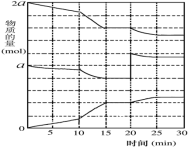
a.10~15min可能是升高了温度
b.10~15min可能是增大了压强
c.20min时可能是加入了一定量的C
d.10~15min时的K(化学平衡常数)与25~30min时的K相同
 2A(g)+B(g)△H。
2A(g)+B(g)△H。(1)若在容积为2.0L的恒容密闭容器中,A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如表:
| 实验序号 | 时间 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | n | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 730℃ | 1.0 | 0.90 | 0.80 | 0.75 | 0.70 | 0.65 | 0.65 |
①在实验1中反应在20至30min内,此反应的平均速率v(B)=
②800℃时,此反应的平衡常数K=
③与实验1相比较,实验2采取的措施可能是
④若测得实验1到达平衡时
(2)在另一容器中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是

a.10~15min可能是升高了温度
b.10~15min可能是增大了压强
c.20min时可能是加入了一定量的C
d.10~15min时的K(化学平衡常数)与25~30min时的K相同
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】乙酸制氢具有重要意义,发生的反应如下:
热裂解反应:

脱羧基反应:

(1)请写出 与
与 反应生成甲烷的热化学方程式:
反应生成甲烷的热化学方程式:___________ 。
(2)在密闭容器中,利用乙酸制氢,选择的压强为___________ (填“高压”或“常压”)。其中温度与气体产率的关系如图:
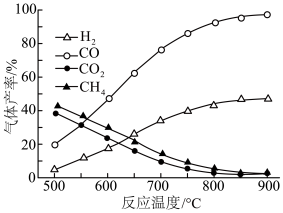
①约650℃之前,脱羧基反应活化能低,速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随着温度升高,热裂解反应速率加快,同时___________ 。
②保持其他条件不变,在乙酸气中掺杂一定量水,氢气产率显著提高而 的产率下降,请分析原因:
的产率下降,请分析原因:___________ 。
(3)若利用合适的催化剂控制其他副反应,温度为T℃时达到平衡,总压强为 ,热裂解反应消耗乙酸30%,脱羧基反应消耗乙酸50%,
,热裂解反应消耗乙酸30%,脱羧基反应消耗乙酸50%, 体积分数为
体积分数为___________ ;脱羧基反应的平衡常数 为
为___________  (
( 为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。
为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。
热裂解反应:


脱羧基反应:


(1)请写出
 与
与 反应生成甲烷的热化学方程式:
反应生成甲烷的热化学方程式:(2)在密闭容器中,利用乙酸制氢,选择的压强为

①约650℃之前,脱羧基反应活化能低,速率快,故氢气产率低于甲烷;650℃之后氢气产率高于甲烷,理由是随着温度升高,热裂解反应速率加快,同时
②保持其他条件不变,在乙酸气中掺杂一定量水,氢气产率显著提高而
 的产率下降,请分析原因:
的产率下降,请分析原因:(3)若利用合适的催化剂控制其他副反应,温度为T℃时达到平衡,总压强为
 ,热裂解反应消耗乙酸30%,脱羧基反应消耗乙酸50%,
,热裂解反应消耗乙酸30%,脱羧基反应消耗乙酸50%, 体积分数为
体积分数为 为
为 (
( 为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。
为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。
您最近半年使用:0次



