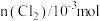Ⅰ.回答下列问题:
(1)用括号内的字母代号填空:中和热测定实验时,若用环形铜丝代替环形玻璃搅拌棒,会导致测定的数值___________ (A.偏高;B.偏低)
Ⅱ.甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH=-206.0kJ·mol-1。该过程可分为以下两步反应完成:
CH3OCH3(g)+H2O(g) ΔH=-206.0kJ·mol-1。该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:2CO(g)+4H2(g) 2CH3OH(g) ΔH=-182.0 kJ·mol-1
2CH3OH(g) ΔH=-182.0 kJ·mol-1
ⅱ.甲醇脱水反应:
(2)请写出ⅱ中甲醇脱水反应的热化学方程式:___________ 。
(3)在一定条件下,将CO和H2按体积比1∶2充入恒容 密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列不能说明该反应达到平衡状态的是___________(填字母)。
(4)生产甲醚的过程中还存在以下副反应,与甲醇脱水反应形成竞争:CH3OH(g)+H2O(g)  CO2(g)+3H2(g) ΔH=+48.8 kJ·mol-1,将反应物混合气按进料比n(CO)∶n(H2)=1∶2通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。
CO2(g)+3H2(g) ΔH=+48.8 kJ·mol-1,将反应物混合气按进料比n(CO)∶n(H2)=1∶2通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。
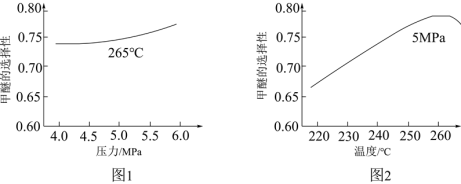
资料:甲醚的选择性是指转化为甲醚的CO在全部CO反应物中所占的比例。
①图1中,温度一定,压强增大,甲醚选择性增大的原因是___________ 。
②图2中,温度高于265℃后,甲醚选择性降低的原因是___________ 。
(1)用括号内的字母代号填空:中和热测定实验时,若用环形铜丝代替环形玻璃搅拌棒,会导致测定的数值
Ⅱ.甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g) ΔH=-206.0kJ·mol-1。该过程可分为以下两步反应完成:
CH3OCH3(g)+H2O(g) ΔH=-206.0kJ·mol-1。该过程可分为以下两步反应完成:ⅰ.甲醇合成反应:2CO(g)+4H2(g)
 2CH3OH(g) ΔH=-182.0 kJ·mol-1
2CH3OH(g) ΔH=-182.0 kJ·mol-1ⅱ.甲醇脱水反应:
(2)请写出ⅱ中甲醇脱水反应的热化学方程式:
(3)在一定条件下,将CO和H2按体积比1∶2充入
| A.混合气体的总物质的量保持不变 |
| B.混合气体的密度保持不变 |
| C.CH3OCH3(g)和H2O(g)的物质的量之比保持不变 |
| D.每生成1 mol CH3OCH3(g),同时生成2 mol CO |
 CO2(g)+3H2(g) ΔH=+48.8 kJ·mol-1,将反应物混合气按进料比n(CO)∶n(H2)=1∶2通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。
CO2(g)+3H2(g) ΔH=+48.8 kJ·mol-1,将反应物混合气按进料比n(CO)∶n(H2)=1∶2通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。
资料:甲醚的选择性是指转化为甲醚的CO在全部CO反应物中所占的比例。
①图1中,温度一定,压强增大,甲醚选择性增大的原因是
②图2中,温度高于265℃后,甲醚选择性降低的原因是
更新时间:2024-01-11 20:50:25
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】(1)为消除氮氧化物(NOx)的污染,可采用甲烷催化还原法:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+ 2NO2(g)=N2(g) +CO2(g) +2H2O(g) △H3=-867kJ/mol
则△H2=_________ 。
(2)甲醇催化脱氢可制得重要的化工产品——甲醛,制备过程中能量的转化关系如图所示。

①写出上述反应的热化学方程式______________ 。
②反应热大小比较:过程I______ 过程II(填“大于”、“小于”或“等于”)。
③上述反应过程中,需向体系中通入适量空气,控制条件消耗体系中的H2,既提高甲醛产率,同时使反应温度保持不变,则理论上n(CH3OH) :n(空气)=________ 。(已知:H2(g) + O2(g)==H2O(g) △H=-a kJ/mol,空气中O2 的体积分数为0.2)
O2(g)==H2O(g) △H=-a kJ/mol,空气中O2 的体积分数为0.2)
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
②CO2(g)+H2(g) CO(g)+H2O(g) △H>0
CO(g)+H2O(g) △H>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图所示。图中的压强由大到小顺序为_____ ,判断理由是_____________ ;试解释CO 平衡转化率随温度升高面减小的原因是__________________ 。

CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+ 2NO2(g)=N2(g) +CO2(g) +2H2O(g) △H3=-867kJ/mol
则△H2=
(2)甲醇催化脱氢可制得重要的化工产品——甲醛,制备过程中能量的转化关系如图所示。

①写出上述反应的热化学方程式
②反应热大小比较:过程I
③上述反应过程中,需向体系中通入适量空气,控制条件消耗体系中的H2,既提高甲醛产率,同时使反应温度保持不变,则理论上n(CH3OH) :n(空气)=
 O2(g)==H2O(g) △H=-a kJ/mol,空气中O2 的体积分数为0.2)
O2(g)==H2O(g) △H=-a kJ/mol,空气中O2 的体积分数为0.2)(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)
 CH3OH(g) △H<0
CH3OH(g) △H<0②CO2(g)+H2(g)
 CO(g)+H2O(g) △H>0
CO(g)+H2O(g) △H>0当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图所示。图中的压强由大到小顺序为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】化学能与热能在生产生活中扮演者重要的角色,按照要求回答下列各题。
I、键能、焓变及热化学方程式相关考点:
(1)已知拆开1molH-H键、1molI-I键、1molH-I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol碘反应生成HI会___________ (填“放出”或“吸收”)___________ kJ的热量。
(2)1gH2燃烧生成液态水,放出142.9kJ热量,该反应的热化方程式为:___________ 。
(3)为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·moL-1;2H2(g)+O2(g)=2H2O(g) ΔH=-483.6KJ·moL-1;H2O(g)=H2O(l) ΔH=-44.0KJ·moL-1
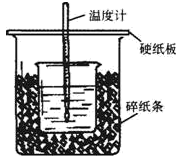
50mL0.55mol·L-1盐酸与50mL0.50mol·L-1NaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和热。回答下列问题:___________ 。
(5)烧杯间填满碎纸条的作用是___________ 。
(6)若大烧杯上不盖硬纸板,求得的中和热___________ (填“偏大”“偏小”或“无影响”)。
(7)实验中若改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(忽略测量误差,下同)___________ (填“相等”或“不相等”),所求中和热___________ (填“相等”或“不相等”)。
(8)仍按50mL0.55mol·L-1盐酸与50mL0.50mol·L-1NaOH溶液测定中和热。若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差t2-t1分别为①2.2℃,②3.5℃,③3.3℃,④3.4℃,则最终代入计算式的温差均值应该为___________ ℃。已知溶液的比热容4.18J/(g·℃),密度为1g/mL。计算所得中和热ΔH=___________ kJ/mol(计算结果保留一位小数)。
I、键能、焓变及热化学方程式相关考点:
(1)已知拆开1molH-H键、1molI-I键、1molH-I键分别需要吸收的能量为436kJ、151kJ、299kJ。则由1mol氢气和1mol碘反应生成HI会
(2)1gH2燃烧生成液态水,放出142.9kJ热量,该反应的热化方程式为:
(3)为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·moL-1;2H2(g)+O2(g)=2H2O(g) ΔH=-483.6KJ·moL-1;H2O(g)=H2O(l) ΔH=-44.0KJ·moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式
50mL0.55mol·L-1盐酸与50mL0.50mol·L-1NaOH溶液在如下图所示的装置中进行中和反应,通过测定反应过程中放出的热量可计算中和热。回答下列问题:

(5)烧杯间填满碎纸条的作用是
(6)若大烧杯上不盖硬纸板,求得的中和热
(7)实验中若改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(忽略测量误差,下同)
(8)仍按50mL0.55mol·L-1盐酸与50mL0.50mol·L-1NaOH溶液测定中和热。若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差t2-t1分别为①2.2℃,②3.5℃,③3.3℃,④3.4℃,则最终代入计算式的温差均值应该为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题:
(1)根据图1数据计算反应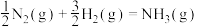 的
的
___________  。
。

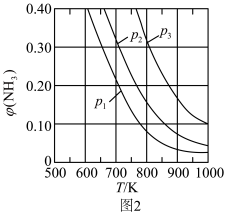
(2)合成氮的原料混合气体的进料组成为 ;
;
①在不同压强下反应达平衡时,氨的体积分数 与温度的关系如图2所示,其中压强(
与温度的关系如图2所示,其中压强( 、
、 、
、 )
)由小到大 的顺序为___________ 。
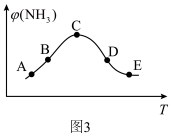
②将混合气体匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中 的体积分数
的体积分数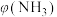 关系如图3所示,图3中各点表示的状态一定
关系如图3所示,图3中各点表示的状态一定未达到 平衡的是___________ (填字母)。
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是___________(填字母)。
(4)氮氧化物会造成环境污染,SCR技术利用 选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
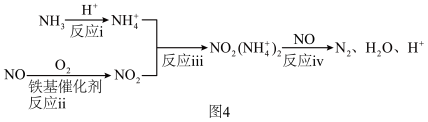
①对于反应ii: ,用
,用 表示的速率方程为
表示的速率方程为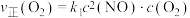 ;用
;用 表示的速率方程为
表示的速率方程为 ,
, 与
与 分别表示速率常数,则
分别表示速率常数,则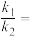
___________ (填数值)。
②根据上述机理,等物质的量的 、NO在有氧条件下完全转化为
、NO在有氧条件下完全转化为 的总反应化学方程式为
的总反应化学方程式为___________ 。
(1)根据图1数据计算反应
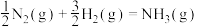 的
的
 。
。
(2)合成氮的原料混合气体的进料组成为
 ;
;①在不同压强下反应达平衡时,氨的体积分数
 与温度的关系如图2所示,其中压强(
与温度的关系如图2所示,其中压强( 、
、 、
、 )
)
②将混合气体匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中
 的体积分数
的体积分数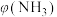 关系如图3所示,图3中各点表示的状态一定
关系如图3所示,图3中各点表示的状态一定
(3)合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是___________(填字母)。
| A.采用较高温度(400~500℃) | B.将生成的氨液化并及时从体系中分离出来 |
| C.用铁触媒加快化学反应速率 | D.采用较高压强(20~50MPa) |
(4)氮氧化物会造成环境污染,SCR技术利用
 选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
选择性催化还原氮氧化物。铁基催化剂在260~300℃范围内实现SCR技术的过程如图4:
①对于反应ii:
 ,用
,用 表示的速率方程为
表示的速率方程为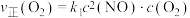 ;用
;用 表示的速率方程为
表示的速率方程为 ,
, 与
与 分别表示速率常数,则
分别表示速率常数,则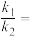
②根据上述机理,等物质的量的
 、NO在有氧条件下完全转化为
、NO在有氧条件下完全转化为 的总反应化学方程式为
的总反应化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】(1)按要求完成下列问题
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为________ (填“吸热”或“放热”)反应。
②已知常温下CO转化成CO2的能量关系如图所示。写出该反应的热化学方程式:______ 。
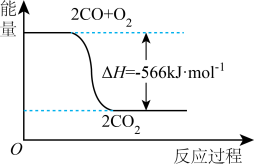
(2) N2H4和H2O2混合可作火箭推进剂,已知:0.5molN2H4(l)和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O 2(l)=O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。
①反应N2H4(l)+O2(g)=N2(g)+2H2O(l)的ΔH=__________ kJ·mol-1。
②N2H4(l)和H2O2(l)反应生成N2(g)和H2O(l)的热化学方程式为_______ 。将上述反应设计成原电池如图所示,KOH溶液作为电解质溶液。

③a极电极反应式为_______ ;
④当负极区溶液增重18g,则电路中转移电子总数为__________ ;
(3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。
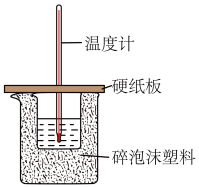
①该装置缺少一种玻璃仪器,该仪器的名称为_________________ ;
②实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应最好选择_____________ mol·L-1的NaOH溶液进行实验。
③若实验过程中分多次加入所选浓度的NaOH溶液,会导致所测得的中和热ΔH__________ (填“偏大”、“偏小”或“无影响”)。
①若反应物的总能量为E1,生成物的总能量为E2,且E1>E2,则该反应为
②已知常温下CO转化成CO2的能量关系如图所示。写出该反应的热化学方程式:

(2) N2H4和H2O2混合可作火箭推进剂,已知:0.5molN2H4(l)和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O 2(l)=O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。
①反应N2H4(l)+O2(g)=N2(g)+2H2O(l)的ΔH=
②N2H4(l)和H2O2(l)反应生成N2(g)和H2O(l)的热化学方程式为

③a极电极反应式为
④当负极区溶液增重18g,则电路中转移电子总数为
(3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。

①该装置缺少一种玻璃仪器,该仪器的名称为
②实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应最好选择
③若实验过程中分多次加入所选浓度的NaOH溶液,会导致所测得的中和热ΔH
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】煤、石油等传统能源使用时污染严重,且日渐枯竭,科学家们正积极寻找其他清洁能源作为替代品。根据所学知识,回答下列问题:
(1)下列反应中,属于放热反应的是___________(填标号)。
(2)键能通常是指在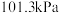 和298K下,将
和298K下,将 气态分子拆开成气态原子时,每个键所需能量的平均值,键能用E表示。已知:
气态分子拆开成气态原子时,每个键所需能量的平均值,键能用E表示。已知:
计算: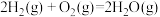

___________ 。
(3)已知在25℃、101kPa时:
Ⅰ.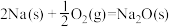

Ⅱ.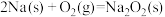

写出 与
与 反应生成
反应生成 的热化学方程式:
的热化学方程式:___________ 。
(4)利用实验装置测定盐酸与 溶液发生中和反应的反应热,若取
溶液发生中和反应的反应热,若取
 的盐酸,则还需加入
的盐酸,则还需加入___________ (填标号)。
A.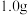
 固体
固体
B.
 氨水
氨水
C.

 溶液
溶液
(5)甲醚( )是重要的化工原料,可由
)是重要的化工原料,可由 和
和 反应制得,反应的热化学方程式为
反应制得,反应的热化学方程式为
 ,起始时向容器中投入
,起始时向容器中投入
 和
和
 ,某时刻测得该反应放出的热量为
,某时刻测得该反应放出的热量为 ,此时
,此时 的转化率为
的转化率为___________ 。
(6)某同学设计如图所示实验,探究反应中的能量变化。

分析下列操作可能对结果造成的影响___________(填“偏大”、“偏小”或“不变”)。
①将实验(a)中的铝片更换为等质量的铝粉后,释放出的能量将___________ ;
②将实验(b)中玻璃搅拌器改为铁质搅拌器后,实验测得的
___________ 。
(1)下列反应中,属于放热反应的是___________(填标号)。
A.碳与 反应 反应 | B.铝和氧化铁反应 |
C. 受热分解 受热分解 | D.锌与盐酸反应 |
(2)键能通常是指在
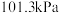 和298K下,将
和298K下,将 气态分子拆开成气态原子时,每个键所需能量的平均值,键能用E表示。已知:
气态分子拆开成气态原子时,每个键所需能量的平均值,键能用E表示。已知:| 化学键 |  |  |  |
键能/( ) ) | 436 | 496 | 463.4 |
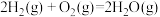

(3)已知在25℃、101kPa时:
Ⅰ.
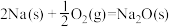

Ⅱ.
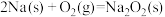

写出
 与
与 反应生成
反应生成 的热化学方程式:
的热化学方程式:(4)利用实验装置测定盐酸与
 溶液发生中和反应的反应热,若取
溶液发生中和反应的反应热,若取
 的盐酸,则还需加入
的盐酸,则还需加入A.
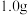
 固体
固体B.

 氨水
氨水C.


 溶液
溶液(5)甲醚(
 )是重要的化工原料,可由
)是重要的化工原料,可由 和
和 反应制得,反应的热化学方程式为
反应制得,反应的热化学方程式为
 ,起始时向容器中投入
,起始时向容器中投入
 和
和
 ,某时刻测得该反应放出的热量为
,某时刻测得该反应放出的热量为 ,此时
,此时 的转化率为
的转化率为(6)某同学设计如图所示实验,探究反应中的能量变化。

分析下列操作可能对结果造成的影响___________(填“偏大”、“偏小”或“不变”)。
①将实验(a)中的铝片更换为等质量的铝粉后,释放出的能量将
②将实验(b)中玻璃搅拌器改为铁质搅拌器后,实验测得的

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某学生通过测定反应过程中所放出的热量来计算中和热。他将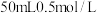 的盐酸与
的盐酸与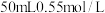 的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
 从实验装置上看,图中尚缺少的一种玻璃用品是
从实验装置上看,图中尚缺少的一种玻璃用品是___________ ;由图可知该装置有不妥之处?___________ 。
 实验中改用
实验中改用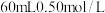 的盐酸跟
的盐酸跟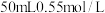 的NaOH溶液进行反应,与上述实验相比,所放出的热量
的NaOH溶液进行反应,与上述实验相比,所放出的热量___________  填“相等”或“不相等”
填“相等”或“不相等” ;所求中和热的数值会
;所求中和热的数值会___________  填“相等”或“不相等”
填“相等”或“不相等” 。
。
 该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是___________
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视计数
E.将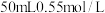 氢氧化钠溶液取成了
氢氧化钠溶液取成了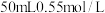 的氨水
的氨水
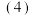 将
将 溶液和
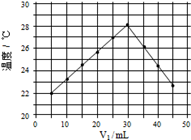
溶液和 未知浓度的NaOH溶液混合均匀后测量并记录温度,实验结果如下图所示
未知浓度的NaOH溶液混合均匀后测量并记录温度,实验结果如下图所示 实验中始终保持
实验中始终保持 ,该NaOH溶液的浓度约为
,该NaOH溶液的浓度约为___________  。
。
 若取
若取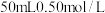 盐酸与
盐酸与 溶液置于如图所示的装置中进行中和热的测定实验,测定结果如下表所示:
溶液置于如图所示的装置中进行中和热的测定实验,测定结果如下表所示:
已知盐酸、NaOH溶液密度近似为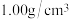 ,中和后混合液的比热容
,中和后混合液的比热容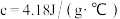 ,根据上表数据,求出该反应的中和热△H=
,根据上表数据,求出该反应的中和热△H=___________ (保留2位小数
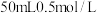 的盐酸与
的盐酸与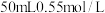 的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
的NaOH溶液在如图所示的装置中进行中和反应。请回答下列问题:
 从实验装置上看,图中尚缺少的一种玻璃用品是
从实验装置上看,图中尚缺少的一种玻璃用品是 实验中改用
实验中改用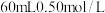 的盐酸跟
的盐酸跟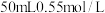 的NaOH溶液进行反应,与上述实验相比,所放出的热量
的NaOH溶液进行反应,与上述实验相比,所放出的热量 填“相等”或“不相等”
填“相等”或“不相等” ;所求中和热的数值会
;所求中和热的数值会 填“相等”或“不相等”
填“相等”或“不相等” 。
。 该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
该同学做实验时有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视计数
E.将
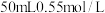 氢氧化钠溶液取成了
氢氧化钠溶液取成了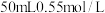 的氨水
的氨水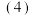 将
将 溶液和
溶液和 未知浓度的NaOH溶液混合均匀后测量并记录温度,实验结果如下图所示
未知浓度的NaOH溶液混合均匀后测量并记录温度,实验结果如下图所示 实验中始终保持
实验中始终保持 ,该NaOH溶液的浓度约为
,该NaOH溶液的浓度约为 。
。
 若取
若取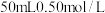 盐酸与
盐酸与 溶液置于如图所示的装置中进行中和热的测定实验,测定结果如下表所示:
溶液置于如图所示的装置中进行中和热的测定实验,测定结果如下表所示:| 实验序号 | 起始温度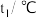 | 终止温度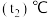 | ||
| 盐酸 | NaOH溶液 | 平均值 | ||
| 1 | 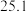 | 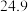 | 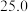 | 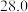 |
| 2 | 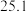 | 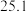 | 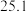 | 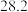 |
| 3 | 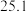 | 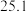 | 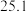 |  |
| 4 | 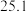 | 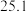 | 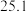 | 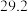 |
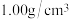 ,中和后混合液的比热容
,中和后混合液的比热容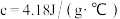 ,根据上表数据,求出该反应的中和热△H=
,根据上表数据,求出该反应的中和热△H=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】某矿石的组成为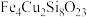 ,以此为原料实现如下转化:
,以此为原料实现如下转化:
请回答:
(1)下列说法正确的是________(填序号)。
(2) 与矿石中金属阳离子的配位能力由强到弱的顺序是
与矿石中金属阳离子的配位能力由强到弱的顺序是________ 。
(3)生成深蓝色溶液的化学方程式为________ 。
(4) 遇酸会迅速分解,请设计实验证明氧化产物与还原产物
遇酸会迅速分解,请设计实验证明氧化产物与还原产物________ 。 遇酸分解的离子方程式为
遇酸分解的离子方程式为________ 。
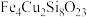 ,以此为原料实现如下转化:
,以此为原料实现如下转化:
请回答:
(1)下列说法正确的是________(填序号)。
A. 是由极性键形成的极性分子 是由极性键形成的极性分子 |
B.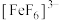 的氧化性弱于 的氧化性弱于 |
| C.矿石中Si与O形成相互独立的正四面体结构 |
D.固体A中含有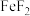 |
(2)
 与矿石中金属阳离子的配位能力由强到弱的顺序是
与矿石中金属阳离子的配位能力由强到弱的顺序是(3)生成深蓝色溶液的化学方程式为
(4)
 遇酸会迅速分解,请设计实验证明氧化产物与还原产物
遇酸会迅速分解,请设计实验证明氧化产物与还原产物 遇酸分解的离子方程式为
遇酸分解的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】杭州亚运会主火炬的燃料首次使用废碳再生的绿色甲醇,甲醇火炬被称为“零碳”火炬。目前,我国在相关设备及技术方面全球领先。请回答:
(1)二氧化碳催化加氢制甲醇的反应可表示为: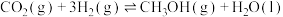 。
。
①已知: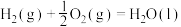
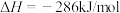


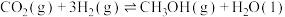
 =
=______ kJ/mol。该反应能自发进行的条件是______ 。
②在恒容条件下能加快二氧化碳催化加氢制甲醇的反应速率,并提高 转化率的措施是
转化率的措施是______ 。
③若二氧化碳催化加氢制甲醇的反应在恒温恒容的密闭容器中进行,能说明反应达到平衡状态的是______ ,(填字母)。
A.容器内压强不随时间变化 B.容器内各物质的浓度相等
C.单位时间消耗1mol ,同时生成3mol
,同时生成3mol D.混合气体的密度不再改变
D.混合气体的密度不再改变
(2)电催化法是制备甲醇的途径之一,原理如图所示。

①室温下, 溶液
溶液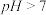 ,
, 水解的离子方程式为
水解的离子方程式为______ 。
② 电极的电极反应式为
电极的电极反应式为______ 。
③与其他有机合成相比,电有机合成的优点是______ 。
(1)二氧化碳催化加氢制甲醇的反应可表示为:
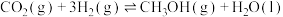 。
。①已知:
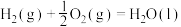
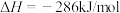


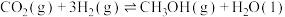
 =
=②在恒容条件下能加快二氧化碳催化加氢制甲醇的反应速率,并提高
 转化率的措施是
转化率的措施是③若二氧化碳催化加氢制甲醇的反应在恒温恒容的密闭容器中进行,能说明反应达到平衡状态的是
A.容器内压强不随时间变化 B.容器内各物质的浓度相等
C.单位时间消耗1mol
 ,同时生成3mol
,同时生成3mol D.混合气体的密度不再改变
D.混合气体的密度不再改变(2)电催化法是制备甲醇的途径之一,原理如图所示。

①室温下,
 溶液
溶液 ,
, 水解的离子方程式为
水解的离子方程式为②
 电极的电极反应式为
电极的电极反应式为③与其他有机合成相比,电有机合成的优点是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

(1)若t1=15时,则t0~t1s内以C物质浓度变化表示的反应速率v(C)=_______ ;
(2)写出反应的化学方程式:________________________ ;
(3)t1 s时,A的转化率为__________ ,此时v(A)正______ v(B)逆(选填“>”、“<”或“=”);
Ⅱ.已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2。在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2。在温度973K和1173K情况下,K1、K2的值分别如下:
(4)通过表格中的数值可以推断:反应①是__________ (填“吸热”或“放热”)反应。
(5)现有反应③CO2(g)+H2 (g) CO(g)+H2O(g),能判断反应③已达平衡状态的是_______________________________
CO(g)+H2O(g),能判断反应③已达平衡状态的是_______________________________
(6)根据反应①与②可推导出K1、K2与K3之间的关系式_______________________ 。据此关系式及上表数据,也能推断出反应③是______ (填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是______ (填写序号)。
A缩小反应容器容积 B扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(7)一定温度下,某恒容密闭容器中发生反应 ,若原料气中
,若原料气中 ,测得m与CO2的平衡转化率(α)的关系如图所示。
,测得m与CO2的平衡转化率(α)的关系如图所示。

若平衡时A点容器内总压强为0.5MPa,则上述反应的平衡常数。
______  (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。

(1)若t1=15时,则t0~t1s内以C物质浓度变化表示的反应速率v(C)=
(2)写出反应的化学方程式:
(3)t1 s时,A的转化率为
Ⅱ.已知化学反应①:Fe(s)+CO2(g)
 FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2。在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数为K2。在温度973K和1173K情况下,K1、K2的值分别如下:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(4)通过表格中的数值可以推断:反应①是
(5)现有反应③CO2(g)+H2 (g)
 CO(g)+H2O(g),能判断反应③已达平衡状态的是_______________________________
CO(g)+H2O(g),能判断反应③已达平衡状态的是_______________________________| A.容器中压强不变 | B.混合气体中c(CO)不变 |
| C.v正(H2)=v逆(H2O) | D.c(CO2)=c(CO) |
(6)根据反应①与②可推导出K1、K2与K3之间的关系式
A缩小反应容器容积 B扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(7)一定温度下,某恒容密闭容器中发生反应
 ,若原料气中
,若原料气中 ,测得m与CO2的平衡转化率(α)的关系如图所示。
,测得m与CO2的平衡转化率(α)的关系如图所示。
若平衡时A点容器内总压强为0.5MPa,则上述反应的平衡常数。

 (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】硝酸是一种具有强氧化性、腐蚀性的一元无机强酸,它也是一种重要的化工原料。氨氧化法生产硝酸是世界上生产硝酸的主要方法,其制备过程如图所示,回答下列问题:
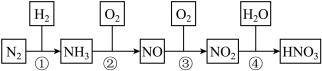
(1)关于NO和NO2的说法错误的是_______(填标号)。
(2)将装有50mLNO2、NO混合气体的量筒倒立在水槽中,反应后气体体积缩小为30mL,则原混合气体中NO2和NO的体积比是_______ 。
(3)热电厂通常用NH3消除燃煤烟气中的NO2,生成两种无污染的产物,写出该反应的化学方程式:_______ 。
(4)制备过程中②是氨的催化氧化反应,化学研究小组将经加热的铂丝插入锥形瓶内(如图所示),此时锥形瓶相当于氧化炉,可观察到铂丝保持红热,瓶口有红棕色气体生成,写出氨的催化氧化反应的化学方程式:_______ ,该反应_______ (填“吸热”或“放热”)。

(5)工业上合成氨反应的化学方程式为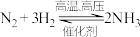 ,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
①下列情况不能 说明N2与H2反应一定达到化学平衡状态的是_______ (填标号)。
A.NH3的质量不再变化 B.单位时间内消耗1molN2同时生成3molH2
C.容器内的压强不再变化 D.容器内N2、H2和NH3的分子数之比为1:3:2
②若2min末测得容器内NH3的物质的量为0.6mol,则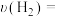
_______ mol·L-1·min-1。
(6)足量的铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.12LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是_______  。
。

(1)关于NO和NO2的说法错误的是_______(填标号)。
| A. NO2易溶于水生成HNO3,故NO2是酸性氧化物 |
| B.N2与O2反应时,不论O2是否足量,其一步反应都只能得到NO,不能生成NO2 |
| C.常温常压下,无色的NO能与空气中的O2直接化合生成红棕色的NO2 |
| D.在NO2与水的反应中,氧化剂与还原剂的质量之比为2:1 |
(3)热电厂通常用NH3消除燃煤烟气中的NO2,生成两种无污染的产物,写出该反应的化学方程式:
(4)制备过程中②是氨的催化氧化反应,化学研究小组将经加热的铂丝插入锥形瓶内(如图所示),此时锥形瓶相当于氧化炉,可观察到铂丝保持红热,瓶口有红棕色气体生成,写出氨的催化氧化反应的化学方程式:

(5)工业上合成氨反应的化学方程式为
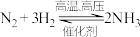 ,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。①下列情况
A.NH3的质量不再变化 B.单位时间内消耗1molN2同时生成3molH2
C.容器内的压强不再变化 D.容器内N2、H2和NH3的分子数之比为1:3:2
②若2min末测得容器内NH3的物质的量为0.6mol,则
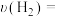
(6)足量的铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.12LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】近年来,随着聚酯工业的快速发展,Cl2的需求量和HCl的产出量也随之迅速增长。Deacon发明了直接氧化法(称作Deacon反应):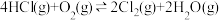 。
。
用O2将HCl转化为Cl2,可提高效益,减少污染。
回答下列问题:
(1)传统上Deacon反应可通过如图所示的催化剂循环实现。

Deacon反应的△H=_______ (用△H1和△H2表示)
(2)在恒温、体积为1L的刚性密闭容器中发生Deacon反应,HCl、O2初始投料分别为4mol、1mol。实验测得HCl平衡转化率(α(HCl))随温度变化的曲线如图。
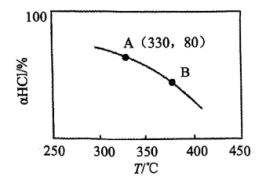
①下列说法能说明Deacon反应在此条件下到达平衡状态的有________ 。
A.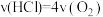 B.H2O的质量分数不变
B.H2O的质量分数不变
C. 不变 D.
不变 D. 不变
不变
②Deacon反应的△H________ 0(填“>”、“=”或“<”,下同),A、B两点的平衡常数K(A)与K(B)的大小关系是K(A)________ K(B)。
③Deacon反应在A点的平衡常数K=________ 。
④保持温度及投料比不变,提高HCl的平衡转化率的方法有________ 。(写出2种)
⑤若HCl、O2初始投料分别为5mol、1mol,画出相应α(HCl)-T曲线的示意图__________ 。
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
2.0~6.0min内以HCl的物质的量变化表示的反应速率为_______ mol·min-1。
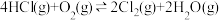 。
。用O2将HCl转化为Cl2,可提高效益,减少污染。
回答下列问题:
(1)传统上Deacon反应可通过如图所示的催化剂循环实现。

Deacon反应的△H=
(2)在恒温、体积为1L的刚性密闭容器中发生Deacon反应,HCl、O2初始投料分别为4mol、1mol。实验测得HCl平衡转化率(α(HCl))随温度变化的曲线如图。

①下列说法能说明Deacon反应在此条件下到达平衡状态的有
A.
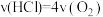 B.H2O的质量分数不变
B.H2O的质量分数不变C.
 不变 D.
不变 D. 不变
不变②Deacon反应的△H
③Deacon反应在A点的平衡常数K=
④保持温度及投料比不变,提高HCl的平衡转化率的方法有
⑤若HCl、O2初始投料分别为5mol、1mol,画出相应α(HCl)-T曲线的示意图
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
| 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| 0 | 1.8 | 3.7 | 5.4 | 7.2 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】氮及其化合物在科研及生产中均有重要的应用。根据已学知识回答下列问题:
I.汽车尾气中发生的反应有:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746kJ•mol-1
(1)已知部分化学键的键能(如表所示)
由以上数据可求得NO的键能为_______ kJ•mol-1。
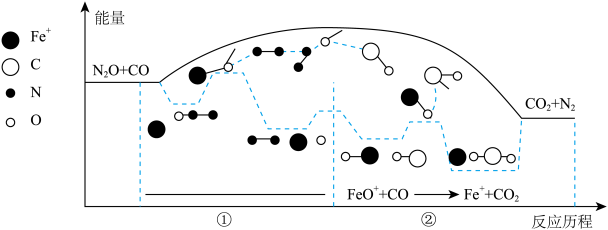
(2)有毒气体N2O、CO在Fe+催化下发生的反应是:N2O(g)+CO(g)=CO2(g)+N2(g),其反应分两步进行(如图所示),写出其中反应①的化学方程式:_______ 。总反应速率的快慢主要由其中一步反应决定,该反应是_______ (填“①”或“②”)。
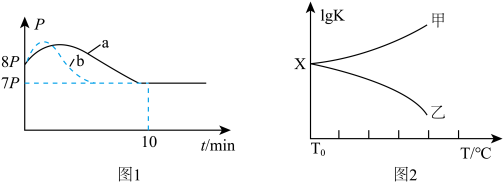
(3)①向体积为2L且带气压计的恒容密闭容器中通入2molNO和2molCO。若反应起始和平衡时温度相同(均为T0℃),测得反应过程中压强(P)随时间(t)的变化如图1曲线a所示,若其它条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图1曲线b所示,则改变的条件是______ ,0~10min内用CO表示的平均反应速率为_______ ,该温度时反应的分压平衡常数为_______ (用p表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图2是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是________ (填“甲”或“乙”)。
Ⅱ.也可用NH3催化消除NO污染:4NH3(g)+6NO(g) 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
(4)将1.0molNH3和1.2molNO加入某恒容密闭容器中,发生上述反应。若在相同时间内,测得NH3的转化率随温度的变化曲线如图。
①下列说法正确的是______ 。

A.若容器内混合气体的平均相对分子质量不变,则反应达到平衡状态
B.图中a、b、c点均为平衡状态
C.图中a点和c点消耗的氨气一样,所以这两点对应的速率相等
②在300℃~400℃之间NH3的转化率快速上升的原因可能有:温度升高加快了化学反应速率、_______ 。
I.汽车尾气中发生的反应有:2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746kJ•mol-1
(1)已知部分化学键的键能(如表所示)
| 化学键 | C≡O | N≡N | C=O |
| E(kJ/mol) | 1076 | 945 | 745 |
(2)有毒气体N2O、CO在Fe+催化下发生的反应是:N2O(g)+CO(g)=CO2(g)+N2(g),其反应分两步进行(如图所示),写出其中反应①的化学方程式:

(3)①向体积为2L且带气压计的恒容密闭容器中通入2molNO和2molCO。若反应起始和平衡时温度相同(均为T0℃),测得反应过程中压强(P)随时间(t)的变化如图1曲线a所示,若其它条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图1曲线b所示,则改变的条件是
②图2是甲、乙两同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是

Ⅱ.也可用NH3催化消除NO污染:4NH3(g)+6NO(g)
 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。(4)将1.0molNH3和1.2molNO加入某恒容密闭容器中,发生上述反应。若在相同时间内,测得NH3的转化率随温度的变化曲线如图。
①下列说法正确的是

A.若容器内混合气体的平均相对分子质量不变,则反应达到平衡状态
B.图中a、b、c点均为平衡状态
C.图中a点和c点消耗的氨气一样,所以这两点对应的速率相等
②在300℃~400℃之间NH3的转化率快速上升的原因可能有:温度升高加快了化学反应速率、
您最近一年使用:0次