氨基甲酸铵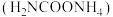 是一种重要的化工原料,可用于药物合成、制备化学肥料、灭火剂或洗涤剂等。某化学兴趣小组用如图所示装置制取氨基甲酸铵:
是一种重要的化工原料,可用于药物合成、制备化学肥料、灭火剂或洗涤剂等。某化学兴趣小组用如图所示装置制取氨基甲酸铵:
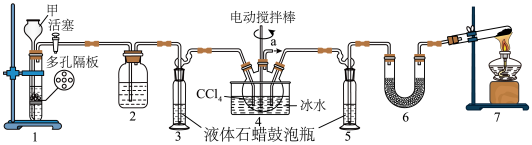
已知:①制取氨基甲酸铵反应为: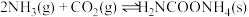
 。
。
②氨基甲酸铵溶于水后生成 和
和 。
。
回答下列问题:
(1)仪器甲的名称是___________ ,装置2的作用是除去 中的水蒸气,其盛装的试剂是
中的水蒸气,其盛装的试剂是___________ 。
(2)装置7是实验室制备氨气,其化学方程式为___________ 。
(3)液体石蜡鼓泡瓶的作用是___________ 。
(4)实验制得产品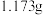 ,其中可能含有碳酸氢铵杂质(不考虑碳酸氢铵与一水合氨的之间的反应)。设计方案进行成分探究,请填写表中空格。
,其中可能含有碳酸氢铵杂质(不考虑碳酸氢铵与一水合氨的之间的反应)。设计方案进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀硝酸、 溶液、澄清石灰水、
溶液、澄清石灰水、 溶液、稀盐酸。
溶液、稀盐酸。
通过计算氨基甲酸铵的质量分数是___________ 。(保留小数点后两位)[ 、
、 ]
]
(5)氨基甲酸铵易分解,用如图所示装置测定 时该分解反应的化学平衡常数
时该分解反应的化学平衡常数 ,实验步骤如下:
,实验步骤如下:

(Ⅰ)关闭 ,打开
,打开 和
和 ,开启真空泵抽气至测压仪数值稳定后关闭
,开启真空泵抽气至测压仪数值稳定后关闭 。
。
(Ⅱ)关闭 ,
,___________ ,读取压强数值。
测得 时压强为
时压强为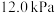 。
。
①请在空白处完善步骤Ⅱ的实验操作。
②若步骤I中测压仪数值未稳定即关闭 ,
, 测量值
测量值___________ (选填“偏大”、“偏小”或“无影响”)。
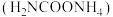 是一种重要的化工原料,可用于药物合成、制备化学肥料、灭火剂或洗涤剂等。某化学兴趣小组用如图所示装置制取氨基甲酸铵:
是一种重要的化工原料,可用于药物合成、制备化学肥料、灭火剂或洗涤剂等。某化学兴趣小组用如图所示装置制取氨基甲酸铵:
已知:①制取氨基甲酸铵反应为:
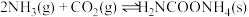
 。
。②氨基甲酸铵溶于水后生成
 和
和 。
。回答下列问题:
(1)仪器甲的名称是
 中的水蒸气,其盛装的试剂是
中的水蒸气,其盛装的试剂是(2)装置7是实验室制备氨气,其化学方程式为
(3)液体石蜡鼓泡瓶的作用是
(4)实验制得产品
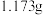 ,其中可能含有碳酸氢铵杂质(不考虑碳酸氢铵与一水合氨的之间的反应)。设计方案进行成分探究,请填写表中空格。
,其中可能含有碳酸氢铵杂质(不考虑碳酸氢铵与一水合氨的之间的反应)。设计方案进行成分探究,请填写表中空格。限选试剂:蒸馏水、稀硝酸、
 溶液、澄清石灰水、
溶液、澄清石灰水、 溶液、稀盐酸。
溶液、稀盐酸。| 实验步骤 | 预期现象和结论 |
| 步骤1:取固体样品于试管中,加入蒸馏水至固体溶解 | 得到无色溶液 |
| 步骤2:向试管中继续加入足量澄清石灰水 | |
步骤3:过滤、洗涤、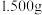 | 证明样品中有碳酸氢铵 |
 、
、 ]
](5)氨基甲酸铵易分解,用如图所示装置测定
 时该分解反应的化学平衡常数
时该分解反应的化学平衡常数 ,实验步骤如下:
,实验步骤如下:
(Ⅰ)关闭
 ,打开
,打开 和
和 ,开启真空泵抽气至测压仪数值稳定后关闭
,开启真空泵抽气至测压仪数值稳定后关闭 。
。(Ⅱ)关闭
 ,
,测得
 时压强为
时压强为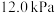 。
。①请在空白处完善步骤Ⅱ的实验操作。
②若步骤I中测压仪数值未稳定即关闭
 ,
, 测量值
测量值
更新时间:2024-03-28 16:35:19
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】联氨(N2H4)又称肼,是一种应用广泛的化工原料;次磷酸钠( NaH2PO2 )是常用的次磷酸盐。二者都是重要的还原剂。
(1)已知:①2N2H4(l) +N2O4(l) =3N2(g) +4H2O(g) △H1= - 1038. 7kJ∙mol-1
②N2O4(l) =N2(g) +2O2(g) △H2= +204.3 kJ∙mol -1
③H2O(g) = H2O(l) △H3= -44 kJ∙mol -1
请写出表示N2H4(l)的燃烧热的热化学方程式_______ 。
(2)已知反应N2H4(g) + 2Cl2(g)⇌N2(g) +4HCl(g) ,T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ;测得Cl2和HCl的浓度随时间的关系如图所示。
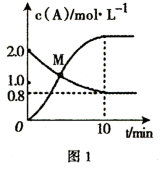
①0~ 10 min内,用HCl( g)表示的平均反应速率:v(HCl)=_______ 。
②M点时,Cl2的转化率为_______ % (精确到0.1)。
③T °C时,达到平衡后再向该容器中加入1.2 mol N2H4(g) 0.4 mol Cl2 (g)、0.8 mol N2(g)、1. 2 mol HCl(g), 此时平衡_______ (填“正向移动”“逆向移动’'或“不移动”)。
(3)①次磷酸(H3PO2)是一元弱酸,常温下,1.0 mol•L-1的NaH2PO2溶液pH为8,则次磷酸的Ka =_______ 。
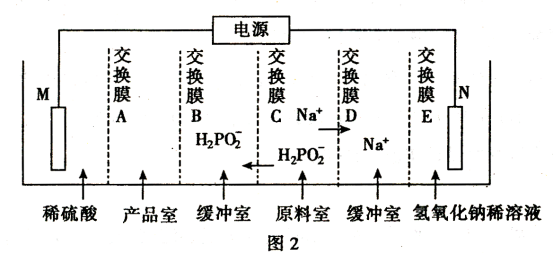
②用次磷酸钠通过电渗析法制备次磷酸,装置如图2所示。交换膜A属于_______ (填“阳离子”或“阴离子”)交换膜,电极N的电极反应式为_______ ,当电路中流过1.9264×105库仑电量时,制得次磷酸的物质的量为_______ (结果取整数) (已知一个电子的电量为1.6×10-19库仑,NA数值约为6.02×1023)。
(1)已知:①2N2H4(l) +N2O4(l) =3N2(g) +4H2O(g) △H1= - 1038. 7kJ∙mol-1
②N2O4(l) =N2(g) +2O2(g) △H2= +204.3 kJ∙mol -1
③H2O(g) = H2O(l) △H3= -44 kJ∙mol -1
请写出表示N2H4(l)的燃烧热的热化学方程式
(2)已知反应N2H4(g) + 2Cl2(g)⇌N2(g) +4HCl(g) ,T°C时,向V L恒容密闭容器中加入2 mol N2H4(g)和4 mol Cl2(g) ;测得Cl2和HCl的浓度随时间的关系如图所示。

①0~ 10 min内,用HCl( g)表示的平均反应速率:v(HCl)=
②M点时,Cl2的转化率为
③T °C时,达到平衡后再向该容器中加入1.2 mol N2H4(g) 0.4 mol Cl2 (g)、0.8 mol N2(g)、1. 2 mol HCl(g), 此时平衡
(3)①次磷酸(H3PO2)是一元弱酸,常温下,1.0 mol•L-1的NaH2PO2溶液pH为8,则次磷酸的Ka =
②用次磷酸钠通过电渗析法制备次磷酸,装置如图2所示。交换膜A属于

您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】CO、CO2是化石燃料燃烧的主要产物。
(1)将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2 固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加_________ g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1,键能Eo-o=499.0kJ·mol-1。
①反应:CO(g)+O2(g) CO2(g)+O(g)的△H=
CO2(g)+O(g)的△H=_________ kJ·mol-1。
②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2)·c(O),则此时v(正)_________ (填“>” 、“<”或“=”)v(逆)。
③已知1500℃时,在密闭容器中发生反应:CO2(g) CO(g)+O(g)。反应过程中O(g)的 物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 v(CO2)=
CO(g)+O(g)。反应过程中O(g)的 物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 v(CO2)=_________ 。

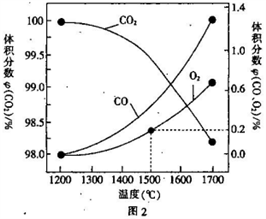
(3)在某密闭容器中发生反应:2CO2(g) 2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。
2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有_________ (填字母)。
A.CO 的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO 的浓度等于生成CO2 的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数 K=_________ (计算结果保留1 位小数)。
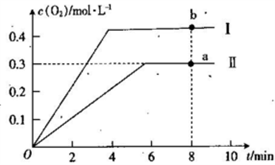
③向恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g) 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是_________ ;a、 两点用CO浓度变化表示的净反应速率关系为va(CO)_________ (填“>”“<”或“=”) vb( CO)。
(1)将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2 固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1,键能Eo-o=499.0kJ·mol-1。
①反应:CO(g)+O2(g)
 CO2(g)+O(g)的△H=
CO2(g)+O(g)的△H=②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2)·c(O),则此时v(正)
③已知1500℃时,在密闭容器中发生反应:CO2(g)
 CO(g)+O(g)。反应过程中O(g)的 物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 v(CO2)=
CO(g)+O(g)。反应过程中O(g)的 物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 v(CO2)=
(3)在某密闭容器中发生反应:2CO2(g)
 2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。
2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有
A.CO 的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO 的浓度等于生成CO2 的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数 K=
③向恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)
 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】利用1—甲基萗(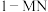 )制备四氢萘类物质(
)制备四氢萘类物质( ,包括
,包括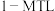 和
和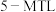 )。反应过程中伴有生成十氢萘(
)。反应过程中伴有生成十氢萘(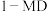 )的副反应,涉及反应如图:
)的副反应,涉及反应如图:

回答下列问题:
(1)已知一定条件下反应 、
、 、
、 的焓变分别为
的焓变分别为 、
、 、
、 ,则反应
,则反应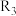 的焓变为
的焓变为_______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(2)四个平衡体系的平衡常数与温度的关系如图甲所示。
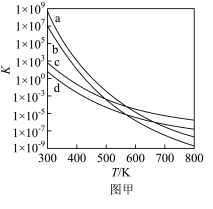
①a、b分别为反应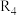 和
和 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应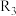 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为_______ 。
②已知反应 的速率方程
的速率方程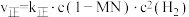 ,
,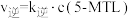 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关),温度
分别为正、逆反应速率常数,只与温度、催化剂有关),温度 下反应达到平衡时
下反应达到平衡时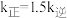 ,温度
,温度 下反应达到平衡时
下反应达到平衡时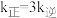 ,由此推知,
,由此推知,
_______  (填“>”,“<”或“=”)。
(填“>”,“<”或“=”)。
③下列说法正确的是_______ 。
A.四个反应均为放热反应
B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中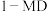 最稳定
最稳定
D.由上述信息可知,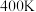 时反应
时反应 速率最快
速率最快
(3)不同温度下达平衡时各产物的选择性 (某生成物
(某生成物 的物质的量与消耗
的物质的量与消耗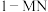 的物质的量之比)和物质的量分数
的物质的量之比)和物质的量分数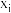 (
(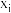 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随
外其他各物种总物质的量之比)随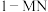 平衡转化率y的变化关系如图所示,从热力学角度分析,
平衡转化率y的变化关系如图所示,从热力学角度分析,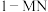 生成
生成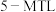 的
的
_______ 生成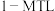 的
的 (填“大于”或“小于”);
(填“大于”或“小于”);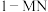 平衡转化率y为80%时,
平衡转化率y为80%时,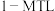 的产率=
的产率=_______ (用含c的式子表示);四氢萘类物质的物质的量分数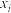 随
随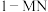 平衡转化率先增大后减小,结合平衡移动原理解释原因
平衡转化率先增大后减小,结合平衡移动原理解释原因_______ 。

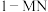 )制备四氢萘类物质(
)制备四氢萘类物质( ,包括
,包括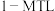 和
和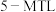 )。反应过程中伴有生成十氢萘(
)。反应过程中伴有生成十氢萘(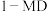 )的副反应,涉及反应如图:
)的副反应,涉及反应如图:
回答下列问题:
(1)已知一定条件下反应
 、
、 、
、 的焓变分别为
的焓变分别为 、
、 、
、 ,则反应
,则反应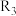 的焓变为
的焓变为 、
、 、
、 的代数式表示)。
的代数式表示)。(2)四个平衡体系的平衡常数与温度的关系如图甲所示。

①a、b分别为反应
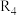 和
和 的平衡常数随温度变化的曲线,则表示反应
的平衡常数随温度变化的曲线,则表示反应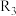 的平衡常数随温度变化曲线为
的平衡常数随温度变化曲线为②已知反应
 的速率方程
的速率方程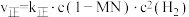 ,
,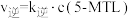 (
( 、
、 分别为正、逆反应速率常数,只与温度、催化剂有关),温度
分别为正、逆反应速率常数,只与温度、催化剂有关),温度 下反应达到平衡时
下反应达到平衡时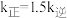 ,温度
,温度 下反应达到平衡时
下反应达到平衡时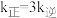 ,由此推知,
,由此推知,
 (填“>”,“<”或“=”)。
(填“>”,“<”或“=”)。③下列说法正确的是
A.四个反应均为放热反应
B.压强越大,温度越低越有利于生成四氢萘类物质
C.反应体系中
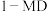 最稳定
最稳定D.由上述信息可知,
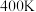 时反应
时反应 速率最快
速率最快(3)不同温度下达平衡时各产物的选择性
 (某生成物
(某生成物 的物质的量与消耗
的物质的量与消耗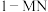 的物质的量之比)和物质的量分数
的物质的量之比)和物质的量分数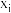 (
(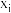 表示物种i与除
表示物种i与除 外其他各物种总物质的量之比)随
外其他各物种总物质的量之比)随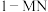 平衡转化率y的变化关系如图所示,从热力学角度分析,
平衡转化率y的变化关系如图所示,从热力学角度分析,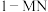 生成
生成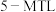 的
的
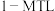 的
的 (填“大于”或“小于”);
(填“大于”或“小于”);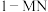 平衡转化率y为80%时,
平衡转化率y为80%时,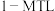 的产率=
的产率=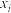 随
随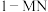 平衡转化率先增大后减小,结合平衡移动原理解释原因
平衡转化率先增大后减小,结合平衡移动原理解释原因
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。已知:锶与镁位于同主族;锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。
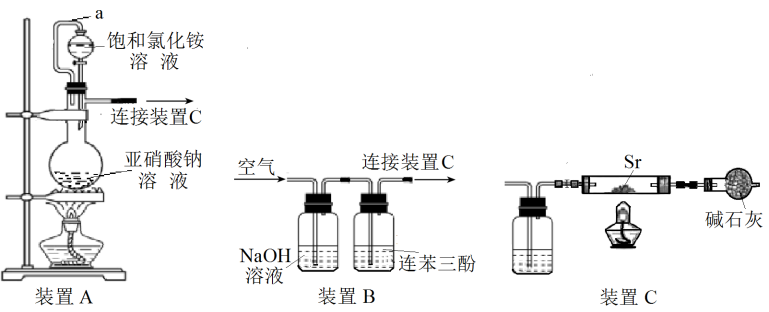
Ⅰ、利用装置A和C制备Sr3N2
(1)实验装置中玻璃管之间需用橡皮管连接,其连接方法是先将_______ ,然后稍稍用力即可将玻璃管插入橡皮管。
(2)写出由装置A制备N2的化学反应方程式_______ 。
(3)装置A中仪器a的名称_______ ,其中导管的作用是_______ 。利用该套装置时,有同学提出应先点燃装置A中的酒精灯一段时间后,再点燃装置C中的酒精灯,其理由是_______ 。
Ⅱ、利用装置B和C制备Sr3N2。利用装置B从空气中提纯N2(已知:氧气可被连苯三酚溶液定量吸收)
(4)写出装置B的NaOH溶液中发生反应的离子方程式_______ 。
(5)装置C中广口瓶盛放的试剂是_______ 。
Ⅲ、测定Sr3N2产品的纯度。
(6)取10.0g该产品,向其中加入适量的水,将生成的气体全部通入浓硫酸中,利用浓硫酸增重质量计算得到产品的纯度,该方法测得产品的纯度偏高,其原因是_______ 。经改进后测得浓硫酸增重0.68g,则产品的纯度为_______ 。

Ⅰ、利用装置A和C制备Sr3N2
(1)实验装置中玻璃管之间需用橡皮管连接,其连接方法是先将
(2)写出由装置A制备N2的化学反应方程式
(3)装置A中仪器a的名称
Ⅱ、利用装置B和C制备Sr3N2。利用装置B从空气中提纯N2(已知:氧气可被连苯三酚溶液定量吸收)
(4)写出装置B的NaOH溶液中发生反应的离子方程式
(5)装置C中广口瓶盛放的试剂是
Ⅲ、测定Sr3N2产品的纯度。
(6)取10.0g该产品,向其中加入适量的水,将生成的气体全部通入浓硫酸中,利用浓硫酸增重质量计算得到产品的纯度,该方法测得产品的纯度偏高,其原因是
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】实验室用下图所示装置制备KClO溶液,再用KClO溶液与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。

已知:Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
回答下列问题:
(1)仪器a的名称___________ ,装置C中三颈瓶置于冰水浴中的目的是______________________ 。
(2)装置B吸收的气体是____________ (写化学式),装置D的作用是____________________ 。
(3)装置C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,控制水浴温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),反应的离子方程式为____________________ 。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯方法为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,过滤,将盛有滤液的烧杯______________________ ,搅拌、静置、过滤,用乙醇洗涤固体2~3次,最后将固体放在真空干燥箱中干燥。
(5)测定K2FeO4产品纯度。称取K2FeO4产品0.2100 g于烧杯中,加入足量的强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol·L-1的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗标准溶液30.00 mL[已知:Cr(OH)4-+FeO42-=Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+=Cr2O72-+H2O,Cr2O72-+6Fe2++14H+=6Fe3++3Cr3++7H2O]。则K2FeO4产品的纯度为_________ %(保留1位小数)。

已知:Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
回答下列问题:
(1)仪器a的名称
(2)装置B吸收的气体是
(3)装置C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,控制水浴温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),反应的离子方程式为
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯方法为:将一定量的K2FeO4粗产品溶于冷的3 mol·L-1KOH溶液中,过滤,将盛有滤液的烧杯
(5)测定K2FeO4产品纯度。称取K2FeO4产品0.2100 g于烧杯中,加入足量的强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol·L-1的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗标准溶液30.00 mL[已知:Cr(OH)4-+FeO42-=Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+=Cr2O72-+H2O,Cr2O72-+6Fe2++14H+=6Fe3++3Cr3++7H2O]。则K2FeO4产品的纯度为
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】 是一种重要的杀菌消毒剂。实验室模拟生产
是一种重要的杀菌消毒剂。实验室模拟生产 的一种工艺如下:
的一种工艺如下:

已知:① 是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②
是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。② 饱和溶液在温度低于38℃时析出
饱和溶液在温度低于38℃时析出 晶体,高于38℃时析出的晶体是
晶体,高于38℃时析出的晶体是 ,高于60℃时
,高于60℃时 分解成
分解成 和NaCl。回答:
和NaCl。回答:
(1) 中所含的化学键类型有
中所含的化学键类型有___________ ;实验室制取 的化学方程式是
的化学方程式是___________ 。
(2)上述流程中“反应”的离子方程式为___________ ;尾气吸收时 的作用是
的作用是___________ 。(填“氧化剂”或“还原剂”)。
(3)最近科学家又在“反应”步骤的基础上研究出用 代替
代替 制备
制备 的新方法,其原理为:
的新方法,其原理为: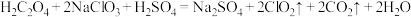 。该新方法最突出的优点是
。该新方法最突出的优点是___________ 。
(4)测定产品 的纯度。取上述所得产品7.5g溶于水配成1L溶液,取出20.00mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(
的纯度。取上述所得产品7.5g溶于水配成1L溶液,取出20.00mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后( 被还原为
被还原为 ,杂质不参加反应),加入2~3滴淀粉溶液,用
,杂质不参加反应),加入2~3滴淀粉溶液,用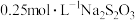 标准液滴定,达到滴定终点时,溶液呈
标准液滴定,达到滴定终点时,溶液呈___________ (填“蓝色”或“无色”),用去标准液24.00mL,计算产品 的纯度
的纯度___________ 。(提示: )
)
 是一种重要的杀菌消毒剂。实验室模拟生产
是一种重要的杀菌消毒剂。实验室模拟生产 的一种工艺如下:
的一种工艺如下:
已知:①
 是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②
是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。② 饱和溶液在温度低于38℃时析出
饱和溶液在温度低于38℃时析出 晶体,高于38℃时析出的晶体是
晶体,高于38℃时析出的晶体是 ,高于60℃时
,高于60℃时 分解成
分解成 和NaCl。回答:
和NaCl。回答:(1)
 中所含的化学键类型有
中所含的化学键类型有 的化学方程式是
的化学方程式是(2)上述流程中“反应”的离子方程式为
 的作用是
的作用是(3)最近科学家又在“反应”步骤的基础上研究出用
 代替
代替 制备
制备 的新方法,其原理为:
的新方法,其原理为: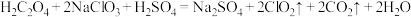 。该新方法最突出的优点是
。该新方法最突出的优点是(4)测定产品
 的纯度。取上述所得产品7.5g溶于水配成1L溶液,取出20.00mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后(
的纯度。取上述所得产品7.5g溶于水配成1L溶液,取出20.00mL溶液于锥形瓶中,再加入足量酸化的KI溶液,充分反应后( 被还原为
被还原为 ,杂质不参加反应),加入2~3滴淀粉溶液,用
,杂质不参加反应),加入2~3滴淀粉溶液,用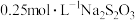 标准液滴定,达到滴定终点时,溶液呈
标准液滴定,达到滴定终点时,溶液呈 的纯度
的纯度 )
)
您最近半年使用:0次



