某班同学用如下实验探究Fe2+、Fe3+的性质:
(1)甲组同学取2mL0.1mol•L-1FeSO4溶液,加1滴KSCN溶液,无明显现象,再加几滴3%H2O2溶液(用H2SO4酸化至pH=1),溶液颜色变红。甲组同学通过上述实验分析Fe2+具有______ (填“氧化”或“还原”)性。写出上面划线处操作所发生反应的离子方程式______ 。
(2)针对Fe3++3SCN- Fe(SCN)3,下列说法正确的是
Fe(SCN)3,下列说法正确的是______ 。(不定项)
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入1滴KSCN溶液和13%H2O2溶液,溶液变红,煤油的作用是______ 。
(4)同时乙组同学查阅资料发现Fe2+与SCN-可发生反应,生成无色的电中性配合物。为证实该性质,乙组同学用FeCO3进行了如图所示的a和b两组实验:
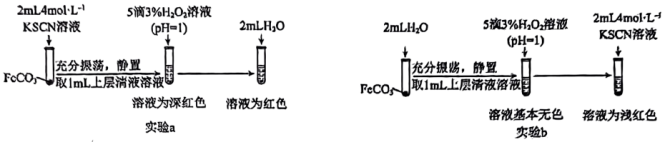
写出实验a中FeCO3与KSCN反应的离子方程式______ ,实验b的目的是______ 。
(5)反应S2O (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。
(aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。

①写出反应历程中“速率决定步骤”的热化学方程式:______ 。
②反应过程中由于Fe2+浓度较低而不容易被检测到,请回答Fe2+浓度较低的原因:______ 。
(6)溶液中Fe2+与邻二集非X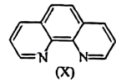 会生成橘黄色的配合物Y。
会生成橘黄色的配合物Y。
①邻二氮菲提供的配位原子是______ 。
②使用该方法时,需要控制pH在2~9之间,其原因为:______ 。
③取2.00mLc(Fe2+)=6.0×10-4mol/L的溶液,加入不同体积、浓度均为c(X)=6.0×10-4mol/L的邻二氮菲溶液,充分反应后加水定容至25mL,得到系列溶液,测其吸光度,结果如表:
已知吸光度A与有色物质的浓度 成正比。Fe2+和邻二氮菲X的吸光度近似为0。
成正比。Fe2+和邻二氮菲X的吸光度近似为0。
Fe2++nX=Y(橘黄色)
结合上面实验数据,通过计算回答Y中Fe2+的配位数(与中心原子或离子以配位键形式结合的配位原子数目):______ 。
(1)甲组同学取2mL0.1mol•L-1FeSO4溶液,加1滴KSCN溶液,无明显现象,再加几滴3%H2O2溶液(用H2SO4酸化至pH=1),溶液颜色变红。甲组同学通过上述实验分析Fe2+具有
(2)针对Fe3++3SCN-
 Fe(SCN)3,下列说法正确的是
Fe(SCN)3,下列说法正确的是| A.增大KSCN溶液的浓度,平衡常数增大 |
| B.向上述平衡体系中加入适量KCl圆体,平衡不移动 |
| C.加水稀释,平衡向左移动,且溶液的红色变浅 |
D.加入少量铁粉,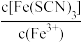 减小 减小 |
(4)同时乙组同学查阅资料发现Fe2+与SCN-可发生反应,生成无色的电中性配合物。为证实该性质,乙组同学用FeCO3进行了如图所示的a和b两组实验:

写出实验a中FeCO3与KSCN反应的离子方程式
(5)反应S2O
 (aq)+2I-(aq)=2SO
(aq)+2I-(aq)=2SO (aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。
(aq)+I2(aq)在加入Fe3+催化后,反应进程中的能量变化如图所示。已知:反应机理中有Fe2+出现。
①写出反应历程中“速率决定步骤”的热化学方程式:
②反应过程中由于Fe2+浓度较低而不容易被检测到,请回答Fe2+浓度较低的原因:
(6)溶液中Fe2+与邻二集非X
 会生成橘黄色的配合物Y。
会生成橘黄色的配合物Y。①邻二氮菲提供的配位原子是
②使用该方法时,需要控制pH在2~9之间,其原因为:
③取2.00mLc(Fe2+)=6.0×10-4mol/L的溶液,加入不同体积、浓度均为c(X)=6.0×10-4mol/L的邻二氮菲溶液,充分反应后加水定容至25mL,得到系列溶液,测其吸光度,结果如表:
| V(X)/mL | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 | 8.00 |
| 吸光度/A | 0.24 | 0.36 | 0.48 | 0.60 | 0.72 | 0.72 |
 成正比。Fe2+和邻二氮菲X的吸光度近似为0。
成正比。Fe2+和邻二氮菲X的吸光度近似为0。Fe2++nX=Y(橘黄色)
结合上面实验数据,通过计算回答Y中Fe2+的配位数(与中心原子或离子以配位键形式结合的配位原子数目):
更新时间:2024-03-31 07:46:17
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
【推荐1】工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:
2FeSO4="===" Fe2O3+SO2↑+SO3↑ 为检验FeSO4高温分解的产物,进行如下实验:
①取少量FeSO4高温分解得到的固体,加一定量稀盐酸溶解,向该溶液中加入适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
②将FeSO4高温分解产生的气体通入右图所示的装置中,以检验产生的气体中是否含有SO2和SO3。请回答以下问题:
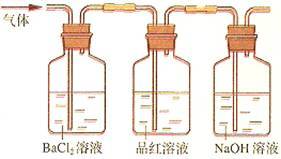
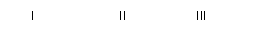
(1)写出用KSCN检验Fe3+的离子方程式_____________________________ 。
(2)装置I中试剂为氯化钡溶液,进行操作②时氯化钡溶液中有白色沉淀产生。甲同学说,这个白色沉淀可能是BaSO4和BaSO3的混合物;乙同学说,这个白色沉淀是BaSO4;丙同学说,这个白色沉淀是BaSO3。请你设计一个简单的实验帮他们加以鉴别。________________________________ ;你认为上述哪一位同学的观点正确?____________________
(3)装置II中试剂为品红溶液,其作用是___________________ ,品红溶液中可观察到现象是______________________________________ 。
(4)装置III中试剂为NaOH溶液,其目的是________________________ 。
2FeSO4="===" Fe2O3+SO2↑+SO3↑ 为检验FeSO4高温分解的产物,进行如下实验:
①取少量FeSO4高温分解得到的固体,加一定量稀盐酸溶解,向该溶液中加入适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
②将FeSO4高温分解产生的气体通入右图所示的装置中,以检验产生的气体中是否含有SO2和SO3。请回答以下问题:

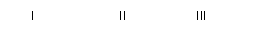
(1)写出用KSCN检验Fe3+的离子方程式
(2)装置I中试剂为氯化钡溶液,进行操作②时氯化钡溶液中有白色沉淀产生。甲同学说,这个白色沉淀可能是BaSO4和BaSO3的混合物;乙同学说,这个白色沉淀是BaSO4;丙同学说,这个白色沉淀是BaSO3。请你设计一个简单的实验帮他们加以鉴别。
(3)装置II中试剂为品红溶液,其作用是
(4)装置III中试剂为NaOH溶液,其目的是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
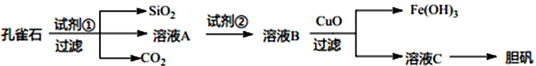
【推荐2】孔雀石主要含Cu2(OH)2CO3以及少量Fe、Si的化合物。可以用孔雀石为原料制备胆矾(CuSO4·5H2O) 步骤如下:
请回答下列问题:
(1)试剂①是一种常见的酸,写出其化学式__________ 。过滤所需要的玻璃仪器有__________ 。
(2)实验室检验Fe3+的常用方法是________________ 。
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+上述流程中需要用试剂②将溶液A中的Fe2+全部转化为Fe3+,从而形成溶液B,则试剂②能否用氯水________________ (填“能”或“不能”若“不能”,请解释原因)。
(4)由溶液C获得胆矾,需要经过________ 、__________ 、过滤等操作。
(5)取25.00mL溶液A,用1.000×10-2mol/LKMnO4标准溶液滴定。反应离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O,若消耗标准溶液20.00mL,则溶液A中Fe2+的浓度为_______________ 。

请回答下列问题:
(1)试剂①是一种常见的酸,写出其化学式
(2)实验室检验Fe3+的常用方法是
(3)溶液A中的金属离子有Cu2+、Fe2+、Fe3+上述流程中需要用试剂②将溶液A中的Fe2+全部转化为Fe3+,从而形成溶液B,则试剂②能否用氯水
(4)由溶液C获得胆矾,需要经过
(5)取25.00mL溶液A,用1.000×10-2mol/LKMnO4标准溶液滴定。反应离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O,若消耗标准溶液20.00mL,则溶液A中Fe2+的浓度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
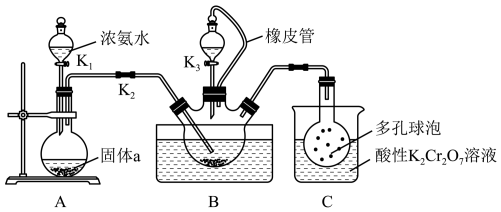
【推荐3】硫氰化钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品。某实验小组模拟工业制备硫氰化钾的方法,设计实验如图:
已知:CS2是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
I.制备NH4SCN溶液
(1)装置A用于制备NH3,圆底烧瓶内的固体a是___________ (填名称)。
(2)三颈烧瓶内盛放有CS2、水和固体催化剂,发生反应CS2+3NH3 NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是使反应更充分且
NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是使反应更充分且___________ 。
(3)一段时间后,当观察到三颈烧瓶内___________ 时,停止通入气体,反应完成。
II.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待NH4HS完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为___________ ;酸性K2Cr2O7溶液除可以吸收NH3外,还能吸收的气体是___________ 。
III.制备KSCN晶体
(5)先通过___________ (填实验操作名称)除去三颈烧瓶中的固体催化剂,再通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰化钾晶体。该提取过程中一定不用的仪器有___________ (填序号)。
①坩埚 ②蒸发皿 ③长颈漏斗 ④玻璃棒 ⑤烧杯 ⑥直形冷凝管
(6)测定晶体中KSCN的含量:称取10.0g样品,配成1000mL溶液。量取25.00mL溶液锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000mol/LAgNO3准溶液滴定,达到滴定终点,三次滴定平均消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色),则指示剂的化学式为___________ (填序号)。
A.FeCl3 B.Fe(NO3)3 C.Fe2(SO4)3 D.Fe(SCN)3
②晶体中KSCN的质量分数为___________ (计算结果保留三位有效数字)。

已知:CS2是一种不溶于水、密度大于水的非极性试剂。请回答下列问题:
I.制备NH4SCN溶液
(1)装置A用于制备NH3,圆底烧瓶内的固体a是
(2)三颈烧瓶内盛放有CS2、水和固体催化剂,发生反应CS2+3NH3
 NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是使反应更充分且
NH4SCN+NH4HS。实验开始时,打开K2和K1,水浴加热装置B,反应发生。三颈烧瓶左侧导管口必须插入CS2中,其目的是使反应更充分且(3)一段时间后,当观察到三颈烧瓶内
II.制备KSCN溶液
(4)关闭K1,将三颈烧瓶继续加热至100℃,待NH4HS完全分解后,再打开K3,继续保持水浴温度为100℃,缓缓滴入稍过量的KOH溶液,制得KSCN溶液。发生反应的化学方程式为
III.制备KSCN晶体
(5)先通过
①坩埚 ②蒸发皿 ③长颈漏斗 ④玻璃棒 ⑤烧杯 ⑥直形冷凝管
(6)测定晶体中KSCN的含量:称取10.0g样品,配成1000mL溶液。量取25.00mL溶液锥形瓶中,加入适量稀硝酸,再加入几滴铁盐溶液作指示剂,用0.1000mol/LAgNO3准溶液滴定,达到滴定终点,三次滴定平均消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN-+Ag+=AgSCN↓(白色),则指示剂的化学式为
A.FeCl3 B.Fe(NO3)3 C.Fe2(SO4)3 D.Fe(SCN)3
②晶体中KSCN的质量分数为
您最近一年使用:0次
【推荐1】氮氧化物( 、NO等)的处理和资源化利用具有重要意义。
、NO等)的处理和资源化利用具有重要意义。
(1)反应 分为三步基元反应完成。
分为三步基元反应完成。
第一步: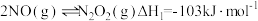 决速步骤)
决速步骤)
第二步: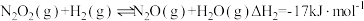
①活化能最高的是第___________ 步。
②为了提高总反应中NO的反应速率和转化率可采用的措施为___________ (写两条)。
(2)已知反应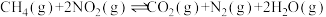 。某温度下向2.0L刚性密闭容器中充入
。某温度下向2.0L刚性密闭容器中充入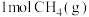 和
和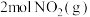 ,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
①用 表示0~4min内平均反应速率为
表示0~4min内平均反应速率为___________ 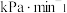 。
。
②该温度下的压强平衡常数
___________ kPa。
(3)NO催化分解ICl制取 和
和 的原理为:
的原理为:
反应I: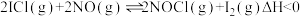 ;
;
反应Ⅱ: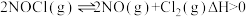 ;
; 。
。
反应的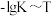 的关系如图所示。
的关系如图所示。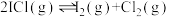 的
的
___________
(4)催化电解NO吸收液可生成多种物质,其中将NO还原为 的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。 的电极反应式为
的电极反应式为___________ 。
②当电解电压为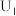 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 、NO等)的处理和资源化利用具有重要意义。
、NO等)的处理和资源化利用具有重要意义。(1)反应
 分为三步基元反应完成。
分为三步基元反应完成。第一步:
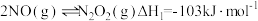 决速步骤)
决速步骤)第二步:
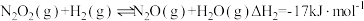
①活化能最高的是第
②为了提高总反应中NO的反应速率和转化率可采用的措施为
(2)已知反应
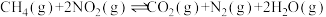 。某温度下向2.0L刚性密闭容器中充入
。某温度下向2.0L刚性密闭容器中充入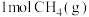 和
和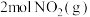 ,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:
,发生该反应,测得容器内气体总压强(p)与时间(t)的变化如下表所示:| 反应时间(t)/min | 0 | 2 | 4 | 6 | 8 | 10 |
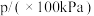 | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
 表示0~4min内平均反应速率为
表示0~4min内平均反应速率为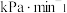 。
。②该温度下的压强平衡常数

(3)NO催化分解ICl制取
 和
和 的原理为:
的原理为:反应I:
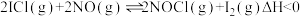 ;
;
反应Ⅱ:
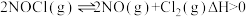 ;
; 。
。反应的
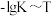 的关系如图所示。
的关系如图所示。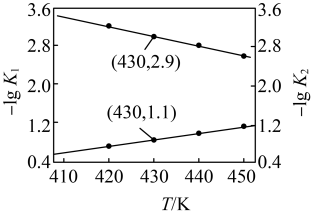
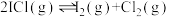 的
的
(4)催化电解NO吸收液可生成多种物质,其中将NO还原为
 的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
的催化机理如图甲所示。在相同条件下,恒定通过电解池的电量,电解得到部分还原产物的法拉第效率(FE%,法拉第效率之比等于转移电子的物质的量之比)随电解电压的变化如图乙所示。
 的电极反应式为
的电极反应式为②当电解电压为
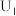 时,电解生成的
时,电解生成的 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】尿素[CO(NH2)2]合成的发展体现了化学科学与技术的不断进步。
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是___________ 。
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步(反应过程中能量变化如图1所示):
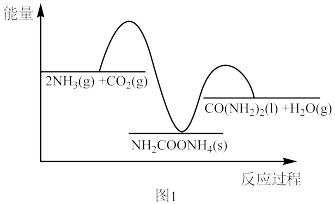
已知:Ⅰ.CO2和NH3生成NH2COONH4
Ⅱ.NH2COONH4分解生成尿素
①为防止反应Ⅰ中NH2COONH4分解为CO2和NH3,应采取的措施___________ 。
A.升温 B.降温 C.增大压强 D.减少压强
②密闭体系中除发生Ⅰ和Ⅱ外,尿素会发生水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵等副反应。尿素生产中实际投入NH3和CO2物质的量之比为4:1,其实际投料比值远大于理论值的原因是___________ 。
(3)尿素[CO(NH)2]溶液可吸收含SO2、NO烟气中SO2,其反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2,若吸收烟气时同时通入少量C1O2,可同时实现脱硫、脱硝。脱硝的反应分为两步。第一步:5NO+2ClO2+H2O=5NO2+2HCl;第二步:6NO2+4CO(NH2)2=7N2+4CO2+8H2O。将含SO2、NO烟气以一定的流速通过10%的CO(NH2)2溶液,其他条件相同,不通ClO2和通少量ClO2时SO2的去除率如图2所示。

①通少量ClO2时SO2的去除率较低的原因是___________ 。
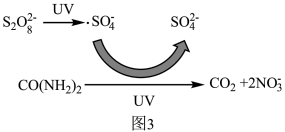
②处理后的废水含有尿素,可用过硫酸钠结合紫外线(UV)辐照去除废水中尿素,其过程机理如图3所示,尿素和过硫酸钠溶液发生的离子反应方程式为___________ 。
(4)电催化NO合成技术凭借其低能耗、绿色环保等优势成为化工行业关注的热点。某科研团队设计的Zn-NO电池装置及在不同电压下NH3的单位时间产量如图4所示,
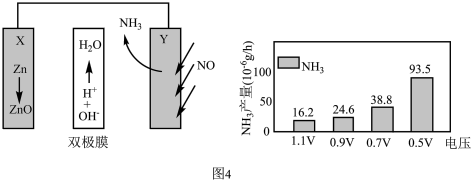
已知:a.双极膜中H2O电离出的H+和OH−在电场作用下可以向两极迁移;
b.法拉第效率= ×100%
×100%
①写出正极的电极反应式___________ 。
②0.7V电压下连续放电10小时,外电路通过1.8×10-4mole-,则法拉第效率为___________ 。(保留两位小数)
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步(反应过程中能量变化如图1所示):

已知:Ⅰ.CO2和NH3生成NH2COONH4
Ⅱ.NH2COONH4分解生成尿素
①为防止反应Ⅰ中NH2COONH4分解为CO2和NH3,应采取的措施
A.升温 B.降温 C.增大压强 D.减少压强
②密闭体系中除发生Ⅰ和Ⅱ外,尿素会发生水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵等副反应。尿素生产中实际投入NH3和CO2物质的量之比为4:1,其实际投料比值远大于理论值的原因是
(3)尿素[CO(NH)2]溶液可吸收含SO2、NO烟气中SO2,其反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2,若吸收烟气时同时通入少量C1O2,可同时实现脱硫、脱硝。脱硝的反应分为两步。第一步:5NO+2ClO2+H2O=5NO2+2HCl;第二步:6NO2+4CO(NH2)2=7N2+4CO2+8H2O。将含SO2、NO烟气以一定的流速通过10%的CO(NH2)2溶液,其他条件相同,不通ClO2和通少量ClO2时SO2的去除率如图2所示。

①通少量ClO2时SO2的去除率较低的原因是
②处理后的废水含有尿素,可用过硫酸钠结合紫外线(UV)辐照去除废水中尿素,其过程机理如图3所示,尿素和过硫酸钠溶液发生的离子反应方程式为

(4)电催化NO合成技术凭借其低能耗、绿色环保等优势成为化工行业关注的热点。某科研团队设计的Zn-NO电池装置及在不同电压下NH3的单位时间产量如图4所示,

已知:a.双极膜中H2O电离出的H+和OH−在电场作用下可以向两极迁移;
b.法拉第效率=
 ×100%
×100%①写出正极的电极反应式
②0.7V电压下连续放电10小时,外电路通过1.8×10-4mole-,则法拉第效率为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】肼(N2H4)是一种应用广泛的化工原料。工业上先合成氨气:N2(g)+3H2(g) 2NH3(g)+Q(Q>0),再进一步制备肼。完成下列填空:
2NH3(g)+Q(Q>0),再进一步制备肼。完成下列填空:

(1)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行试验,所得结果如图所示(其他条件相同),则生产中适宜选择的催化剂是___ (填“A”或“B”或“C”),理由是:________________ 。
(2)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“无法确定”)
(3)肼可作为火箭燃料,4gN2H4(g)在NO2气体中燃烧生成氮气和气态水,放出71kJ的热量。写出该反应的化学方程式:________ 。
(4)氨主要用于生产化肥和硝酸。“十三五”期间,预计我国合成氨产量将保持稳中略增。下图是不同温度和不同压强下,反应达到平衡后,混合物中NH3含量(体积%)的变化情况,已知初始时n(N2):n(H2)=1:3。判断pl、p2压强的大小关系,pl___ p2(选填“>”、“<”或“=”)。

 2NH3(g)+Q(Q>0),再进一步制备肼。完成下列填空:
2NH3(g)+Q(Q>0),再进一步制备肼。完成下列填空:
(1)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行试验,所得结果如图所示(其他条件相同),则生产中适宜选择的催化剂是
(2)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“无法确定”)
| 反应速率 | 平衡常数K | 氨的体积分数 | |
| 变化情况 |
(4)氨主要用于生产化肥和硝酸。“十三五”期间,预计我国合成氨产量将保持稳中略增。下图是不同温度和不同压强下,反应达到平衡后,混合物中NH3含量(体积%)的变化情况,已知初始时n(N2):n(H2)=1:3。判断pl、p2压强的大小关系,pl

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】(1)请按要求填空:用已准确称量的Na2CO3固体配制0.10mol/L Na2CO3溶液100mL,所需要的仪器除烧杯、量筒、玻璃棒和胶头滴管外,还需要的仪器为__________________ 。
(2)实验室可用下图装置(加热装置略)制取SO2以及验证SO2性质
①甲装置中制取SO2气体的化学方程式是___________________________________ 。
②为了证明SO2具有酸性,a处可放置_________ 试纸;装置乙中现象为溶液褪色,可证明SO2具有________ 性。
③ 丙装置的作用是_______________________________ 。
(2)实验室可用下图装置(加热装置略)制取SO2以及验证SO2性质
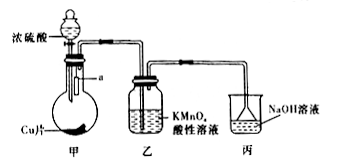
①甲装置中制取SO2气体的化学方程式是
②为了证明SO2具有酸性,a处可放置
③ 丙装置的作用是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。
②将除杂装置B补充完整并标明所用试剂___________ 。
③C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有___________ 。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
ⅰ、由方案Ⅰ中溶液变红可知a中含有___________ ,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由___________ 产生(用方程式表示)。
ⅱ、方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是___________ 。
②根据K2FeO4的制备实验得出:氧化性:Cl2___________ FeO (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
③资料表明,酸性溶液中的氧化性:FeO >MnO
>MnO ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性:FeO
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性:FeO >MnO
>MnO 。若能,请说明理由;若不能,进一步设计实验方案。
。若能,请说明理由;若不能,进一步设计实验方案。
理由或方案:___________ 。
(3)铁矿石中的铁元素通常以氧化物形式存在,可用通式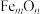 表示。为了确定某铁矿石中的
表示。为了确定某铁矿石中的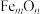 的组成,现进行如下实验:将少量该铁矿石样品粉碎,称取12.5g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌(假设只有Fe的氧化物溶解),过滤后,向所得滤液中加入5.0g铜粉,充分反应后过滤、洗涤、干燥得剩余固体1.8g,再将该过程所得滤液用浓度为1.0mol/L的酸性
的组成,现进行如下实验:将少量该铁矿石样品粉碎,称取12.5g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌(假设只有Fe的氧化物溶解),过滤后,向所得滤液中加入5.0g铜粉,充分反应后过滤、洗涤、干燥得剩余固体1.8g,再将该过程所得滤液用浓度为1.0mol/L的酸性 溶液滴定至终点,此时消耗酸性
溶液滴定至终点,此时消耗酸性 溶液的体积为25.0mL。
溶液的体积为25.0mL。
已知: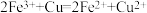 ,
,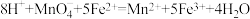 。
。
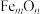 的化学式(m、n为正整数)为
的化学式(m、n为正整数)为___________ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。
②将除杂装置B补充完整并标明所用试剂
③C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
ⅱ、方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
②根据K2FeO4的制备实验得出:氧化性:Cl2
 (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO
(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是③资料表明,酸性溶液中的氧化性:FeO
 >MnO
>MnO ,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性:FeO
,验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色。该现象能否证明氧化性:FeO >MnO
>MnO 。若能,请说明理由;若不能,进一步设计实验方案。
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:
(3)铁矿石中的铁元素通常以氧化物形式存在,可用通式
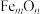 表示。为了确定某铁矿石中的
表示。为了确定某铁矿石中的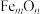 的组成,现进行如下实验:将少量该铁矿石样品粉碎,称取12.5g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌(假设只有Fe的氧化物溶解),过滤后,向所得滤液中加入5.0g铜粉,充分反应后过滤、洗涤、干燥得剩余固体1.8g,再将该过程所得滤液用浓度为1.0mol/L的酸性
的组成,现进行如下实验:将少量该铁矿石样品粉碎,称取12.5g样品于烧杯中,加入稀硫酸充分溶解,并不断加热、搅拌(假设只有Fe的氧化物溶解),过滤后,向所得滤液中加入5.0g铜粉,充分反应后过滤、洗涤、干燥得剩余固体1.8g,再将该过程所得滤液用浓度为1.0mol/L的酸性 溶液滴定至终点,此时消耗酸性
溶液滴定至终点,此时消耗酸性 溶液的体积为25.0mL。
溶液的体积为25.0mL。已知:
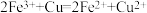 ,
,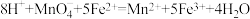 。
。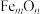 的化学式(m、n为正整数)为
的化学式(m、n为正整数)为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】I.由四种常见元素组成的化合物X,按如下流程进行实验。气体C能使带火星木条复燃,溶液B和溶液E的焰色反应为黄色,固体A和D组成元素相同。
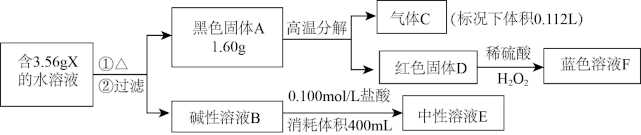
请回答:
(1)X 的化学式__________________ 。
(2)X可由蓝色溶液F与过量的浓的B溶液反应获得,写出该反应的离子方程式_____________ 。
(3)黑色固体A可在高温下与氨气作用生成红色固体D,同时生成一种单质,写出该反应的方程式________________________________________ 。
II.为测定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算。某同学设计的实验装置示意图如下:
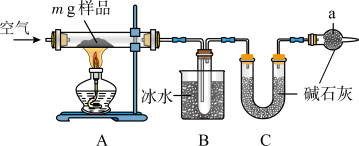
请回答:
(1)仪器a的作用是________________________________________ 。
(2)指出该同学设计的实验装置存在的缺陷__________________________________ 。
(3)设计实验方案说明样品中碳酸氢钠已经分解完全_________________________ 。

请回答:
(1)X 的化学式
(2)X可由蓝色溶液F与过量的浓的B溶液反应获得,写出该反应的离子方程式
(3)黑色固体A可在高温下与氨气作用生成红色固体D,同时生成一种单质,写出该反应的方程式
II.为测定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算。某同学设计的实验装置示意图如下:

请回答:
(1)仪器a的作用是
(2)指出该同学设计的实验装置存在的缺陷
(3)设计实验方案说明样品中碳酸氢钠已经分解完全
您最近一年使用:0次



