常温下,分别向MnCl2、ZnCl2、CH3COOH溶液中滴加NaOH溶液,溶液pX[pX=-lgc(X),X代表Mn2+、Zn2+、OH-,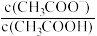 ]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
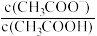 ]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是
]与pH关系如图所示。已知:Ksp[Mn(OH)2]>Ksp[Zn(OH)2]。下列叙述正确的是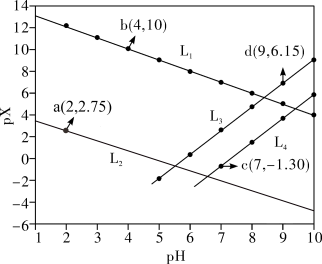
A.图中L2代表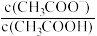 ,L3代表Mn2+ ,L3代表Mn2+ |
| B.室温下,Ksp[Zn(OH)2]的数量级为10-13 |
C.同时产生两种沉淀时,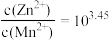 |
D.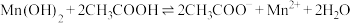 的平衡常数K=105.8 的平衡常数K=105.8 |
更新时间:2024-06-02 12:39:30
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】25 ℃时,相同体帜和pH的NaX、NaY、NaZ三种盐溶液,分别加水稀释,溶液pH的变化与所加水的体积关系如右图所示。下列说法正确的是
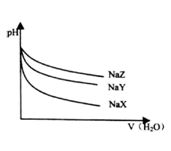

| A.在上述三种盐的原溶液中,水的电离度大小是NaX>NaY>NaZ |
| B.在等物质的量浓度的NaX、NaY、NaZ混合溶液中,离子浓度的大小关系是c(Z- )<c(Y- )<c(X- ) |
| C.在等物质的量浓度的NaX和NaY的混合液中存在c(HX)/c(X- )=c(HY)/c(Y -) |
D.浓度均为0. 1mol·L-1的NaX、NaY、NaZ的混合溶液中:c(OH- )=  +c(HX)+c(HY)+c(HZ) +c(HX)+c(HY)+c(HZ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】对 0.1 mol·L-1 醋酸溶液在25 ℃下的稀释过程,不正确的是
| A.醋酸的电离平衡常数不变 | B.溶液中c(H+)减小 |
| C.c(H+)/c(CH3COOH)增大 | D.醋酸溶液中所有离子的浓度均减少 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下述实验不能达到预期实验目的的是
| 序号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol/L AgNO3溶液的试管 中滴加0. 1 mol/LNaCl溶液,至不再有沉淀 生成,再向其中滴加0.1 mol/L Na2S溶液 | 证明AgCl能转化为溶解度更小的Ag2S |
| B | 向两份等量Mg(OH)2固体中分别加入等体 积蒸馏水和0.1 mol /L NH4Cl溶液 | 证明NH4Cl溶液能促进Mg(OH)2固体的溶解 |
| C | 向0.01 mol/ L稀醋酸中滴入甲基橙,加热 | 证明升高温度能促进醋酸电离 |
| D | 向淀粉溶液中加入稀硫酸,水浴加热一段时间后, 加入NaOH溶液调至碱性,再加入几滴碘水 | 验证淀粉是否完全水解 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可做钡餐,BaCO3不能作钡餐的主要理由是( )
| A.BaSO4的溶度积常数比BaCO3的小 |
B.SO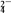 没有毒性,CO 没有毒性,CO 有毒性 有毒性 |
| C.BaSO4的密度大 |
D.胃酸能与CO 结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒 结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】溴酸银(AgBrO3)的溶解度随温度变化的曲线如图所示。下列说法错误的是
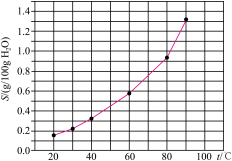

| A.溴酸银的溶解是吸热过程 |
| B.温度降低时溴酸银溶解速率加快 |
| C.60℃时溴酸银的Ksp约等于6×10-4 |
| D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】 时,难溶物
时,难溶物 和
和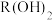 形成的饱和液中
形成的饱和液中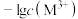 或
或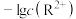 与
与 的变化关系如图所示。设难溶电解质的溶解度单位为
的变化关系如图所示。设难溶电解质的溶解度单位为 ,下列说法正确的是
,下列说法正确的是
 时,难溶物
时,难溶物 和
和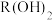 形成的饱和液中
形成的饱和液中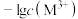 或
或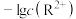 与
与 的变化关系如图所示。设难溶电解质的溶解度单位为
的变化关系如图所示。设难溶电解质的溶解度单位为 ,下列说法正确的是
,下列说法正确的是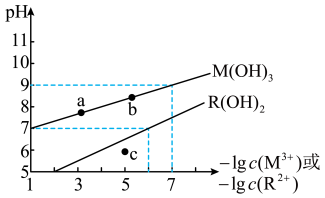
A. 时,c点时的 时,c点时的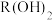 溶液为不饱和溶液 溶液为不饱和溶液 |
B.向 饱和溶液中加入盐酸可使a点变到b点 饱和溶液中加入盐酸可使a点变到b点 |
C. 时, 时, 的溶解度为 的溶解度为 |
D.浓度均为 的 的 和 和 ,调 ,调 ,当 ,当 开始沉淀时,尚未有 开始沉淀时,尚未有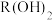 沉淀生成 沉淀生成 |
您最近一年使用:0次

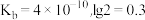 。下列说法错误的是
。下列说法错误的是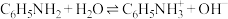

 )]、-1g[c(
)]、-1g[c( )]与-1g[c(Ba2+)]的关系如图所示。下列说法不正确的是
)]与-1g[c(Ba2+)]的关系如图所示。下列说法不正确的是
 )+c(H2CO3)
)+c(H2CO3)

