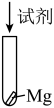
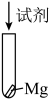
是一种重要的工业化学品。某研究小组利用如图所示装置制备
是一种重要的工业化学品。某研究小组利用如图所示装置制备 ,并进行相关探究。
,并进行相关探究。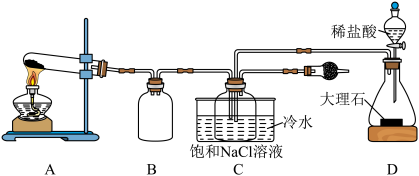
(1)装置A中发生反应的化学方程式为
(2)装置B的作用为
【查阅资料】Ⅰ.常温下镁和水反应现象不明显,镁和水反应会在镁条表面形成致密的
 膜,阻碍反应进一步发生;
膜,阻碍反应进一步发生;Ⅱ.镁与饱和
 溶液剧烈反应产生大量气体和白色沉淀;
溶液剧烈反应产生大量气体和白色沉淀;Ⅲ.
 质地紧密,
质地紧密, 质地疏松,该实验条件下,
质地疏松,该实验条件下, 对
对 膜没有作用。
膜没有作用。【预测】
 溶液中的某种组分破坏了
溶液中的某种组分破坏了 与
与 反应生成的
反应生成的 膜。
膜。【实验设计】用砂纸擦去镁条表面氧化膜,取表面积和质量相同的镁条(2cm)进行实验,测量产生气泡的速率。
| 实验序号 | 实验装置 | 添加试剂及用量 | 产生气泡速率(mL/min) |
| 1 |
|  |  |
| 2 | 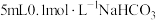 |  | |
| 3 | 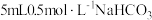 |  | |
| 4 | 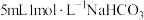 |  |
(3)测得实验结果
 ,得出结论:
,得出结论:(4)另一同学经查阅资料发现
 也能破坏
也能破坏 膜,于是进行如下探究:
膜,于是进行如下探究:| 实验序号 | 实验装置 | 添加试剂及用量 | 产生气泡速率(mL/min) |
| 5 |
| 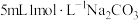 | 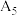 |
| 6 | 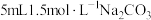 | 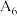 |
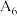
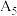 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(5)观察实验4和5发现
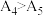 ,请解释其原因
,请解释其原因(6)加热
 可以得到纯碱,写出纯碱在生产或生活中的一种应用:
可以得到纯碱,写出纯碱在生产或生活中的一种应用:
更新时间:2024-05-22 14:44:42
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】知H2S是一种二元弱酸,回答以下问题:
(1)0.1mol/L NaHS溶液显碱性,则c(S2-)___________ c(H2S)(填“大于” ,“小于” 或“等于” ) 。
(2)常温下,向0.2 mol/L的H2S溶液中逐滴滴入0.2 mol/L NaOH溶液至中性,此时溶液中以下所示关系一定正确的是________ 。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)=c(HS-)+2c(S2-)
C.c(Na+) > c(HS-)+c(S2-)+c(H2S)
D.c(H2S) > c(S2-)
(3)已知常温下,CaS饱和溶液中存在平衡:CaS(s) Ca2+(aq)+S2-(aq) ΔH>0。
Ca2+(aq)+S2-(aq) ΔH>0。
①温度升高时,Ksp________ (填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)________ ,原因是______________________________________________ (用文字和离子方程式说明)。
(4)若向CaS悬浊液中加入Cu(NO3)2溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___________________________________________________________ 。
(1)0.1mol/L NaHS溶液显碱性,则c(S2-)
(2)常温下,向0.2 mol/L的H2S溶液中逐滴滴入0.2 mol/L NaOH溶液至中性,此时溶液中以下所示关系一定正确的是
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)=c(HS-)+2c(S2-)
C.c(Na+) > c(HS-)+c(S2-)+c(H2S)
D.c(H2S) > c(S2-)
(3)已知常温下,CaS饱和溶液中存在平衡:CaS(s)
 Ca2+(aq)+S2-(aq) ΔH>0。
Ca2+(aq)+S2-(aq) ΔH>0。①温度升高时,Ksp
②滴加少量浓盐酸,c(Ca2+)
(4)若向CaS悬浊液中加入Cu(NO3)2溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式
您最近一年使用:0次
【推荐2】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。请回答下列问题:

(1)下列说法正确的是_______。
(2)将沉淀用100 mL纯水和100 mL 0.01 mol·L-1的H2SO4分别洗涤,两种情况下损失的BaSO4的质量之比为_______ 。
(3)工业上用饱和碳酸钠溶液浸泡硫酸钡,将其转化为碳酸钡,发生反应的离子方程式为_______ 。

(1)下列说法正确的是_______。
| A.加入Na2SO4可以使溶液由a点变到b点 |
| B.通过蒸发可以使溶液由d点变到c点 |
| C.d点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
(3)工业上用饱和碳酸钠溶液浸泡硫酸钡,将其转化为碳酸钡,发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
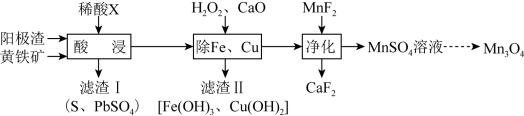
【推荐3】电解金属锰阳极渣(主要成分 ,杂质为Pb,Fe、Cu元素的化合物)和黄铁矿(
,杂质为Pb,Fe、Cu元素的化合物)和黄铁矿( )为原料可制备
)为原料可制备 ,其流程如图所示:
,其流程如图所示:
已知: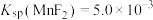 ,
, ,回答下列问题:
,回答下列问题:
(1)“酸浸”时,所用的稀酸X是___________ 。
(2)“除Fe、Cu”过程中加入 溶液时,发生反应的离子方程式为
溶液时,发生反应的离子方程式为___________ 。加入氧化钙的目的是除去铁和铜元素,用化学平衡移动原理解释除去铁元素的原理___________ 。
(3)“净化”过程反应的离子方程式为___________ ,若“净化”过程中 的浓度为2mol/L,则此时
的浓度为2mol/L,则此时 的浓度为
的浓度为___________ mol/L。
(4)“酸浸”过程中, 、
、 的质量浓度、Mn浸出率与时间的关系如图1所示。20~80min内,浸出Mn元素的主要离子方程式为
的质量浓度、Mn浸出率与时间的关系如图1所示。20~80min内,浸出Mn元素的主要离子方程式为___________ 。

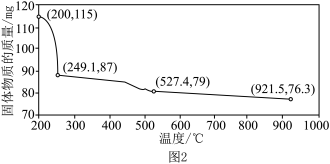
(5)碳酸锰在空气中加热可以生成相应的氧化物,称取115mg碳酸锰(摩尔质量115g/mol)加热,固体物质的质量随温度的变化如图2所示。527.4℃时, 生成相应固体物质的化学方程式为
生成相应固体物质的化学方程式为________ 。
 ,杂质为Pb,Fe、Cu元素的化合物)和黄铁矿(
,杂质为Pb,Fe、Cu元素的化合物)和黄铁矿( )为原料可制备
)为原料可制备 ,其流程如图所示:
,其流程如图所示:
已知:
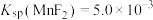 ,
, ,回答下列问题:
,回答下列问题:(1)“酸浸”时,所用的稀酸X是
(2)“除Fe、Cu”过程中加入
 溶液时,发生反应的离子方程式为
溶液时,发生反应的离子方程式为(3)“净化”过程反应的离子方程式为
 的浓度为2mol/L,则此时
的浓度为2mol/L,则此时 的浓度为
的浓度为(4)“酸浸”过程中,
 、
、 的质量浓度、Mn浸出率与时间的关系如图1所示。20~80min内,浸出Mn元素的主要离子方程式为
的质量浓度、Mn浸出率与时间的关系如图1所示。20~80min内,浸出Mn元素的主要离子方程式为
(5)碳酸锰在空气中加热可以生成相应的氧化物,称取115mg碳酸锰(摩尔质量115g/mol)加热,固体物质的质量随温度的变化如图2所示。527.4℃时,
 生成相应固体物质的化学方程式为
生成相应固体物质的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】实验室以工业钴渣为原料制取CoSO4溶液和ZnSO4·7H2O晶体,其实验流程如下:
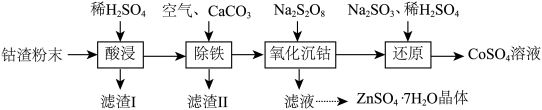
已知:①“酸浸”所得溶液中主要含CoSO4、ZnSO4,另含少量FeSO4、NiSO4。②金属活动性:Ni介于Fe、Cu之间。③下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度1 mol·L-1计算,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-):
(1)“酸浸”时所加稀硫酸不宜过量太多的原因是________ 。
(2)“除铁”时,向溶液中持续鼓入空气的作用是________ 。
(3)流程中需将滤渣Ⅰ、滤渣Ⅱ的洗涤液与“除铁”后所得滤液合并,目的是________ 。
(4)写出“还原”过程中Na2SO3、稀H2SO4与Co(OH)3反应的离子方程式:________ 。
(5)实验所得CoSO4溶液可用于制备CoCO3,制备时CoSO4饱和溶液与Na2CO3饱和溶液的混合方式为________ 。
(6)请结合如图硫酸锌晶体的溶解度曲线,设计从“氧化沉钴”后的滤液(含ZnSO4、Na2SO4、NiSO4等)中获取ZnSO4·7H2O的实验方案:取适量滤液,____________________________ ,过滤,用少量冰水洗涤,低温干燥得ZnSO4·7H2O晶体。(实验中须使用的试剂有:Zn粉、1.0 mol·L-1 NaOH、1.0 mol·L-1 H2SO4)


已知:①“酸浸”所得溶液中主要含CoSO4、ZnSO4,另含少量FeSO4、NiSO4。②金属活动性:Ni介于Fe、Cu之间。③下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度1 mol·L-1计算,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-):
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Co2+ | 7.6 | 9.4 |
| Zn2+ | 5.9 | 8.9 |
(2)“除铁”时,向溶液中持续鼓入空气的作用是
(3)流程中需将滤渣Ⅰ、滤渣Ⅱ的洗涤液与“除铁”后所得滤液合并,目的是
(4)写出“还原”过程中Na2SO3、稀H2SO4与Co(OH)3反应的离子方程式:
(5)实验所得CoSO4溶液可用于制备CoCO3,制备时CoSO4饱和溶液与Na2CO3饱和溶液的混合方式为
(6)请结合如图硫酸锌晶体的溶解度曲线,设计从“氧化沉钴”后的滤液(含ZnSO4、Na2SO4、NiSO4等)中获取ZnSO4·7H2O的实验方案:取适量滤液,

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】碘化亚铜(CuI)是一种白色固体,见光易分解变成棕黄色,不溶于水和乙醇,常用作有机反应催化剂、阳极射线管覆盖物、动物饲料添加剂等。某小组同学以冰铜(Cu2S 和FeS熔体)为原料制备无水CuI的流程如图。

(1)“调节pH”所用试剂为_______ ;若加入该试剂前溶液中阳离子浓度均为0.1mol/L,为使某阳离子完全沉淀为固体A,通过操作I与其它阳离子分离,理论上应调节溶液的pH在_______ 之间(常温下,Cu(OH)2、Fe(OH)3 的Ksp分别约为1×10-21和1×10 -38)。
(2)加入过量KI溶液时发生反应的离子方程式为_______ 。
(3)取CuI样品m g,加适量的FeCl3溶液恰好使其溶解,CuI 被完全氧化生成Cu2+和I2,待样品完全反应后,滴入几滴淀粉溶液,用c mol/L的Na2S2O3标准液滴定,达到终点时消耗标准液的体积平均值为VmL (已知:I2+ 2NaS2O3= Na2S4O6+ 2NaI )。
①达到滴定终点时的现象是_______
②样品中CuI的质量分数为_______ (用相关字母表示)。

(1)“调节pH”所用试剂为
(2)加入过量KI溶液时发生反应的离子方程式为
(3)取CuI样品m g,加适量的FeCl3溶液恰好使其溶解,CuI 被完全氧化生成Cu2+和I2,待样品完全反应后,滴入几滴淀粉溶液,用c mol/L的Na2S2O3标准液滴定,达到终点时消耗标准液的体积平均值为VmL (已知:I2+ 2NaS2O3= Na2S4O6+ 2NaI )。
①达到滴定终点时的现象是
②样品中CuI的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】叶蛇纹石是一种富镁硅酸盐矿物[主要成分为Mg6(Si4O10)(OH)8,还含有Al2O3、Fe2O3、FeO等杂质],利用该矿物生产铁红(Fe2O3)和碱式碳酸镁的工艺流程如图所示:
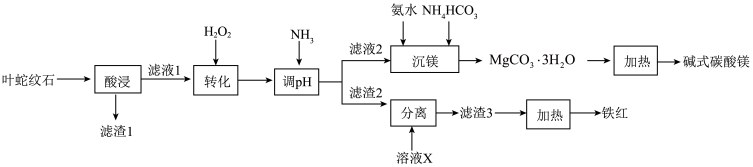
回答下列问题:
(1)“转化”步骤中,温度不能过高的原因是_______ 。“转化”时反应的离子方程式为_______ 。
(2)滤渣2的成分为_______ 。
(3)X通常选用_______ (填化学式)。
(4)“沉镁”步骤中氨水加入的量不能太多,否则MgCO3·H2O的产率会降低,其原因是_______ 。
(5)取9.1g碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O],高温分解后,测得生成3.3gCO2、4.0gMgO,化学式中z=_______ 写出由MgCO3·3H2O生成产品的化学方程式:_______ 。
(6)碱式碳酸镁常用作新型阻燃剂,试分析碱式碳酸镁能够阻燃的原因:_______ 。(写出两点即可)。

回答下列问题:
(1)“转化”步骤中,温度不能过高的原因是
(2)滤渣2的成分为
(3)X通常选用
(4)“沉镁”步骤中氨水加入的量不能太多,否则MgCO3·H2O的产率会降低,其原因是
(5)取9.1g碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O],高温分解后,测得生成3.3gCO2、4.0gMgO,化学式中z=
(6)碱式碳酸镁常用作新型阻燃剂,试分析碱式碳酸镁能够阻燃的原因:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】实验室采用三氟化硼( )与氯化铝(
)与氯化铝( )高温加热的方法制备
)高温加热的方法制备 ,装置如图所示(夹持装置及加热装置略)。
,装置如图所示(夹持装置及加热装置略)。

已知:
Ⅰ.三氟化硼( )易与水反应;三氯化硼(
)易与水反应;三氯化硼( )易潮解;三氯化铝(
)易潮解;三氯化铝( )沸点低、易升华。
)沸点低、易升华。
Ⅱ.部分物质的沸点如表所示:
回答下列问题:
(1)将氟硼酸钾(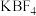 )和硼酐(
)和硼酐( )一起研磨均匀加入A中的圆底烧瓶,滴入浓硫酸并加热,除产生气体外,还生成一种酸式盐,则发生反应的化学方程式为
)一起研磨均匀加入A中的圆底烧瓶,滴入浓硫酸并加热,除产生气体外,还生成一种酸式盐,则发生反应的化学方程式为___________ 。
(2)实验开始时,A、C两处加热装置应先加热A处,原因是___________ 。
(3)装置B中浓硫酸的作用除干燥外,还有___________ 。
(4)装置C中仪器是将规格为1L的圆底烧瓶与500mL的蒸馏烧瓶的底部熔接在一起,再将玻璃管插到圆底烧瓶的底部,这样做的目的为___________ 。
(5)装置D进行___________ (填“冰水浴”或“热水浴”)可得到产品,如果缺少装置E,造成的影响为___________ 。
(6)C中2.67g无水氯化铝完全反应后,取下U形管并注入水,完全反应生成盐酸和硼酸( ,一元弱酸),将所得溶液加水稀释到100mL,取20mL加入锥形瓶中,滴入2滴酚酞溶液,用
,一元弱酸),将所得溶液加水稀释到100mL,取20mL加入锥形瓶中,滴入2滴酚酞溶液,用 的NaOH溶液滴定至终点,重复实验2~3次,消耗NaOH的平均体积为12.50mL,则
的NaOH溶液滴定至终点,重复实验2~3次,消耗NaOH的平均体积为12.50mL,则 的产率为
的产率为___________ %(保留2位小数)。
 )与氯化铝(
)与氯化铝( )高温加热的方法制备
)高温加热的方法制备 ,装置如图所示(夹持装置及加热装置略)。
,装置如图所示(夹持装置及加热装置略)。
已知:
Ⅰ.三氟化硼(
 )易与水反应;三氯化硼(
)易与水反应;三氯化硼( )易潮解;三氯化铝(
)易潮解;三氯化铝( )沸点低、易升华。
)沸点低、易升华。Ⅱ.部分物质的沸点如表所示:
| 物质 |  |  |  |
| 沸点/℃ |  |  |  |
(1)将氟硼酸钾(
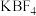 )和硼酐(
)和硼酐( )一起研磨均匀加入A中的圆底烧瓶,滴入浓硫酸并加热,除产生气体外,还生成一种酸式盐,则发生反应的化学方程式为
)一起研磨均匀加入A中的圆底烧瓶,滴入浓硫酸并加热,除产生气体外,还生成一种酸式盐,则发生反应的化学方程式为(2)实验开始时,A、C两处加热装置应先加热A处,原因是
(3)装置B中浓硫酸的作用除干燥外,还有
(4)装置C中仪器是将规格为1L的圆底烧瓶与500mL的蒸馏烧瓶的底部熔接在一起,再将玻璃管插到圆底烧瓶的底部,这样做的目的为
(5)装置D进行
(6)C中2.67g无水氯化铝完全反应后,取下U形管并注入水,完全反应生成盐酸和硼酸(
 ,一元弱酸),将所得溶液加水稀释到100mL,取20mL加入锥形瓶中,滴入2滴酚酞溶液,用
,一元弱酸),将所得溶液加水稀释到100mL,取20mL加入锥形瓶中,滴入2滴酚酞溶液,用 的NaOH溶液滴定至终点,重复实验2~3次,消耗NaOH的平均体积为12.50mL,则
的NaOH溶液滴定至终点,重复实验2~3次,消耗NaOH的平均体积为12.50mL,则 的产率为
的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的两位同学为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
Ⅰ.现需配制1mol/LNaOH溶液450mL,如图是某同学转移溶液的示意图,根据如图所示,

回答下列问题:
(1)①仪器c使用前必须___________ 。
②图中的错误是___________ 。
(2)根据计算得知,需用托盘天平称出NaOH的质量为___________ g。
(3)下列操作使配制的NaOH溶液浓度偏低的有___________。
Ⅱ.实验探究。
探究一:实验方案:铝镁合金 测定剩余固体质量。
测定剩余固体质量。
实验步骤:
(4)称取5.4 g铝镁合金粉末样品,投入体积为V、浓度为1.0 mol·L-1的NaOH溶液中,充分反应。为保证合金充分反应,NaOH溶液的体积V≥___________ 。
探究二:实验方案:铝镁合金 测定生成气体的体积(实验装置如图所示)。
测定生成气体的体积(实验装置如图所示)。

(5)某同学提出该实验装置不够完善,应在A、B之间添加一个除酸雾的装置。你的意见___________ (填“需要”或“不需要”)。
(6)为使测定结果尽可能精确,实验中应注意的问题:___________ 。
Ⅰ.现需配制1mol/LNaOH溶液450mL,如图是某同学转移溶液的示意图,根据如图所示,

回答下列问题:
(1)①仪器c使用前必须
②图中的错误是
(2)根据计算得知,需用托盘天平称出NaOH的质量为
(3)下列操作使配制的NaOH溶液浓度偏低的有___________。
| A.未冷却到室温就转移到容量瓶立即定容 |
| B.选用的容量瓶内有少量蒸馏水 |
| C.定容摇匀后,液面下降,又加水至刻度线 |
| D.定容时俯视刻度线 |
Ⅱ.实验探究。
探究一:实验方案:铝镁合金
 测定剩余固体质量。
测定剩余固体质量。实验步骤:
(4)称取5.4 g铝镁合金粉末样品,投入体积为V、浓度为1.0 mol·L-1的NaOH溶液中,充分反应。为保证合金充分反应,NaOH溶液的体积V≥
探究二:实验方案:铝镁合金
 测定生成气体的体积(实验装置如图所示)。
测定生成气体的体积(实验装置如图所示)。
(5)某同学提出该实验装置不够完善,应在A、B之间添加一个除酸雾的装置。你的意见
(6)为使测定结果尽可能精确,实验中应注意的问题:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某实验小组同学对影响CuSO4溶液和浓氨水反应产物的因素进行了如下探究。
【查阅资料】
①Cu(OH)2(s) Cu2+ + 2OH— Ksp = 2.2×10-20;
Cu2+ + 2OH— Ksp = 2.2×10-20;
 Cu2+ + 4NH3 K = 4.8×10-14。
Cu2+ + 4NH3 K = 4.8×10-14。
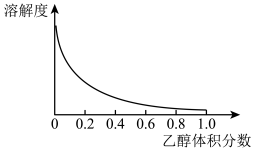
②Cu(NH3)4SO4·H2O是一种易溶于水、难溶于乙醇的深蓝色固体,加热分解有氨气放出。Cu(NH3)4SO4·H2O在乙醇-水混合溶剂中的溶解度如下图所示。
【实验 1】CuSO4溶液和浓氨水的反应。
(1)进一步实验证明,深蓝色溶液A、B中均含有 ,相应的实验方案为
,相应的实验方案为___________________________ (写出实验操作及现象)。
【实验 2】探究影响 CuSO4溶液和浓氨水反应产物的因素。
(2)依据实验 2-1,甲同学认为 Cu2+浓度是影响 CuSO4溶液和浓氨水反应产物的因素之一。乙同学认为实验 2-1 没有排除硫酸铜溶液呈酸性的干扰,并设计了如下对比实验:
①用化学用语表示硫酸铜溶液呈酸性的原因:___________________________ 。
②试剂a为___________________________ 。
(3)利用平衡移动原理对实验2-2的现象进行解释:_______________ 。
(4)实验2-3的目的是___________________ 。
(5)综合上述实验可以推测, 影响 CuSO4 溶液和浓氨水反应产物的因素有______________ 。
【查阅资料】
①Cu(OH)2(s)
 Cu2+ + 2OH— Ksp = 2.2×10-20;
Cu2+ + 2OH— Ksp = 2.2×10-20;
 Cu2+ + 4NH3 K = 4.8×10-14。
Cu2+ + 4NH3 K = 4.8×10-14。②Cu(NH3)4SO4·H2O是一种易溶于水、难溶于乙醇的深蓝色固体,加热分解有氨气放出。Cu(NH3)4SO4·H2O在乙醇-水混合溶剂中的溶解度如下图所示。

【实验 1】CuSO4溶液和浓氨水的反应。
| 序号 | 实验内容 | 实验现象 |
| 1-1 | 向2 mL 0.1 mol/L CuSO4(pH=3.2)中逐滴加入2 mL 1 mol/L氨水 | 立即出现浅蓝色沉淀,溶液变无色;随后沉淀逐渐溶解,溶液变为蓝色;最终得到澄清透明的深蓝色溶液A |
| 1-2 | 向 2 mL 1 mol/L氨水中逐滴加入 2mL 0.1 mol/L CuSO4(pH=3.2) | 始终为澄清透明的深蓝色溶液B |
 ,相应的实验方案为
,相应的实验方案为【实验 2】探究影响 CuSO4溶液和浓氨水反应产物的因素。
| 序号 | 实验内容 | 实验现象 |
| 2-1 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,溶液颜色变浅 |
| 2-2 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 1 mol/L NaOH | 有浅蓝色沉淀生成,上层清液接近无色 |
| 2-3 | 向 2 mL 0.1 mol/L 氨水中逐滴加入2 mL 0.1 mol/L CuSO4(pH=3.2) | 有浅蓝色沉淀生成,上层清液接近无色 |
| 序号 | 实验内容 | 实验现象 |
| 2-4 | 向实验 1-2 所得深蓝色溶液 B 中继续加入 2 mL 试剂 a | 无明显现象 |
②试剂a为
(3)利用平衡移动原理对实验2-2的现象进行解释:
(4)实验2-3的目的是
(5)综合上述实验可以推测, 影响 CuSO4 溶液和浓氨水反应产物的因素有
您最近一年使用:0次