下列根据实验方案设计及现象得出结论错误的是
| 选项 | 实验设计及现象 | 结论 |
| A | 往碘的 溶液中加入等体积浓KI溶液,振荡。溶液分层,下层紫红色变浅粉红色,上层呈棕黄色 溶液中加入等体积浓KI溶液,振荡。溶液分层,下层紫红色变浅粉红色,上层呈棕黄色 | 碘在浓KI溶液中溶解能力大于在 中溶解能力 中溶解能力 |
| B | 有机物A加入NaOH乙醇溶液中,充分加热:冷却后,取混合液加足量硝酸酸化,滴加硝酸银溶液,未产生白色沉淀 | 有机物A不可能是氯代烃 |
| C | 向 溶液中,先加NaOH溶液调节 溶液中,先加NaOH溶液调节 ,有红褐色沉淀生成,再加入足量的KSCN溶液,沉淀不溶解 ,有红褐色沉淀生成,再加入足量的KSCN溶液,沉淀不溶解 | 在 时, 时, 结合 结合 的能力比 的能力比 强 强 |
| D | 常温下,用pH计分别测定浓度均为 的KCl溶液和 的KCl溶液和 溶液的pH,测得pH均为7.0 溶液的pH,测得pH均为7.0 | 但两溶液中水的电离程度不相同 |
| A.A | B.B | C.C | D.D |
更新时间:2024-05-22 17:58:43
|
相似题推荐
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下,PbCO3和 PbI2在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc(CO32-)或-lgc(I-)的关系如图所示。下列说法错误的是


| A.Ksp(PbCO3)的数量级为 10-14 |
| B.相同条件下,水的电离程度 p 点大于 q 点 |
| C.L1对应的是-lgc(Pb2+)与-lgc(I-)的关系变化 |
| D.p 点溶液中加入 Na2CO3浓溶液,可得白色沉淀 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】常温下,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
| 化学式 | HCOOH | H2CO3 | HCN |
| 电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
| A.酸性强弱顺序是:HCOOH > HCN > H2CO3 |
| B.物质的量浓度均为0.1 mol·L-1的HCOONa溶液和NaCN溶液,pH大小顺序:HCOONa > NaCN |
| C.常温下,物质的量浓度为0.1mol/L的HCN溶液中c(OH-)浓度约为1.4×10-8mol/L |
D.H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3 +CN-=HCN + HCO |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】室温下,通过下列实验探究Na2CO3的性质。已知:25℃时,H2SO3的Ka1=1.4×10-2、Ka2=1.0×10-7,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。
实验1:配制50mL0.1mol·L-1Na2CO3溶液,测得溶液pH约为12;
实验2:取10mL0.1mol·L-1Na2CO3溶液,向其中加入一定量CaSO4固体充分搅拌,一段时间后过滤,向滤渣中加入足量稀盐酸,固体部分溶解;
实验3:取10mL0.1mol·L-1Na2CO3溶液,向其中缓慢滴入等体积0.1mol·L-1稀盐酸。
下列说法正确的是
实验1:配制50mL0.1mol·L-1Na2CO3溶液,测得溶液pH约为12;
实验2:取10mL0.1mol·L-1Na2CO3溶液,向其中加入一定量CaSO4固体充分搅拌,一段时间后过滤,向滤渣中加入足量稀盐酸,固体部分溶解;
实验3:取10mL0.1mol·L-1Na2CO3溶液,向其中缓慢滴入等体积0.1mol·L-1稀盐酸。
下列说法正确的是
A.实验1所得溶液中,c(Na+)<c(CO )+c(HCO )+c(HCO ) ) |
B.实验2,加入稀盐酸后的上层清液中c(Ca2+)=c(SO ) ) |
C.实验3反应后溶液中存在:c(Na+)=c(CO )+c(HCO )+c(HCO )+c(H2CO3) )+c(H2CO3) |
D.25℃时,反应CO +H2SO3⇌HCO +H2SO3⇌HCO +HSO +HSO 的平衡常数K=2.5×108 的平衡常数K=2.5×108 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列实验操作能达到其对应目的的是
| 实验目的 | 操作 | |
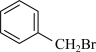
| A | 欲证明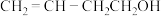 中含有碳碳双键 中含有碳碳双键 | 取该物质适量于试管,滴入酸性 溶液 溶液 |
| B | 欲除去苯中混有的苯酚 | 向混合液中加入浓溴水,充分反应后,生成三溴苯酚白色沉淀,过滤 |
| C | 欲检验乙醇的消去反应产物 | 将乙醇与浓硫酸混合,迅速加热到170℃(务必迅速加热到170℃,140℃会有乙醚生成),将气体产物通过导气管直接通入酸性高锰酸钾 |
| D | 欲证明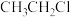 中含有氯原子 中含有氯原子 | 取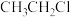 在碱性条件下的水解液适量于试管,加足量硝酸酸化,再加入 在碱性条件下的水解液适量于试管,加足量硝酸酸化,再加入 溶液 溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】下列实验方案中,可以达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入酸性高锰酸钾溶液中 |
| B | 除去苯中混有的苯酚 | 加入适量的溴水充分反应后过滤弃去沉淀 |
| C | 除去NaCl晶体中少量的KNO3杂质 | 先将晶体溶于水配成溶液,然后蒸发结晶并趁热过滤弃去滤液 |
| D | 检验CH3CH2Br中存在的溴元素 | 将CH3CH2Br与NaOH溶液共热,冷却后,取出上层水溶液,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列实验目的可以实现或操作正确的是 ( )
| A.用托盘天平称取3.23g NaCl固体 |
| B.用10mL量筒量取7.50mL稀盐酸 |
| C.分液以后下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
| D.稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水里,并不断搅拌 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】下列有关除杂质(括号中为杂质)的操作中,错误的是
| A.福尔马林(甲酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 |
| B.溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
| C.乙醇(水):加入新制生石灰,蒸馏 |
| D.乙酸(乙醇):加入金属钠,蒸馏 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】Na2SO3易被空气中的氧气氧化生成Na2SO4而变质,现有Na2SO3样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是( )
| A.将样品与足量稀硫酸充分反应,生成的全部气体依次全部通过盛有饱和NaHSO3溶液的洗气瓶、盛有浓硫酸的洗气瓶、盛有碱石灰的干燥管Ⅰ、盛有碱石灰的干燥管Ⅱ,测得干燥管Ⅰ增重b g |
| B.将样品与足量稀硫酸充分反应后,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称重为d g |
| C.向样品中加入足量H2O2溶液,再加入足量BaCl2溶液,过滤,将沉淀洗涤、干燥,称重为c g |
| D.将样品配制成溶液V1 L,取其中25.00 mL用标准酸性KMnO4溶液滴定,消耗标准酸性KMnO4溶液V2 mL |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列在科学研究过程中使用的实验装置内,没有 发生氧化还原反应的是
 | 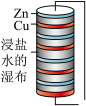 | 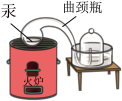 |  |
| A.屠呦呦用乙醚提取青蒿素 | B.伏打发明电池 | C.拉瓦锡研究空气成分 | D.李比希用CuO做氧化剂分析有机物的组成 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】下列实验过程、实验目的、判定及解释都正确的是
| 编号 | 实验目的 | 实验过程 | 判定、解释 |
| A | 配制0.4000mol·L-1的NaOH溶液 | 称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,直接转移至250mL容量瓶中定容 | 正确,4.0g固体NaOH的物质的量为0.1mol,定容到250mL的容量瓶,物质的量浓度恰好为0.4000mol·L-1 |
| B | 探究维生素C的还原性 | 向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 | 正确,FeCl3具有氧化性,能与具有还原性的维生素C发生反应,使溶液的颜色由黄色变为浅绿色(Fe2+) |
| C | 制取并纯化 氢气 | 向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液 | 正确,产生的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液,除去可能的酸性气体、水蒸气和还原性气体等杂质,得到纯净氢气 |
| D | 探究浓度对反应速率的影响 | 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL 5%H2O2溶液,观察实验现象 | 错误,反应的离子方程式为 H2O2+NaHSO3=Na++H++SO42-+H2O 没有明显的实验现象,因此不能用此反应探究浓度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次