清洁能源的综合利用有效降低碳排放,是实现“碳中和碳达峰”的重要途径。
(1)以环己烷为原料生产苯,同时得氢气。下图是该反应过程中几种物质间的能量关系。
 ,利用该反应可减少
,利用该反应可减少 排放,合成清洁能源。
排放,合成清洁能源。
①下列能说明反应达到平衡状态的是_______ (填字母)。
A.单位时间内生成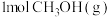 的同时消耗了
的同时消耗了
B.在绝热恒容的容器中,反应的平衡常数不再变化
C.容器内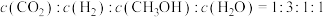
D.在恒温恒压的容器中,混合气体的密度不再变化
②一定条件下,在一密闭容器中充入 和
和 发生反应,下图表示压强为
发生反应,下图表示压强为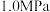 和
和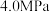 下
下 的平衡转化率随温度的变化关系。
的平衡转化率随温度的变化关系。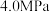 下
下 的平衡转化率随温度的变化曲线为
的平衡转化率随温度的变化曲线为_______ (填“Ⅰ”或“Ⅱ”),a点对应的平衡常数
_______  。(列出计算式即可,
。(列出计算式即可, 为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)
为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)
③利用制备的甲醇可以催化制取丙烯,过程中发生如下反应: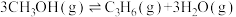 ,为探究M、N两种催化剂的催化效能,进行相关实验,依据实验数据获得如图所示曲线。
,为探究M、N两种催化剂的催化效能,进行相关实验,依据实验数据获得如图所示曲线。 (
( 为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数)。在M催化剂作用下,该反应的活化能
为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数)。在M催化剂作用下,该反应的活化能
_______  ,从图中信息获知催化效能较低的催化剂是
,从图中信息获知催化效能较低的催化剂是_______ (“M”或“N”),判断理由是_______ 。
(1)以环己烷为原料生产苯,同时得氢气。下图是该反应过程中几种物质间的能量关系。
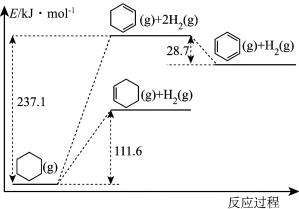
反应: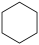
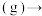
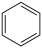
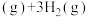

 。
。

 ,利用该反应可减少
,利用该反应可减少 排放,合成清洁能源。
排放,合成清洁能源。①下列能说明反应达到平衡状态的是
A.单位时间内生成
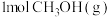 的同时消耗了
的同时消耗了
B.在绝热恒容的容器中,反应的平衡常数不再变化
C.容器内
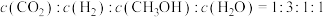
D.在恒温恒压的容器中,混合气体的密度不再变化
②一定条件下,在一密闭容器中充入
 和
和 发生反应,下图表示压强为
发生反应,下图表示压强为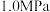 和
和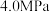 下
下 的平衡转化率随温度的变化关系。
的平衡转化率随温度的变化关系。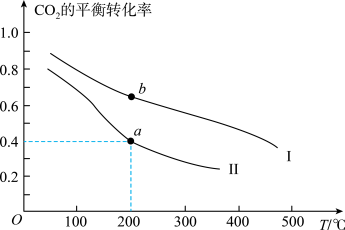
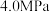 下
下 的平衡转化率随温度的变化曲线为
的平衡转化率随温度的变化曲线为
 。(列出计算式即可,
。(列出计算式即可, 为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)
为以平衡分压代替平衡浓度表示的平衡常数,分压=总压×物质的量分数)③利用制备的甲醇可以催化制取丙烯,过程中发生如下反应:
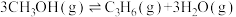 ,为探究M、N两种催化剂的催化效能,进行相关实验,依据实验数据获得如图所示曲线。
,为探究M、N两种催化剂的催化效能,进行相关实验,依据实验数据获得如图所示曲线。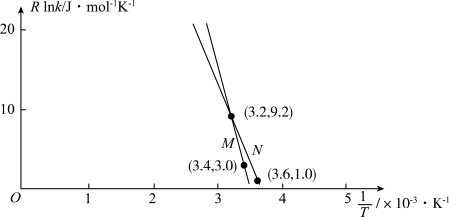
 (
( 为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数)。在M催化剂作用下,该反应的活化能
为活化能,假设受温度影响忽略不计,k为速率常数,R和C为常数)。在M催化剂作用下,该反应的活化能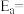
 ,从图中信息获知催化效能较低的催化剂是
,从图中信息获知催化效能较低的催化剂是
更新时间:2024-05-24 10:25:36
|
相似题推荐
【推荐1】氮及其化合物在科研及生产中均有重要的应用。
(1) 转化为
转化为 是工业制取硝酸的重要一步,一定条件下,
是工业制取硝酸的重要一步,一定条件下, 与
与 发生催化氧化反应时,可发生不同反应:
发生催化氧化反应时,可发生不同反应:
反应Ⅰ: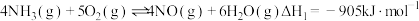
反应Ⅱ: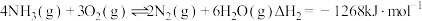
①该条件下, 与
与 反应生成
反应生成 的热化学方程式为
的热化学方程式为_______ .
②一定条件下的密闭容器中发生反应Ⅰ,平衡时混合物中 的物质的量分数在不同温度(
的物质的量分数在不同温度( 、
、 、
、 )随压强的变化如图所示。
)随压强的变化如图所示。
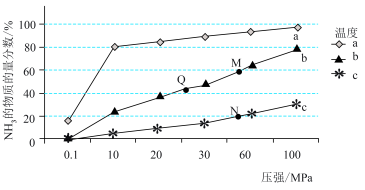
则曲线 对应的温度是
对应的温度是_______ ,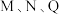 点平衡常数
点平衡常数 的大小关系是
的大小关系是_______ 。
(2)已知: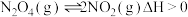 ,将
,将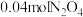 气体充入
气体充入 的恒容密闭容器中,控制反应温度为
的恒容密闭容器中,控制反应温度为 ,
, 随
随 (时间)变化曲线如图。
(时间)变化曲线如图。

①下列各项中能说明该反应已达到化学平衡状态的是_______ 。
A.容器内压强不变 B.
C.混合气体的颜色不变 D.混合气体的密度不变
② 时刻反应达到平衡,若
时刻反应达到平衡,若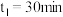 ,计算
,计算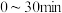 内的平均反应速率
内的平均反应速率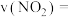
_______ ,此时 的转化率为
的转化率为_______ 。
③反应温度 时,画出
时,画出 时段,
时段, 随
随 变化曲线。保持其他条件不变,改变反应温度为
变化曲线。保持其他条件不变,改变反应温度为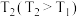 ,再次画出
,再次画出 时段,
时段, 随
随 变化趋势的曲线
变化趋势的曲线____ 。(在答题卡方框中完成 )
(1)
 转化为
转化为 是工业制取硝酸的重要一步,一定条件下,
是工业制取硝酸的重要一步,一定条件下, 与
与 发生催化氧化反应时,可发生不同反应:
发生催化氧化反应时,可发生不同反应:反应Ⅰ:
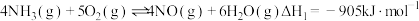
反应Ⅱ:
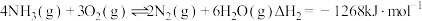
①该条件下,
 与
与 反应生成
反应生成 的热化学方程式为
的热化学方程式为②一定条件下的密闭容器中发生反应Ⅰ,平衡时混合物中
 的物质的量分数在不同温度(
的物质的量分数在不同温度( 、
、 、
、 )随压强的变化如图所示。
)随压强的变化如图所示。
则曲线
 对应的温度是
对应的温度是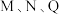 点平衡常数
点平衡常数 的大小关系是
的大小关系是(2)已知:
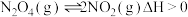 ,将
,将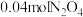 气体充入
气体充入 的恒容密闭容器中,控制反应温度为
的恒容密闭容器中,控制反应温度为 ,
, 随
随 (时间)变化曲线如图。
(时间)变化曲线如图。
①下列各项中能说明该反应已达到化学平衡状态的是
A.容器内压强不变 B.

C.混合气体的颜色不变 D.混合气体的密度不变
②
 时刻反应达到平衡,若
时刻反应达到平衡,若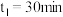 ,计算
,计算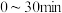 内的平均反应速率
内的平均反应速率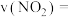
 的转化率为
的转化率为③反应温度
 时,画出
时,画出 时段,
时段, 随
随 变化曲线。保持其他条件不变,改变反应温度为
变化曲线。保持其他条件不变,改变反应温度为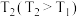 ,再次画出
,再次画出 时段,
时段, 随
随 变化趋势的曲线
变化趋势的曲线
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
请回答下列问题:
①该反应的平衡常数表达式K=__________ ,ΔH_______ 0(填“>”、“<”或“=”)。
②欲提高反应中CO的平衡转化率,可采取的措施是_____________________ 。
A.减少Fe的量 B.加入合适的催化剂
C.增大容器的体积 D.降低反应的温度
③在一个容积为1 L的密闭容器中,1000 ℃时加入Fe2O3、CO各2 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO)=______________ ,Fe2O3的平衡转化率为________ 。
(2)饱和Mg(OH)2溶液中滴加FeCl3溶液,产生红褐色沉淀, 反应的离子方程式是________________________________________ 。
(3)已知:2Fe(s)+3/2O2(g)=Fe2O3(s) △H=−824 kJ·mol-1、2Al(s)+3/2O2(g)=Al2O3(s) △H=−1675.7 kJ·mol-1。则铝与Fe2O3发生反应生成Al2O3和Fe的热化学方程式为 :___________________________ 。
(1)在一定温度下,氧化铁可以与一氧化碳发生反应:Fe2O3(s)+3CO(g)
 2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:
2Fe(s)+3CO2(g)。已知该反应在不同温度下的平衡常数如下表:| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
①该反应的平衡常数表达式K=
②欲提高反应中CO的平衡转化率,可采取的措施是
A.减少Fe的量 B.加入合适的催化剂
C.增大容器的体积 D.降低反应的温度
③在一个容积为1 L的密闭容器中,1000 ℃时加入Fe2O3、CO各2 mol,反应经过10 min后达到平衡。求该时间范围内反应的平均反应速率v(CO)=
(2)饱和Mg(OH)2溶液中滴加FeCl3溶液,产生红褐色沉淀, 反应的离子方程式是
(3)已知:2Fe(s)+3/2O2(g)=Fe2O3(s) △H=−824 kJ·mol-1、2Al(s)+3/2O2(g)=Al2O3(s) △H=−1675.7 kJ·mol-1。则铝与Fe2O3发生反应生成Al2O3和Fe的热化学方程式为 :
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】随着人类社会的发展,氮氧化物的排放导致一系列环境问题。
(1)NO加速臭氧层被破坏,其反应过程如图所示:

反应O3(g)+O(g)=2O2(g) ∆H=−143kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ∆H1=−200.2kJ/mol
反应2:热化学方程式为___________ 。
(2)①汽车发动机工作时会引发反应N2(g)+O2(g) 2NO(g)。2000K时,向固定容积的密闭容器中充入等物质的量的N2和O2发生上述反应,下列能说明反应已达到平衡状态的是
2NO(g)。2000K时,向固定容积的密闭容器中充入等物质的量的N2和O2发生上述反应,下列能说明反应已达到平衡状态的是___________ 。
A.混合气体的密度保持不变 B.v正(NO)=2v逆(N2)
C.混合气体的平均相对分子质量不变 D.O2的浓度不再发生变化
反应过程各组分体积分数(φ)的变化如图1所示,N2的平衡转化率为___________ 。

②在密闭、固定容积的容器中,一定量NO发生分解的过程中,NO的转化率随时间变化关系如图2所示。反应2NO(g) N2(g)+O2(g) ∆H
N2(g)+O2(g) ∆H___________ 0(填“>”或“<”)。

(3)电解NO制备NH4NO3,是处理氮氧化物的排放的方法之一,发生反应8NO+7H2O 3NH4NO3+2HNO3,其工作原理如图所示:阴极的电极反应式为:
3NH4NO3+2HNO3,其工作原理如图所示:阴极的电极反应式为:___________ 。

(1)NO加速臭氧层被破坏,其反应过程如图所示:

反应O3(g)+O(g)=2O2(g) ∆H=−143kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ∆H1=−200.2kJ/mol
反应2:热化学方程式为
(2)①汽车发动机工作时会引发反应N2(g)+O2(g)
 2NO(g)。2000K时,向固定容积的密闭容器中充入等物质的量的N2和O2发生上述反应,下列能说明反应已达到平衡状态的是
2NO(g)。2000K时,向固定容积的密闭容器中充入等物质的量的N2和O2发生上述反应,下列能说明反应已达到平衡状态的是A.混合气体的密度保持不变 B.v正(NO)=2v逆(N2)
C.混合气体的平均相对分子质量不变 D.O2的浓度不再发生变化
反应过程各组分体积分数(φ)的变化如图1所示,N2的平衡转化率为

②在密闭、固定容积的容器中,一定量NO发生分解的过程中,NO的转化率随时间变化关系如图2所示。反应2NO(g)
 N2(g)+O2(g) ∆H
N2(g)+O2(g) ∆H
(3)电解NO制备NH4NO3,是处理氮氧化物的排放的方法之一,发生反应8NO+7H2O
 3NH4NO3+2HNO3,其工作原理如图所示:阴极的电极反应式为:
3NH4NO3+2HNO3,其工作原理如图所示:阴极的电极反应式为:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】Ⅰ.实现“碳中和”,综合利用 具有重要的意义。一定条件下,
具有重要的意义。一定条件下, 与
与 制备气态甲醇的反应方程式为
制备气态甲醇的反应方程式为 。
。
(1)在容积为 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和 ,测得
,测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。
①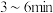 内,
内,
___________ 。
②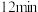 末时,混合气体中
末时,混合气体中 的物质的量分数为
的物质的量分数为___________ 。
③第 时
时
___________ 第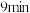 时
时 (填“>”、“<”或“=”),第
(填“>”、“<”或“=”),第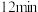 时,
时,
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(2)保持压强为 ,向密闭容器中投入一定量
,向密闭容器中投入一定量 和
和 发生上述反应,若投料比m[
发生上述反应,若投料比m[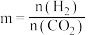 ]=1,一定温度下发生上述反应,下列说法不能作为反应是否达到平衡的判断依据的是
]=1,一定温度下发生上述反应,下列说法不能作为反应是否达到平衡的判断依据的是___________ (填标号)。
a.容器内气体的密度不再变化 b.容器内气体的平均相对分子质量不再变化
c. 的体积分数不再变化 d.断裂
的体积分数不再变化 d.断裂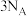 个
个 键的同时生成
键的同时生成 个水分子
个水分子
Ⅱ.研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
(3)碘蒸气存在能大幅度提高 的分解速率,反应历程为:
的分解速率,反应历程为:
第一步: (快反应)
(快反应)
第二步: (慢反应)
(慢反应)
第三步: (快反应)
(快反应)
实验表明,含碘时 分解速率方程
分解速率方程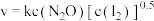 (
( 为速率常数)。下列表述正确的是___________。
为速率常数)。下列表述正确的是___________。
(4)在汽车尾气净化装置中, 和
和 发生反应
发生反应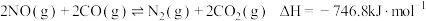 。实验测得:
。实验测得: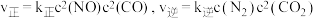 。其中
。其中 、
、 分别为正、逆反应速率常数,只与温度有关,
分别为正、逆反应速率常数,只与温度有关, 为浓度。
为浓度。
①达到平衡后,仅升高温度, 增大的倍数
增大的倍数___________ (填“大于”“小于”或“等于”) 增大的倍数。
增大的倍数。
②一定温度下在刚性 密闭容器中充入
密闭容器中充入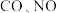 和
和 物质的量分别为
物质的量分别为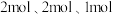 ,起始时压强为
,起始时压强为 ,达平衡时压强为
,达平衡时压强为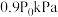 。则平衡时
。则平衡时 的转化率为
的转化率为___________ ,
___________ 。
 具有重要的意义。一定条件下,
具有重要的意义。一定条件下, 与
与 制备气态甲醇的反应方程式为
制备气态甲醇的反应方程式为 。
。(1)在容积为
 的恒温密闭容器中,充入
的恒温密闭容器中,充入 和
和 ,测得
,测得 和
和 的物质的量随时间的变化情况如下表。
的物质的量随时间的变化情况如下表。| 时间 | 0min | 3min | 6min | 9min | 12min |
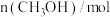 | 0 | 0.50 |  | 0.75 | 0.75 |
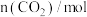 | 1 | 0.50 | 0.35 | 0.25 | 0.25 |
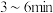 内,
内,
②
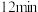 末时,混合气体中
末时,混合气体中 的物质的量分数为
的物质的量分数为③第
 时
时
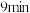 时
时 (填“>”、“<”或“=”),第
(填“>”、“<”或“=”),第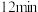 时,
时,
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(2)保持压强为
 ,向密闭容器中投入一定量
,向密闭容器中投入一定量 和
和 发生上述反应,若投料比m[
发生上述反应,若投料比m[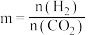 ]=1,一定温度下发生上述反应,下列说法不能作为反应是否达到平衡的判断依据的是
]=1,一定温度下发生上述反应,下列说法不能作为反应是否达到平衡的判断依据的是a.容器内气体的密度不再变化 b.容器内气体的平均相对分子质量不再变化
c.
 的体积分数不再变化 d.断裂
的体积分数不再变化 d.断裂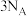 个
个 键的同时生成
键的同时生成 个水分子
个水分子Ⅱ.研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
(3)碘蒸气存在能大幅度提高
 的分解速率,反应历程为:
的分解速率,反应历程为:第一步:
 (快反应)
(快反应)第二步:
 (慢反应)
(慢反应)第三步:
 (快反应)
(快反应)实验表明,含碘时
 分解速率方程
分解速率方程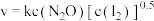 (
( 为速率常数)。下列表述正确的是___________。
为速率常数)。下列表述正确的是___________。A. 分解反应中,k值与碘蒸气浓度大小有关 分解反应中,k值与碘蒸气浓度大小有关 |
| B.v(第二步的逆反应)<v(第三步反应) |
| C.IO为反应的催化剂 |
| D.第二步活化能比第三步大 |
 和
和 发生反应
发生反应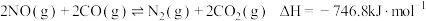 。实验测得:
。实验测得: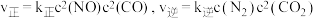 。其中
。其中 、
、 分别为正、逆反应速率常数,只与温度有关,
分别为正、逆反应速率常数,只与温度有关, 为浓度。
为浓度。①达到平衡后,仅升高温度,
 增大的倍数
增大的倍数 增大的倍数。
增大的倍数。②一定温度下在刚性
 密闭容器中充入
密闭容器中充入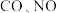 和
和 物质的量分别为
物质的量分别为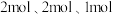 ,起始时压强为
,起始时压强为 ,达平衡时压强为
,达平衡时压强为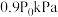 。则平衡时
。则平衡时 的转化率为
的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】研究碳氧化物、氮氧化物反应的特征及机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
(1)已知: 的燃烧热
的燃烧热 kJ·mol
kJ·mol ,
, 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol ,
,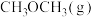 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol ,
,
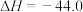 kJ⋅mol
kJ⋅mol 。则
。则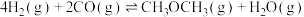

______ kJ⋅mol 。
。
(2)在恒温恒压条件下,向密闭容器中充入4.0 mol 和2.0 mol
和2.0 mol  ,发生反应
,发生反应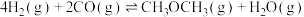 ,起始时体系压强为p,平衡时
,起始时体系压强为p,平衡时 的转化率为50%。达到平衡时,
的转化率为50%。达到平衡时,
______ ,平衡常数 (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。
(3)氮的氧化物与悬浮在大气中的海盐粒子相互作用,发生反应: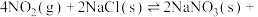
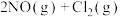 ,该反应的正反应需在低温条件下才能自发进行,则该反应的活化能:
,该反应的正反应需在低温条件下才能自发进行,则该反应的活化能: (正)
(正)_____ (填“>”或“<”) (逆)。
(逆)。
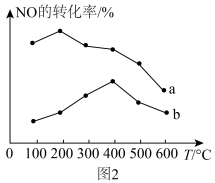
(4)CO还原NO的反应: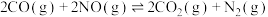

①实验测得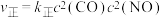 ,
,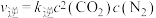 (
( ,
, 是速率常数,只与温度有关)。则升高温度,
是速率常数,只与温度有关)。则升高温度,
______ (填“增大”“减小”或“不变”),将 随温度变化的曲线
随温度变化的曲线______ 表示在图1中。______ 。_______ (填“正向移动”“逆向移动”或“不移动”)。
(1)已知:
 的燃烧热
的燃烧热 kJ·mol
kJ·mol ,
, 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol ,
,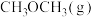 的燃烧热
的燃烧热 kJ⋅mol
kJ⋅mol ,
,
 kJ⋅mol
kJ⋅mol 。则
。则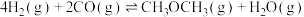

 。
。(2)在恒温恒压条件下,向密闭容器中充入4.0 mol
 和2.0 mol
和2.0 mol  ,发生反应
,发生反应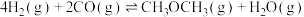 ,起始时体系压强为p,平衡时
,起始时体系压强为p,平衡时 的转化率为50%。达到平衡时,
的转化率为50%。达到平衡时,
 (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。(3)氮的氧化物与悬浮在大气中的海盐粒子相互作用,发生反应:
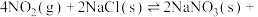
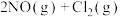 ,该反应的正反应需在低温条件下才能自发进行,则该反应的活化能:
,该反应的正反应需在低温条件下才能自发进行,则该反应的活化能: (正)
(正) (逆)。
(逆)。(4)CO还原NO的反应:
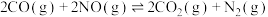

①实验测得
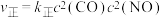 ,
,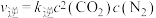 (
( ,
, 是速率常数,只与温度有关)。则升高温度,
是速率常数,只与温度有关)。则升高温度,
 随温度变化的曲线
随温度变化的曲线
您最近一年使用:0次
【推荐3】CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。已知部分反应的热化学方程式如下:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJ•mol-1
O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJ•mol-1
H2(g)+ O2(g)=H2O(1)△H2=-285.8kJ•mol-1
O2(g)=H2O(1)△H2=-285.8kJ•mol-1
H2O(g)=H2O(l) △H3=-44kJ•mol-1
则CO2与H2反应生成气态CH3OH和水蒸气的热化学方程式为__ 。
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) 2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
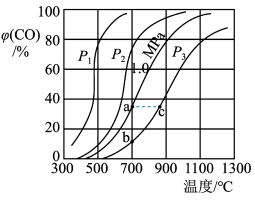
①压强p1__ 1.0MPa(填>、=或<)。
②900℃、1.0MPa时,足量碳与amolCO2反应达平衡后,CO2的转化率为__ ,该反应的平衡常数Kp=__ (保留小数点后一位数字)(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)①以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g) CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是
CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是___ (写一条即可)。
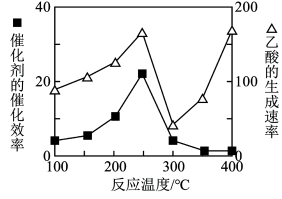
②在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__ ;300~400℃时,乙酸的生成速率升高的主要原因是__ 。
(4)将1.0×10-3mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为___ mol/L。(已知:CoCO3的溶度积为:Ksp=1.0×10-13)
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。已知部分反应的热化学方程式如下:
CH3OH(g)+
 O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJ•mol-1
O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJ•mol-1H2(g)+
 O2(g)=H2O(1)△H2=-285.8kJ•mol-1
O2(g)=H2O(1)△H2=-285.8kJ•mol-1H2O(g)=H2O(l) △H3=-44kJ•mol-1
则CO2与H2反应生成气态CH3OH和水蒸气的热化学方程式为
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)
 2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
①压强p1
②900℃、1.0MPa时,足量碳与amolCO2反应达平衡后,CO2的转化率为
(3)①以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)
 CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是
CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是②在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是

(4)将1.0×10-3mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为
您最近一年使用:0次



