CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。已知部分反应的热化学方程式如下:
CH3OH(g)+ O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJ•mol-1
O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJ•mol-1
H2(g)+ O2(g)=H2O(1)△H2=-285.8kJ•mol-1
O2(g)=H2O(1)△H2=-285.8kJ•mol-1
H2O(g)=H2O(l) △H3=-44kJ•mol-1
则CO2与H2反应生成气态CH3OH和水蒸气的热化学方程式为__ 。
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g) 2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
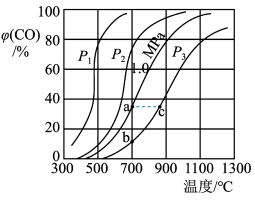
①压强p1__ 1.0MPa(填>、=或<)。
②900℃、1.0MPa时,足量碳与amolCO2反应达平衡后,CO2的转化率为__ ,该反应的平衡常数Kp=__ (保留小数点后一位数字)(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
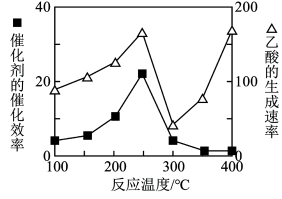
(3)①以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g) CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是
CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是___ (写一条即可)。
②在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__ ;300~400℃时,乙酸的生成速率升高的主要原因是__ 。
(4)将1.0×10-3mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为___ mol/L。(已知:CoCO3的溶度积为:Ksp=1.0×10-13)
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。已知部分反应的热化学方程式如下:
CH3OH(g)+
 O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJ•mol-1
O2(g)=CO2(g)+2H2O(1)△H1=-726.5kJ•mol-1H2(g)+
 O2(g)=H2O(1)△H2=-285.8kJ•mol-1
O2(g)=H2O(1)△H2=-285.8kJ•mol-1H2O(g)=H2O(l) △H3=-44kJ•mol-1
则CO2与H2反应生成气态CH3OH和水蒸气的热化学方程式为
(2)为研究CO2与CO之间的转化,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)
 2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
2CO(g) △H,反应达平衡后,测得压强、温度对CO的体积分数(φ(CO)%)的影响如图所示。回答下列问题:
①压强p1
②900℃、1.0MPa时,足量碳与amolCO2反应达平衡后,CO2的转化率为
(3)①以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)
 CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是
CH3COOH(g)。为了提高该反应中CO2的转化率,可以采取的措施是②在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是

(4)将1.0×10-3mol/LCoSO4与1.2×10-3mol/L的Na2CO3等体积混合,此时溶液中的Co2+的浓度为
更新时间:2020-06-04 16:12:48
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】“绿水青山就是金山银山”,运用化学反应原理研究碳、 氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.甲醇是一种可再生能源,具有广泛的开发和应用前景:工业上一般以CO和H2为原料合成 甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) ∆H1=-116kJ•mol-1
(1)已知:CO(g)+ O2(g)=CO2(g) ∆H2=-283kJ•mol-1
O2(g)=CO2(g) ∆H2=-283kJ•mol-1
H2(g)+ O2(g)=H2O(g) ∆H3=-242kJ•mol-1
O2(g)=H2O(g) ∆H3=-242kJ•mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___________ 。
(2)下列措施中有利于增大反应:CO(g)+2H2(g) CH3OH(g)的反应速率且利于反应正向进行的是
CH3OH(g)的反应速率且利于反应正向进行的是___________ 。
a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.增大体系压强 d.使用高效催化剂
(3)一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
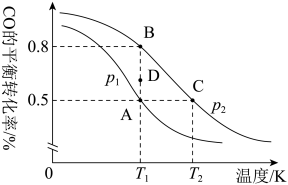
①该可逆反应的ΔH___________ 0(填“>”或“<”),A、B、C三点平衡常数KA、KB、KC的大小关系是___________ ;
②压强p1___________ p2(填“>”“<”或“=”),若p2=100kPa,则B点的Kp=___________ kPa-2(Kp为以分压表示的平衡常数;分压=总压×物质的量分数)
③在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:υ正___________ υ逆 (填“>”“<”或“=”)。
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下:
回答下列问题:
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为___________ ℃。
(5)800℃时,发生上述反应,某一时刻测得容器内物质的浓度分别为:CO2为2mol•L-1,H2为1.5mol•L-1,CO为1mol•L-1,H2O为3mol•L-1,则此时反应向___________ (填“正反应方向”或“逆反应方向”)进行。
I.甲醇是一种可再生能源,具有广泛的开发和应用前景:工业上一般以CO和H2为原料合成 甲醇,该反应的热化学方程式为:CO(g)+2H2(g)=CH3OH(g) ∆H1=-116kJ•mol-1
(1)已知:CO(g)+
 O2(g)=CO2(g) ∆H2=-283kJ•mol-1
O2(g)=CO2(g) ∆H2=-283kJ•mol-1H2(g)+
 O2(g)=H2O(g) ∆H3=-242kJ•mol-1
O2(g)=H2O(g) ∆H3=-242kJ•mol-1则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为
(2)下列措施中有利于增大反应:CO(g)+2H2(g)
 CH3OH(g)的反应速率且利于反应正向进行的是
CH3OH(g)的反应速率且利于反应正向进行的是a.随时将CH3OH与反应混合物分离 b.降低反应温度
c.增大体系压强 d.使用高效催化剂
(3)一定条件下向2L的密闭容器中充入1molCO和2molH2发生反应:CO(g)+2H2(g)
 CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示:
①该可逆反应的ΔH
②压强p1
③在T1和p1条件下,由D点到A点过程中,正、逆反应速率之间的关系:υ正
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下:
CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为
(5)800℃时,发生上述反应,某一时刻测得容器内物质的浓度分别为:CO2为2mol•L-1,H2为1.5mol•L-1,CO为1mol•L-1,H2O为3mol•L-1,则此时反应向
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】党的二十大报告中提出要打造“青山常在、绿水长流、空气常新”的美丽中国。工厂烟气(主要污染物SO2、NO)直接排放会造成空气污染,需处理后才能排放,
(1)O3氧化。O3氧化过程中部分反应的能量变化如图所示。
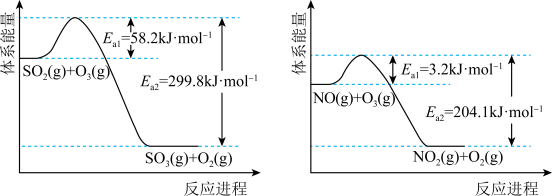
①已知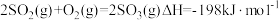 。则反应
。则反应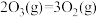 的△H
的△H__________ kJ·mol-1。
②其他条件不变时,增加m(O3),O3氧化NO的反应速率增大,而O3氧化SO2的反应速率几乎不受影响,其可能原因是__________ 。
(2)利用如图装置可同时吸收SO2和NO
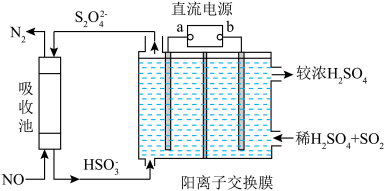
①已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为__________ 。
②写出电解池中发生的总反应的离子方程式为__________ 。
(3)烟气中的SO2可用Na2SO3溶液吸收。
室温下,吸收过程中,吸收液pH随n(SO ):n(HSO
):n(HSO )变化关系如下表:
)变化关系如下表:
当吸收液呈中性时,溶液中所有含硫微粒浓度由大到小的顺序为__________ 。
(4)尿素[CO(NH2)2]在催化剂存在的条件下可以将烟气中的NO转化为N2。
已知尿素水溶液高于160°C时会生成NH3和CO2。通过调整尿素喷入量与烟气流速,得到相同时间内不同投料比[n(尿素)/n(NO)]时NO的转化率随温度的变化情况如图所示。
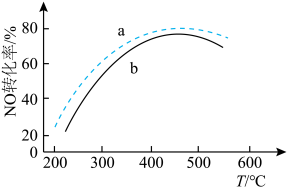
①曲线a和曲线b中,投料比较大的曲线是__________ 。
②T>450°C时,NO的转化率随温度升高而降低的原因是__________ 。
(1)O3氧化。O3氧化过程中部分反应的能量变化如图所示。

①已知
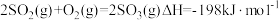 。则反应
。则反应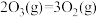 的△H
的△H②其他条件不变时,增加m(O3),O3氧化NO的反应速率增大,而O3氧化SO2的反应速率几乎不受影响,其可能原因是
(2)利用如图装置可同时吸收SO2和NO

①已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为
②写出电解池中发生的总反应的离子方程式为
(3)烟气中的SO2可用Na2SO3溶液吸收。
室温下,吸收过程中,吸收液pH随n(SO
 ):n(HSO
):n(HSO )变化关系如下表:
)变化关系如下表:n(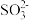 ):n( ):n(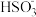 ) ) | 99:1 | 1:1 | 1:99 |
| pH | 8.2 | 7.2 | 6.2 |
(4)尿素[CO(NH2)2]在催化剂存在的条件下可以将烟气中的NO转化为N2。
已知尿素水溶液高于160°C时会生成NH3和CO2。通过调整尿素喷入量与烟气流速,得到相同时间内不同投料比[n(尿素)/n(NO)]时NO的转化率随温度的变化情况如图所示。

①曲线a和曲线b中,投料比较大的曲线是
②T>450°C时,NO的转化率随温度升高而降低的原因是
您最近一年使用:0次
【推荐3】为研究哈伯法合成氨反应,T℃时,在容积为2L恒容容器中通入4mol N2和12mol H2,反应如下:N2(g)+3H2(g) 2NH3(g) ΔH=-92.0kJ•mol-1,相关键能数据如下:
2NH3(g) ΔH=-92.0kJ•mol-1,相关键能数据如下:
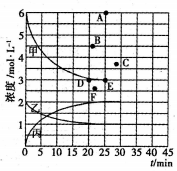
若25min时反应达到平衡,各物质浓度随时间变化曲线如下图中甲、乙、丙。回答下列问题:
(1)0-25min内,反应的平均速率v(H2)为___________ ;表中X=___________ 。
(2)T℃时,该反应的平衡常数K=___________ (用最简分数表达)。
(3)T℃时,若起始充入8mol N2和24mol H2,则反应刚达到平衡时,表示c(H2)在下图中相应的点为___________ (填字母)。
(4)以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C(s)+H2O(g) CO(g)+H2(g) ΔH1
CO(g)+H2(g) ΔH1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2
若已知CO和H2的燃烧热分别为283kJ·mol-l和285.8kJ·mol-l;H2O(g)=H2O(1) ΔH=-44kJ·mol-l则ΔH2=___________ 。
(5)氨气是生产硝酸的重要原料,其过程如下:
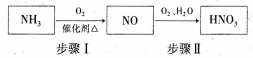
写出步骤I的化学方程式:___________ 。
(6)下图是科学家提出的利用电解法常温常压下由氮气、氢气合成氨的示意图:
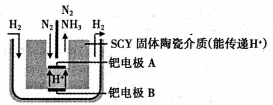
由图可知,钯电极B是电解池的___________ (填“阴极”或“阳极”);钯电极A上的电极反应式为___________ 。
 2NH3(g) ΔH=-92.0kJ•mol-1,相关键能数据如下:
2NH3(g) ΔH=-92.0kJ•mol-1,相关键能数据如下:| N≡N | H-H | N-H | |
| 键能数据(kJ/mol) | 946 | 436 | X |
(1)0-25min内,反应的平均速率v(H2)为
(2)T℃时,该反应的平衡常数K=
(3)T℃时,若起始充入8mol N2和24mol H2,则反应刚达到平衡时,表示c(H2)在下图中相应的点为

(4)以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C(s)+H2O(g)
 CO(g)+H2(g) ΔH1
CO(g)+H2(g) ΔH1②CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2若已知CO和H2的燃烧热分别为283kJ·mol-l和285.8kJ·mol-l;H2O(g)=H2O(1) ΔH=-44kJ·mol-l则ΔH2=
(5)氨气是生产硝酸的重要原料,其过程如下:

写出步骤I的化学方程式:
(6)下图是科学家提出的利用电解法常温常压下由氮气、氢气合成氨的示意图:

由图可知,钯电极B是电解池的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮及其化合物在科研及生产中均有重要的应用。根据已学知识回答下列问题:
(1)氮气与氧气在一定压强和 条件下发生催化氧化反应时,可发生不同反应,
条件下发生催化氧化反应时,可发生不同反应,
反应i: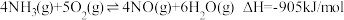
反应ii: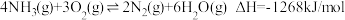
①该条件下氮气被氧气氧化为 的热化学方程式为
的热化学方程式为___________ 。
②反应i与反应ii有关物质产率与温度的关系如图甲。下列说法正确的是__ (填序号)。
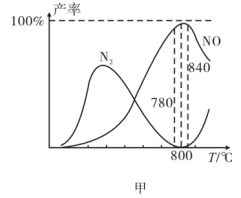
A.氨催化氧化生成 时,温度应控制在
时,温度应控制在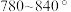
B.提高物料比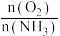 的值,主要目的是提高反应速率
的值,主要目的是提高反应速率
C.对反应加压可提高反应物平衡转化率
D.高于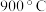 时
时 的产率降低的原因可能与高温下催化剂的活性降低有关
的产率降低的原因可能与高温下催化剂的活性降低有关
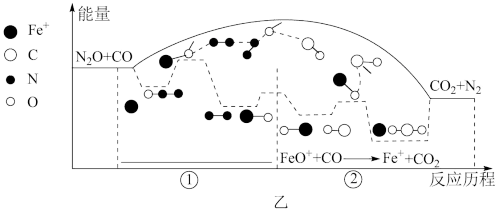
(2)有毒气体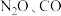 在上
在上 催化下发生反应:
催化下发生反应: 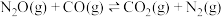 ,其反应分两步进行(如图乙所示),写出其中反应①的化学方程式:
,其反应分两步进行(如图乙所示),写出其中反应①的化学方程式:___________ 。总反应速率的快慢主要由其中一步反应决定,该反应是___________ (填“①”或“②”)。
(3)某科研小组向一密闭容器中通入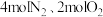 ,控制适当条件使其发生如下反应:
,控制适当条件使其发生如下反应: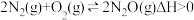 ,测出
,测出 的某种平衡物理量X(体积百分数或转化率)随着温度、压强变化而变化的情况如图丙所示。
的某种平衡物理量X(体积百分数或转化率)随着温度、压强变化而变化的情况如图丙所示。
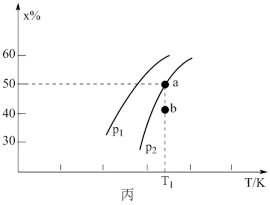
①X___________ (填“能”或“不能”)表示平衡体系中 的体积頁分数;
的体积頁分数; 的相对大小关系为
的相对大小关系为
___________  (填“>”=”或“<”)。
(填“>”=”或“<”)。
②若 ,计算
,计算 时的平衡常数
时的平衡常数 (
( 为用分压表示的平衡常数),写出计算过程
为用分压表示的平衡常数),写出计算过程______ 。
(1)氮气与氧气在一定压强和
 条件下发生催化氧化反应时,可发生不同反应,
条件下发生催化氧化反应时,可发生不同反应,反应i:
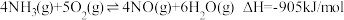
反应ii:
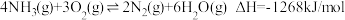
①该条件下氮气被氧气氧化为
 的热化学方程式为
的热化学方程式为②反应i与反应ii有关物质产率与温度的关系如图甲。下列说法正确的是

A.氨催化氧化生成
 时,温度应控制在
时,温度应控制在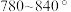
B.提高物料比
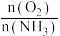 的值,主要目的是提高反应速率
的值,主要目的是提高反应速率C.对反应加压可提高反应物平衡转化率
D.高于
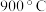 时
时 的产率降低的原因可能与高温下催化剂的活性降低有关
的产率降低的原因可能与高温下催化剂的活性降低有关(2)有毒气体
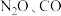 在上
在上 催化下发生反应:
催化下发生反应: 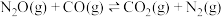 ,其反应分两步进行(如图乙所示),写出其中反应①的化学方程式:
,其反应分两步进行(如图乙所示),写出其中反应①的化学方程式:
(3)某科研小组向一密闭容器中通入
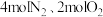 ,控制适当条件使其发生如下反应:
,控制适当条件使其发生如下反应: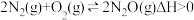 ,测出
,测出 的某种平衡物理量X(体积百分数或转化率)随着温度、压强变化而变化的情况如图丙所示。
的某种平衡物理量X(体积百分数或转化率)随着温度、压强变化而变化的情况如图丙所示。
①X
 的体积頁分数;
的体积頁分数; 的相对大小关系为
的相对大小关系为
 (填“>”=”或“<”)。
(填“>”=”或“<”)。②若
 ,计算
,计算 时的平衡常数
时的平衡常数 (
( 为用分压表示的平衡常数),写出计算过程
为用分压表示的平衡常数),写出计算过程
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】硫及其化合物在生产生活中有重要的应用。回答下列问题:
(1)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应如下:
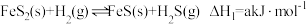

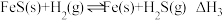
则
_______ (用含a、b的式子表示)。
(2) 溶液脱除空气中
溶液脱除空气中 并再生的原理如图甲所示。
并再生的原理如图甲所示。

将一定体积含有 的空气匀速通入
的空气匀速通入 溶液中,反应相同时间,初始
溶液中,反应相同时间,初始 浓度
浓度 及其
及其 与
与 脱除率的关系如图乙所示。当
脱除率的关系如图乙所示。当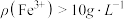 时,
时, 脱除率下降的原因是
脱除率下降的原因是_______ 。

(3)已知: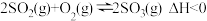 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是_______ (填标号)。
A.相同时间内,消耗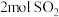 的同时生成
的同时生成 ,则反应达到平衡
,则反应达到平衡
B.使用催化剂,可以提高 的平衡转化率
的平衡转化率
C.当温度、压强一定时,气体的平均摩尔质量不变时,则反应达到平衡
D.增大氧气的浓度,活化分子的百分数增大,有效碰撞频率增大,反应速率加快
E.其他条件相同,恒压比恒容条件具有更高的平均反应速率和更大的平衡常数
(4)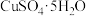 和少量水蒸气置于容积可变的真空密闭容器中,受热逐渐失去
和少量水蒸气置于容积可变的真空密闭容器中,受热逐渐失去 的三个化学方程式、水蒸气的平衡压强和温度的关系如表所示:
的三个化学方程式、水蒸气的平衡压强和温度的关系如表所示:
①图丙表示水蒸气平衡压强与温度的关系曲线,其中表示平衡时反应Ⅲ的曲线是_______ (填“a”“b”或“c”)。
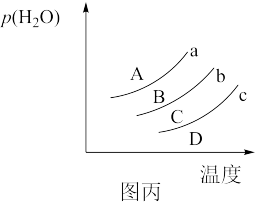
②设 为相对压力平衡常数,其表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为
为相对压力平衡常数,其表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为 )除以
)除以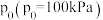 。在
。在 时,反应Ⅱ的
时,反应Ⅱ的
_______ 。
(1)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应如下:
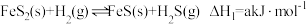

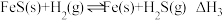
则

(2)
 溶液脱除空气中
溶液脱除空气中 并再生的原理如图甲所示。
并再生的原理如图甲所示。
将一定体积含有
 的空气匀速通入
的空气匀速通入 溶液中,反应相同时间,初始
溶液中,反应相同时间,初始 浓度
浓度 及其
及其 与
与 脱除率的关系如图乙所示。当
脱除率的关系如图乙所示。当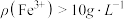 时,
时, 脱除率下降的原因是
脱除率下降的原因是
(3)已知:
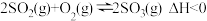 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是A.相同时间内,消耗
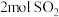 的同时生成
的同时生成 ,则反应达到平衡
,则反应达到平衡B.使用催化剂,可以提高
 的平衡转化率
的平衡转化率C.当温度、压强一定时,气体的平均摩尔质量不变时,则反应达到平衡
D.增大氧气的浓度,活化分子的百分数增大,有效碰撞频率增大,反应速率加快
E.其他条件相同,恒压比恒容条件具有更高的平均反应速率和更大的平衡常数
(4)
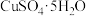 和少量水蒸气置于容积可变的真空密闭容器中,受热逐渐失去
和少量水蒸气置于容积可变的真空密闭容器中,受热逐渐失去 的三个化学方程式、水蒸气的平衡压强和温度的关系如表所示:
的三个化学方程式、水蒸气的平衡压强和温度的关系如表所示:| 化学方程式 | 水蒸气的平衡压强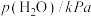 | |
 |  | |
Ⅰ: | 1.04 | 6.05 |
Ⅱ: | 0.75 | 4.00 |
Ⅲ: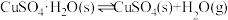 | 0.11 | 0.60 |
①图丙表示水蒸气平衡压强与温度的关系曲线,其中表示平衡时反应Ⅲ的曲线是

②设
 为相对压力平衡常数,其表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为
为相对压力平衡常数,其表达式为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为 )除以
)除以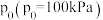 。在
。在 时,反应Ⅱ的
时,反应Ⅱ的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】大气环境中 的减量化排放受到国内外广泛关注。利用碳还原NO的反应为:
的减量化排放受到国内外广泛关注。利用碳还原NO的反应为: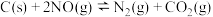 。回答下列问题:
。回答下列问题:
(1)该反应在常温下可以自发进行,则反应的
________ 0(填“ ”“
”“ ”或“
”或“ ”),有利于提高NO平衡转化率的条件是
”),有利于提高NO平衡转化率的条件是________ (任写一条)。
(2)以上反应可分为如下四步反应历程,写出其中第三步的反应:
第一步: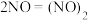
第二步: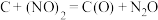
第三步:________
第四步: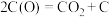
(3)对比研究活性炭负载钙、镧氧化物的反应活性。在三个反应器中分别加入C、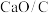 、
、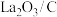 ,通入
,通入 使其浓度达到
使其浓度达到 。不同温度下,测得第2小时NO去除率如图所示:
。不同温度下,测得第2小时NO去除率如图所示:
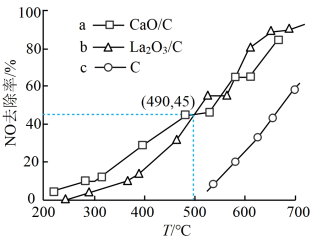
①据图分析,490℃以下,三种情况下反应的活化能最小的是________ (用a、b、c表示);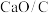 、
、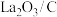 去除NO效果比C更好,其依据是
去除NO效果比C更好,其依据是________ (写一条)。
②上述实验中,490℃时,若测得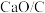 对NO的去除率为60%,则可能采取的措施是
对NO的去除率为60%,则可能采取的措施是________ 。
A.及时分离出 B.压缩体积
B.压缩体积
C.恒容下,向体系中通入氮气 D.寻找更好的催化剂
③490℃时的反应速率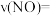
________ 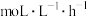 ,该温度下此反应的平衡常数为121,则反应达平衡时NO的去除率为
,该温度下此反应的平衡常数为121,则反应达平衡时NO的去除率为________ (保留二位有效数字)。
 的减量化排放受到国内外广泛关注。利用碳还原NO的反应为:
的减量化排放受到国内外广泛关注。利用碳还原NO的反应为: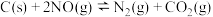 。回答下列问题:
。回答下列问题:(1)该反应在常温下可以自发进行,则反应的

 ”“
”“ ”或“
”或“ ”),有利于提高NO平衡转化率的条件是
”),有利于提高NO平衡转化率的条件是(2)以上反应可分为如下四步反应历程,写出其中第三步的反应:
第一步:
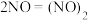
第二步:
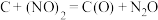
第三步:
第四步:
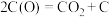
(3)对比研究活性炭负载钙、镧氧化物的反应活性。在三个反应器中分别加入C、
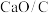 、
、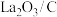 ,通入
,通入 使其浓度达到
使其浓度达到 。不同温度下,测得第2小时NO去除率如图所示:
。不同温度下,测得第2小时NO去除率如图所示:
①据图分析,490℃以下,三种情况下反应的活化能最小的是
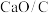 、
、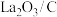 去除NO效果比C更好,其依据是
去除NO效果比C更好,其依据是②上述实验中,490℃时,若测得
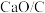 对NO的去除率为60%,则可能采取的措施是
对NO的去除率为60%,则可能采取的措施是A.及时分离出
 B.压缩体积
B.压缩体积C.恒容下,向体系中通入氮气 D.寻找更好的催化剂
③490℃时的反应速率
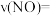
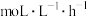 ,该温度下此反应的平衡常数为121,则反应达平衡时NO的去除率为
,该温度下此反应的平衡常数为121,则反应达平衡时NO的去除率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲醇和二甲醚是可再生能源,具有广泛的发展前景。相关的主要反应有:
制备合成气:I.
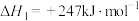

制备甲醇和二甲醚:Ⅱ.


Ⅲ.
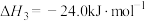

请回答:
(1)有利于制备合成气(反应I)的条件是___________ 。
A. 低温低压 B. 低温高压 C. 高温低压 D. 高温高压
(2)一定条件下,相关物质的相对能量与反应过程如下图:

①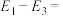
___________  。
。
②在某温度下,在体积为1L的恒容容器中,投料为1molCO和2molH2,仅发生反应Ⅱ和Ⅲ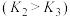 ,在
,在 时达到平衡状态,请画出
时达到平衡状态,请画出 之间
之间 的变化趋势
的变化趋势___________ 。
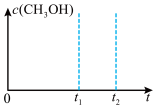
(3)甲醇生成二甲醚的转化率 可以根据冷凝液中的
可以根据冷凝液中的 与
与 的相对百分含量来计算(忽略副反应和各物质的挥发)。冷凝液中
的相对百分含量来计算(忽略副反应和各物质的挥发)。冷凝液中 的质量分数为
的质量分数为 ,
, 的质量分数为
的质量分数为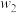 ,则甲醇的转化率
,则甲醇的转化率
___________ 。(用含 和
和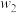 的式子表示)
的式子表示)
(4)制备合成气(反应I)时,还存在反应
 ,该过程可用于热化学能的储存。已知:储能效率
,该过程可用于热化学能的储存。已知:储能效率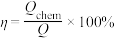 (
( 是通过化学反应吸收的热量,
是通过化学反应吸收的热量, 是设备的加热功率)。反应物气体流速、
是设备的加热功率)。反应物气体流速、 对
对 转化率
转化率 、储能效率(
、储能效率( )的影响,部分数据如下表:
)的影响,部分数据如下表:
①下列说法不正确 的是___________ 。
A.反应I可以储能的原因是该反应是吸热反应,将热量储存在高热值物质CO、H2中
B.其他条件不变,反应物气体流速越小,CH4转化率越大,有利于热化学能储存
C.其他条件不变, 越小,CH4转化率越大
越小,CH4转化率越大
D.反应物气体流速越大,CH4转化率越低的可能原因是反应物与催化剂未充分接触
②在实验2和3中,经过相同的时间,混合气中CO2占比越低,储能效率越高,说明其可能的原因___________ 。(该条件下设备的加热功率视为不变)
制备合成气:I.

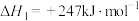

制备甲醇和二甲醚:Ⅱ.



Ⅲ.

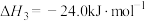

请回答:
(1)有利于制备合成气(反应I)的条件是
A. 低温低压 B. 低温高压 C. 高温低压 D. 高温高压
(2)一定条件下,相关物质的相对能量与反应过程如下图:

①
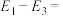
 。
。②在某温度下,在体积为1L的恒容容器中,投料为1molCO和2molH2,仅发生反应Ⅱ和Ⅲ
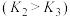 ,在
,在 时达到平衡状态,请画出
时达到平衡状态,请画出 之间
之间 的变化趋势
的变化趋势
(3)甲醇生成二甲醚的转化率
 可以根据冷凝液中的
可以根据冷凝液中的 与
与 的相对百分含量来计算(忽略副反应和各物质的挥发)。冷凝液中
的相对百分含量来计算(忽略副反应和各物质的挥发)。冷凝液中 的质量分数为
的质量分数为 ,
, 的质量分数为
的质量分数为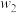 ,则甲醇的转化率
,则甲醇的转化率
 和
和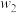 的式子表示)
的式子表示)(4)制备合成气(反应I)时,还存在反应

 ,该过程可用于热化学能的储存。已知:储能效率
,该过程可用于热化学能的储存。已知:储能效率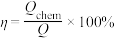 (
( 是通过化学反应吸收的热量,
是通过化学反应吸收的热量, 是设备的加热功率)。反应物气体流速、
是设备的加热功率)。反应物气体流速、 对
对 转化率
转化率 、储能效率(
、储能效率( )的影响,部分数据如下表:
)的影响,部分数据如下表:| 序号 | 加热温度/℃ | 反应物气体流速/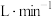 |  |  | 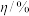 |
| 1 | 800 | 4 | 1:1 | 79.6 | 52.2 |
| 2 | 800 | 6 | 1:1 | 64.2 | 61.9 |
| 3 | 800 | 6 | 1:2 | 81.1 | 41.6 |
A.反应I可以储能的原因是该反应是吸热反应,将热量储存在高热值物质CO、H2中
B.其他条件不变,反应物气体流速越小,CH4转化率越大,有利于热化学能储存
C.其他条件不变,
 越小,CH4转化率越大
越小,CH4转化率越大D.反应物气体流速越大,CH4转化率越低的可能原因是反应物与催化剂未充分接触
②在实验2和3中,经过相同的时间,混合气中CO2占比越低,储能效率越高,说明其可能的原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】600℃时,将0.2molNO(g)和0.2molO2(g)置于2L密闭容器内发生反应生成NO2(g)的体系中,n(NO)随时间的变化如表所示:
(1)上述反应__ (填“是”或“不是”)可逆反应,在第2s时,NO的转化率为__ 。
(2)如图中表示NO2变化曲线的是___ ,用O2表示从0~1s内该反应的平均反应速率v=__ 。
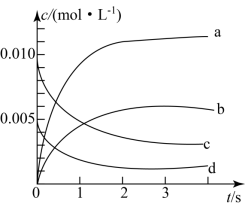
(3)平衡时体系压强与反应起始时体系压强的比为__ 。
(4)若该反应低温自发,欲增大该反应的K值,可采取的措施有(填序号)__ 。
A.降低温度 B.向混合气体中通入Cl2 C.使用高效催化剂 D.升高温度
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.20 | 0.12 | 0.08 | 0.06 | 0.06 | 0.06 |
(2)如图中表示NO2变化曲线的是

(3)平衡时体系压强与反应起始时体系压强的比为
(4)若该反应低温自发,欲增大该反应的K值,可采取的措施有(填序号)
A.降低温度 B.向混合气体中通入Cl2 C.使用高效催化剂 D.升高温度
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g) CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
a、b、c、d与m、n、x、y之间的关系式为________ .
(3)碳酸:H2CO3, K1=4.3×10﹣7, K2=5.6×10﹣11草酸:H2C2O4, K1=5.9×10﹣2, K2=6.4×10﹣5 ,0.1mol/LNa2CO3溶液的pH____ 0.1mol/LNa2C2O4溶液的pH,(选填“大于”“小于”或“等于”),等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___ .
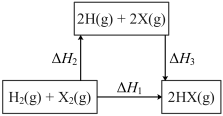
(4)在如图的转化关系中(X代表卤素)。ΔH2_____ 0(填“>”、“=”或“<”);△H1、△H2和△H3三者存在的关系为_______ 。
(5)现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④醋酸钠。请回答下列问题:
①醋酸钠中各离子浓度由大到小的顺序是_______ 。
②醋酸和醋酸钠等体积混合所得溶液中:c(CH3COOH)+c(CH3COO-)=______ mol·L-1。
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)
 CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
CH4(g)+2H2O(g),已知H2的体积分数随温度的升高而增加.若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)| v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
| [CO2]/mol•L﹣1 | [H2]/mol•L﹣1 | [CH4]/mol•L﹣1 | [H2O]/mol•L﹣1 | |
| 平衡Ⅰ | a | b | c | d |
| 平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为
(3)碳酸:H2CO3, K1=4.3×10﹣7, K2=5.6×10﹣11草酸:H2C2O4, K1=5.9×10﹣2, K2=6.4×10﹣5 ,0.1mol/LNa2CO3溶液的pH
(4)在如图的转化关系中(X代表卤素)。ΔH2

(5)现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④醋酸钠。请回答下列问题:
①醋酸钠中各离子浓度由大到小的顺序是
②醋酸和醋酸钠等体积混合所得溶液中:c(CH3COOH)+c(CH3COO-)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】磷酸锌常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰(主要含ZnO,还含少量FeO、Al2O3、CuO及SiO2)为原料制取磷酸锌的工艺流程如图所示:
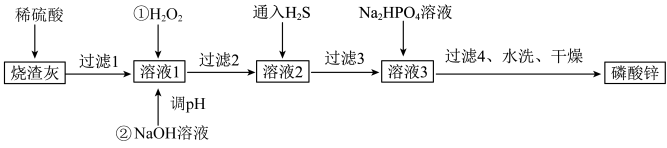
已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
(1)烧渣灰加入稀硫酸时,请写出ZnO与稀硫酸反应的离子方程式___________
(2)加入H2O2的作用___________
(3)经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是___________ 。
(4)加入Na2HPO4溶液发生反应的离子方程式为___________ 。
(5)洗涤磷酸锌沉淀时应选用___________ (填“冷水”或“热水”),确认磷酸锌洗涤干净的操作是___________ 。
(6)通入H2S是为了除铜离子,25°C时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1 mol·L-1,此时溶液中c(Cu2+)=6.3×10-15mol·L-1,则CuS的溶度积Ksp=___________ (已知:25°C时,H2S的电离平衡常数Ka1=1×10-7 mol∙L-1,Ka2=1×10-15 mol∙L-1)。

已知:①[Zn3(PO4)2]在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
| 金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4 | 6.5 |
| 完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(1)烧渣灰加入稀硫酸时,请写出ZnO与稀硫酸反应的离子方程式
(2)加入H2O2的作用
(3)经过滤2得到滤渣的主要成分是Fe(OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是
(4)加入Na2HPO4溶液发生反应的离子方程式为
(5)洗涤磷酸锌沉淀时应选用
(6)通入H2S是为了除铜离子,25°C时,当通入H2S达到饱和时测得溶液的pH=1,c(H2S)=0.1 mol·L-1,此时溶液中c(Cu2+)=6.3×10-15mol·L-1,则CuS的溶度积Ksp=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】已知草酸镍晶体(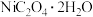 )难溶于水,其在高温下煅烧可制得三氧化二镍。以含镍合金废料(主要成分为镍,含有一定量的铁、铜和硅)为原料生产草酸镍的工艺流程如图:
)难溶于水,其在高温下煅烧可制得三氧化二镍。以含镍合金废料(主要成分为镍,含有一定量的铁、铜和硅)为原料生产草酸镍的工艺流程如图: 、
、 、
、 、
、 、
、 、
、 。
。
②草酸的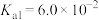 、
、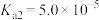 。
。
③氨水的 。
。
回答下列问题:
(1)实验室进行“酸浸”操作时,需要在通风橱中进行,其原因是___________ 。
(2) 的VSEPR模型为
的VSEPR模型为___________ 。
(3)“过滤”后,需要往滤液中加入 溶液制备草酸镍,
溶液制备草酸镍, 溶液呈
溶液呈___________ (填“酸”“碱”或“中”)性,溶液中离子浓度由大到小的顺序是___________ 。
(4)已知常温下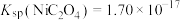 ,当溶液pH=2时,
,当溶液pH=2时, 沉淀完全[
沉淀完全[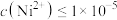
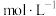 时认为沉淀完全],则此时溶液中草酸的浓度
时认为沉淀完全],则此时溶液中草酸的浓度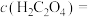
___________ 。
(5)镍钛记忆合金可用于制造飞机和宇宙飞船。已知一种镍钛合金的晶胞结构如图所示,其中Ti原子采用面心立方最密堆积方式,该合金中与Ti原子距离最近且相等的Ni原子个数为___________ ;若该合金的密度为 ,
, 代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是
代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是___________ (用含 和
和 的计算式表示,不必化简)pm。
的计算式表示,不必化简)pm。
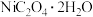 )难溶于水,其在高温下煅烧可制得三氧化二镍。以含镍合金废料(主要成分为镍,含有一定量的铁、铜和硅)为原料生产草酸镍的工艺流程如图:
)难溶于水,其在高温下煅烧可制得三氧化二镍。以含镍合金废料(主要成分为镍,含有一定量的铁、铜和硅)为原料生产草酸镍的工艺流程如图: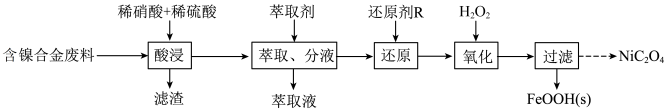
 、
、 、
、 、
、 、
、 、
、 。
。②草酸的
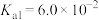 、
、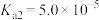 。
。③氨水的
 。
。回答下列问题:
(1)实验室进行“酸浸”操作时,需要在通风橱中进行,其原因是
(2)
 的VSEPR模型为
的VSEPR模型为(3)“过滤”后,需要往滤液中加入
 溶液制备草酸镍,
溶液制备草酸镍, 溶液呈
溶液呈(4)已知常温下
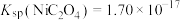 ,当溶液pH=2时,
,当溶液pH=2时, 沉淀完全[
沉淀完全[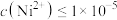
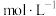 时认为沉淀完全],则此时溶液中草酸的浓度
时认为沉淀完全],则此时溶液中草酸的浓度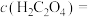
(5)镍钛记忆合金可用于制造飞机和宇宙飞船。已知一种镍钛合金的晶胞结构如图所示,其中Ti原子采用面心立方最密堆积方式,该合金中与Ti原子距离最近且相等的Ni原子个数为
 ,
, 代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是
代表阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是 和
和 的计算式表示,不必化简)pm。
的计算式表示,不必化简)pm。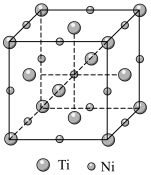
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法治金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
(1)从“正极”可以回收的金属有___ 。
(2)写出碱溶时Al箔溶解的离子方程式___ 。
(3)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池充电时正极的电极反应式为___ 。
(4)酸浸时产生标准状况下3.36LNO时,溶解 LiFePO4___ mol(其他杂质不与HNO3反应),若用H2O2代替HNO3,发生反应的离子方程式为___ 。
(5)流程中用“热水洗涤”的原因是___ 。
(6)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3后,Li+的沉降率到90%,计算滤液③中c(CO32-)=___ mol/L。
(7)“沉淀”时___ (填“能”或“不能”)用Na2SO4溶液代替饱和Na2CO3溶液,原因是___ 。
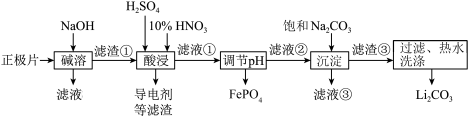
| T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
| 20 | 1.33 | 34.2 | 0.039 |
| 80 | 0.85 | 30.5 | —— |
| 100 | 0.72 | —— |
(1)从“正极”可以回收的金属有
(2)写出碱溶时Al箔溶解的离子方程式
(3)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池充电时正极的电极反应式为
(4)酸浸时产生标准状况下3.36LNO时,溶解 LiFePO4
(5)流程中用“热水洗涤”的原因是
(6)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3后,Li+的沉降率到90%,计算滤液③中c(CO32-)=
(7)“沉淀”时
您最近一年使用:0次



