选做【化学——物质结构与性质】
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①在基态Ti2+中,电子占据的最高能层符号为________ ,该能层具有的原子轨道数为______ 。
②BH4-的空间构型是________ (用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用 ,实现储氢和输氢。下列说法正确的是
,实现储氢和输氢。下列说法正确的是________ 。
a.[Cu(NH3)4]2+中,N原子是配位原子
b.NH3分子中氮原子的轨道杂化方式为sp2杂化
c.键角NH4+<NH3
d.相同压强时,NH3的沸点比PH3的沸点高
(3)富氢材料NH3和F2在Cu催化剂存在下反应直接得到NF3

上述化学方程式中的5种物质所属的晶体类型有________ (填序号)
a.离子晶体 b.分子晶体
c.原子晶体 d.金属晶体
(4)某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示。则这种合金的化学式为________________ 。
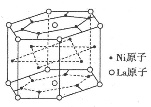
氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①在基态Ti2+中,电子占据的最高能层符号为
②BH4-的空间构型是
(2)液氨是富氢物质,是氢能的理想载体,利用
 ,实现储氢和输氢。下列说法正确的是
,实现储氢和输氢。下列说法正确的是a.[Cu(NH3)4]2+中,N原子是配位原子
b.NH3分子中氮原子的轨道杂化方式为sp2杂化
c.键角NH4+<NH3
d.相同压强时,NH3的沸点比PH3的沸点高
(3)富氢材料NH3和F2在Cu催化剂存在下反应直接得到NF3

上述化学方程式中的5种物质所属的晶体类型有
a.离子晶体 b.分子晶体
c.原子晶体 d.金属晶体
(4)某种合金材料有较大的储氢容量,其晶体结构的最小单元如图所示。则这种合金的化学式为

更新时间:2016-12-09 07:43:41
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】A、B、C、D、E、F、G七种短周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是内层电子数的3倍;D与G处在同一族;F是
地壳中含量最高的金属元素。请回答下列问题:
(1)元素F在周期表中的位置____________ 。
(2)B、C、D三种元素的第一电离能由大到小的顺序是___________ (用元素符号表示)。
(3)配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于_____________ (填晶体类型)。
(4)CA3分子的电子式为___________ 。
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是__________________ 。
(6)由A、D、G中任两种元素构成甲、乙两种均含18个电子的分子,所含原子的数目依次为3、4。则甲分子的中心原子采取________ 杂化;1 mol乙分子含有________ molσ键。
地壳中含量最高的金属元素。请回答下列问题:
(1)元素F在周期表中的位置
(2)B、C、D三种元素的第一电离能由大到小的顺序是
(3)配合物Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于
(4)CA3分子的电子式为
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是
(6)由A、D、G中任两种元素构成甲、乙两种均含18个电子的分子,所含原子的数目依次为3、4。则甲分子的中心原子采取
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】ZnGeP2和KTiOPO4都是非线性光学晶体材料,在激光技术方面有广泛用途。
回答下列问题:
(1)基态Ge原子的价电子排布式为_______ 。
(2)O、 P、 K、 Zn按电负性由大到小的顺序排列为_______ 。
(3)H2O、PH3、KH按熔点由高到低的顺序排列为_______ ,熔点差异的原因_______ 。
(4)以Zn为顶点的ZnGeP2晶胞结构如图所示。
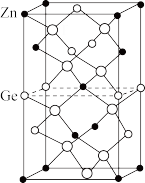
①Zn的配位数为_______ 。
②以Ge为顶点的晶胞中,Zn原子位于_______ 。
回答下列问题:
(1)基态Ge原子的价电子排布式为
(2)O、 P、 K、 Zn按电负性由大到小的顺序排列为
(3)H2O、PH3、KH按熔点由高到低的顺序排列为
(4)以Zn为顶点的ZnGeP2晶胞结构如图所示。

①Zn的配位数为
②以Ge为顶点的晶胞中,Zn原子位于
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】碳、氮、铁三种元素均可以形成一些结构独特、性能特殊的物质。回答下列问题:
(1)基态氮原子能量最高能级的电子云轮廓图为___________ 形;基态碳原子和铁原子所含未成对电子数之比为___________ 。
(2)铁与锰在元素周期表中属于相邻元素,二者电离能(I)如下表。
I3(Mn)>I3(Fe)的主要原因为___________ 。
(3)(CN)2分子中每个原子最外层均为8电子结构,则(CN)2分子中所含σ键与π键数目之比为___________ 。(CN)2的沸点为一21.2 °C,N2的沸点为一195.62 °C,(CN)2的沸点高于N2的原因为______ 。
(4)[Fe(CN)6]3-中化学键的类型为___________ ,配位体中碳原子的杂化方式为___________ 。
(5)铁原子与氮原子形成的一种晶胞如下图所示(白球代表铁原子,黑球代表氮原子)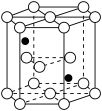 ,该晶体的化学式为
,该晶体的化学式为___________ ,已知该晶体的密度为d g· cm-3,正六棱柱底边边长为x cm,NA为阿伏加德罗常数的值,则该正六棱柱的高为___________ cm(用含x、d、NA的代数式表示,列出计算式即可)。
(1)基态氮原子能量最高能级的电子云轮廓图为
(2)铁与锰在元素周期表中属于相邻元素,二者电离能(I)如下表。
| 元素 | I1/(kJ·mol-1) | I2/(kJ·mol-1) | I3/(kJ·mol-1) |
| 锰 | 717.3 | 1509.9 | 3248 |
| 铁 | 762.5 | 1561.9 | 2 953 |
I3(Mn)>I3(Fe)的主要原因为
(3)(CN)2分子中每个原子最外层均为8电子结构,则(CN)2分子中所含σ键与π键数目之比为
(4)[Fe(CN)6]3-中化学键的类型为
(5)铁原子与氮原子形成的一种晶胞如下图所示(白球代表铁原子,黑球代表氮原子)
 ,该晶体的化学式为
,该晶体的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】
A、B、C、D、E、F、G均是原子序数小于36的元素。A的基态原子外围电子排布式为3s 2;B原子的L电子层的p能级上有一个空轨道;C元素的基态原子最外层有3个未成对电子,次外层有2个电子;D的原子的2p轨道上有l个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2。
根据信息回答下列问题:
(1)C的外围电子排布图为_______ 。C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为_____ ;分子的VSEPR模型名称为_____ ;阴离子的立体构型为______ 。
(2)A的元素符号为_____ ;G的价电子排布式为_______ 。
(3)F与BD易形成配合物F(BD)5,在F(BD)5中F的化合价为_____ ; BD分子的结构式为_____ , 1molBD分子中含有_____ molπ键。
(4)B、C、D、E原子两两相互化合形成的分子有多种,请列举两种分子内所有原子都满足最外层8电子稳定结构的分子_______ (写分子式)。
A、B、C、D、E、F、G均是原子序数小于36的元素。A的基态原子外围电子排布式为3s 2;B原子的L电子层的p能级上有一个空轨道;C元素的基态原子最外层有3个未成对电子,次外层有2个电子;D的原子的2p轨道上有l个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2。
根据信息回答下列问题:
(1)C的外围电子排布图为
(2)A的元素符号为
(3)F与BD易形成配合物F(BD)5,在F(BD)5中F的化合价为
(4)B、C、D、E原子两两相互化合形成的分子有多种,请列举两种分子内所有原子都满足最外层8电子稳定结构的分子
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】A、B、C、D、E均为36号以前的元素,A原子中只有一个能层且只含1个电子;B原子的2p轨道上得到2个电子后不能再容纳外来电子;C原子价电子排布式为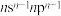 ;D的一种核素的质量数为59,中子数为31;E元素基态的正三价离子的3d轨道为半充满。请完成下列空白。
;D的一种核素的质量数为59,中子数为31;E元素基态的正三价离子的3d轨道为半充满。请完成下列空白。
(1)A的原子轨道形状为___________ 。
(2)B的元素名称___________ ,画出B的价层电子轨道表示式___________ 。
(3)C的基态原子核外电子空间运动状态有___________ 种。
(4)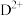 的核外电子排布式是
的核外电子排布式是___________ 。
(5)E的元素符号为___________ ,E元素基态原子的价层电子排布式___________ 。
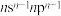 ;D的一种核素的质量数为59,中子数为31;E元素基态的正三价离子的3d轨道为半充满。请完成下列空白。
;D的一种核素的质量数为59,中子数为31;E元素基态的正三价离子的3d轨道为半充满。请完成下列空白。(1)A的原子轨道形状为
(2)B的元素名称
(3)C的基态原子核外电子空间运动状态有
(4)
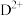 的核外电子排布式是
的核外电子排布式是(5)E的元素符号为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】部分元素的性质或原子结构如下表所示,根据要求完成相应的填空。
(1)①、③元素的名称分别是___________ 、____________ 。
(2)元素②原子的结构示意图为_____ 、元素⑤原子的电子式为__________ 。
(3)上述元素中,与Ne原子电子层结构相同的正离子的结构示意图为______ 。
(4)元素①所形成的简单离子的电子式可能为______ 、_______ 。
(5)以上元素所形成的化合物分子中,含有18个电子的化合物是___________ 、____________ 。
(6)②、③两元素形成化合物的化学式是_____ ,该物质由_________ 构成(填“分子”、“原子”或“离子”)。
元素编号 | 元素性质或原子结构 |
① | 质子数为1 |
② | 原子最外层电子数为a,次外层电子数为b |
③ | 原子L层电子数为a+b,M层电子数为a-b |
④ | 自然界含量最多的金属元素 |
⑤ | L层电子数为K层、M层电子数之和的原子 |
(2)元素②原子的结构示意图为
(3)上述元素中,与Ne原子电子层结构相同的正离子的结构示意图为
(4)元素①所形成的简单离子的电子式可能为
(5)以上元素所形成的化合物分子中,含有18个电子的化合物是
(6)②、③两元素形成化合物的化学式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】Ag+能与NH3、SCN-、CH3NH2等配体结合。为了探究含银配合物、硝酸银能否发生银镜反应,进行如下实验:
Ⅰ.含银配合物溶液的配制
(1)配制质量分数为10%的NaOH溶液,下列仪器不需要用到的是______ (填仪器名称)。
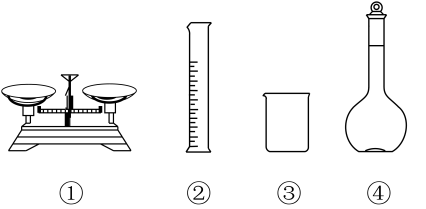
(2)配制含[Ag(SCN)2]-溶液:向洁净的试管中加入1mL10%NaOH溶液,随后加入1mL2%______ 溶液,再逐滴加入______ 溶液至生成的AgSCN沉淀恰好溶解。
Ⅱ.探究配合物稳定性与银镜反应的关系
不同含银配合物发生银镜反应的对比实验结果如表:
(3)写出实验①中[Ag(SCN)2]-与乙醛反应的离子方程式_______ 。
(4)实验出现银镜时间:①<②<③,可以得出的结论是_______ 。
Ⅲ.探究硝酸银的银镜反应
取一定量AgNO3溶液于试管中,滴入用氢氧化钠碱化的乙醛溶液。
(5)AgOH是白色物质,因此有观点认为该黑色沉淀可能是Ag,或者是二者混合物。立即产生黑色沉淀。也可能是_______ 。
(6)取黑色沉淀于试管中,加入足量的_______ ,若观察到_______ 的现象,则说明黑色沉淀中存在单质Ag。
Ⅰ.含银配合物溶液的配制
(1)配制质量分数为10%的NaOH溶液,下列仪器不需要用到的是

(2)配制含[Ag(SCN)2]-溶液:向洁净的试管中加入1mL10%NaOH溶液,随后加入1mL2%
Ⅱ.探究配合物稳定性与银镜反应的关系
不同含银配合物发生银镜反应的对比实验结果如表:
| 序号 | 配体 | 配位反应 | 温度 | 现象 |
| ① | SCN- | Ag++2SCN- [Ag(SCN)2]- K=2.04×108 [Ag(SCN)2]- K=2.04×108 | 室温 | 1min出现银镜 |
| ② | NH3 | Ag++2NH3 [Ag(NH3)2]+ K=1.6×107 [Ag(NH3)2]+ K=1.6×107 | 室温 | 无明显现象 |
| 60℃ | 8min出现银镜 | |||
| ③ | CH3NH2 | Ag++2CH3NH2 [Ag(CH3NH2)2]+ K=7.8×106 [Ag(CH3NH2)2]+ K=7.8×106 | 室温 | 无明显现象 |
| 60℃ | 15min出现银镜 |
(4)实验出现银镜时间:①<②<③,可以得出的结论是
Ⅲ.探究硝酸银的银镜反应
取一定量AgNO3溶液于试管中,滴入用氢氧化钠碱化的乙醛溶液。
(5)AgOH是白色物质,因此有观点认为该黑色沉淀可能是Ag,或者是二者混合物。立即产生黑色沉淀。也可能是
(6)取黑色沉淀于试管中,加入足量的
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铁氰化钾(化学式为K3[Fe(CN)6])在工业上主要应用于制药、电镀、造纸、钢铁生产,其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。回答下列问题:
(1)Fe3+比Fe2+稳定的原因______ 。
(2)在[Fe(CN)6]3-中不存在的化学键为______ 。
A.离子键
B.配位键
C.氢键
D.共价键
(3)已知(CN)2性质与卤素相似,化学上称为类卤化合物。
(CN)2+2 KOH═KCN+KCNO+H2O
KCN+HCl═HCN+KCl
C2H2+HCN→CH2=CH-C≡N
①KCNO中各元素原子的第一电离能由大到小排序为______ 。
②丙烯腈(CH2=CH-C≡N)分子中碳原子轨道杂化类型是______ ,分子中σ键和π键数目之比为______ 。
(4)氮化铁晶体的晶胞结构如图1所示,该晶体中铁、氮的微粒个数之比为______ 。

(5)已知:氧化亚铁晶体的密度为pg•cm-3,NA表示阿伏加 德罗常数的值。氧化亚铁晶体的晶胞如图2所示,该晶胞中,与O2-紧邻且等距离的O2-数目为______ ;Fe2+与O2-的最短核间距为______ pm。
(1)Fe3+比Fe2+稳定的原因
(2)在[Fe(CN)6]3-中不存在的化学键为
A.离子键
B.配位键
C.氢键
D.共价键
(3)已知(CN)2性质与卤素相似,化学上称为类卤化合物。
(CN)2+2 KOH═KCN+KCNO+H2O
KCN+HCl═HCN+KCl
C2H2+HCN→CH2=CH-C≡N
①KCNO中各元素原子的第一电离能由大到小排序为
②丙烯腈(CH2=CH-C≡N)分子中碳原子轨道杂化类型是
(4)氮化铁晶体的晶胞结构如图1所示,该晶体中铁、氮的微粒个数之比为

(5)已知:氧化亚铁晶体的密度为pg•cm-3,NA表示阿伏加 德罗常数的值。氧化亚铁晶体的晶胞如图2所示,该晶胞中,与O2-紧邻且等距离的O2-数目为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铜及其化合物在生产生活中有着广泛的应用。请回答下列问题:
(1) 铜元素在元素周期表中的位置为______ ,基态Cu原子核外有______ 种不同运动状态的电子。
(2) 铜合金可用于制造航母螺旋桨。制造过程中产生的含铜废液可利用铜萃取剂M,通过如图反应实现铜离子的富集回收。
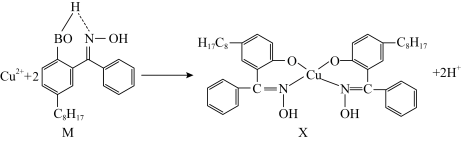
① M所含元素的电负性由大到小的顺序为________ (用元素符号表示)。
② X中采用sp3杂化的非金属原子有_____________ (填元素名称)。
(3) 在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体Y产生。Y分子的立体构型是_____ ,Y的沸点比水低的主要原因是______ 。Fe的价电子排布式为_____ 。
(4) 向蓝色[Cu(H2O)4]2+硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4]2+。通过上述实验现象可知,与Cu2+的配位能力:H2O____ NH3(填“大于”或“小于”)。
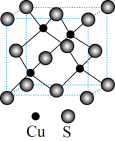
(5) CuS与ZnS的晶胞相似,结构如图所示。CuS晶胞中与硫原子距离最近且相等的硫原子有12个,若CuS晶胞的密度为ρ g·cm-3,用NA代表阿伏加 德罗常数的值,则晶胞边长为________ nm。
(1) 铜元素在元素周期表中的位置为
(2) 铜合金可用于制造航母螺旋桨。制造过程中产生的含铜废液可利用铜萃取剂M,通过如图反应实现铜离子的富集回收。

① M所含元素的电负性由大到小的顺序为
② X中采用sp3杂化的非金属原子有
(3) 在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体Y产生。Y分子的立体构型是
(4) 向蓝色[Cu(H2O)4]2+硫酸铜溶液中加入稍过量的氨水,溶液变为深蓝色[Cu(NH3)4]2+。通过上述实验现象可知,与Cu2+的配位能力:H2O
(5) CuS与ZnS的晶胞相似,结构如图所示。CuS晶胞中与硫原子距离最近且相等的硫原子有12个,若CuS晶胞的密度为ρ g·cm-3,用NA代表阿伏加 德罗常数的值,则晶胞边长为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】1937年,意大利化学家西格雷等用氘核去轰击某一元素,两种原子核融合制得了第一个人造元素锝Tc。
(1)请指出,西格雷等用氘核去轰击的是_______ 元素。
(2)金属Tc属于六方最密堆积,Tc原子的金属半径为0.136nm,求金属Tc的密度_______ ;
(3)下图是立方和六方最密堆积中原子的配位多面体,请指出哪一种对应晶体中Tc原子的配位多面体_______ ;

(4)对锰副族的最高价氧化物的水化物HMnO4、HTcO4、HReO4,酸性顺序如何_______ ?
(5)从合成锝Tc之后,科学家又何成了许多新元素。关于新元素的命名,国际化学会无机化学分会决定,从110号元素之后,不再以人名或国名来命名元素的名称,而采用拉丁文数字缩写来命名,如110号Ununilium(元素符号Uun),111号Ununnilium(元素符号Uuu),112号Ununbium(元素符号Uub),113号Ununtrium(元素符号Uut),114号Ununquadium(元素符号Uuq),115号Ununpentium(元素符号Uup),116号Ununhexium(元素符号Uuh),117号Ununseptium(元素符号Uus),118号Ununoctium(元素符号Uuo),119号Ununennium(元素符号Uue)。请你根据命名规律命名126号和128号元素_______ ,同时给出元素符号_______ ;
(6)请根据电子的填充规律,说明从多少号元素开始填充5g轨道_______ 。
(1)请指出,西格雷等用氘核去轰击的是
(2)金属Tc属于六方最密堆积,Tc原子的金属半径为0.136nm,求金属Tc的密度
(3)下图是立方和六方最密堆积中原子的配位多面体,请指出哪一种对应晶体中Tc原子的配位多面体

(4)对锰副族的最高价氧化物的水化物HMnO4、HTcO4、HReO4,酸性顺序如何
(5)从合成锝Tc之后,科学家又何成了许多新元素。关于新元素的命名,国际化学会无机化学分会决定,从110号元素之后,不再以人名或国名来命名元素的名称,而采用拉丁文数字缩写来命名,如110号Ununilium(元素符号Uun),111号Ununnilium(元素符号Uuu),112号Ununbium(元素符号Uub),113号Ununtrium(元素符号Uut),114号Ununquadium(元素符号Uuq),115号Ununpentium(元素符号Uup),116号Ununhexium(元素符号Uuh),117号Ununseptium(元素符号Uus),118号Ununoctium(元素符号Uuo),119号Ununennium(元素符号Uue)。请你根据命名规律命名126号和128号元素
(6)请根据电子的填充规律,说明从多少号元素开始填充5g轨道
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】白磷(P4)在化工、军事等领域有着广泛应用。工业上采用Ca3(PO4)2、SiO2及C为原料制备,产物除P4外,还有CaSiO3、CO等。
回答下列问题:
(1)下列状态的钙中,电离最外层第一个电子所需能量最小的是________ (填选项字母)。
A.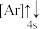 B.
B.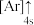 C.
C.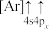 D.
D.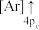
(2)SiO2硬而脆,其原因是_____________________________________________________ 。
(3) 的空间构型为
的空间构型为____________________________ ,酸性条件下,可与Fe3+形成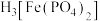 从而掩蔽溶液中的Fe3+,基态Fe3+核外M层有
从而掩蔽溶液中的Fe3+,基态Fe3+核外M层有________ 种空间运动状态不同的电子。
(4)P4分子中P原子的杂化形式为_______________________________ ,P4难溶于水而易溶于CS2,原因是____________________________________ 。
(5)CO可与第四周期过渡元素形成羰基配合物,形成配合物时,每个CO提供一对电子与金属原子形成配位键,研究发现金属原子的价电子和CO提供的电子总和等于18。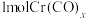 中所含
中所含 键的物质的量为
键的物质的量为________ mol(填数值)
(6)天然硅酸盐组成复杂,其复杂性在其阴离子,而阴离子的基本结构单元是硅氧四面体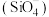 。硅、氧原子通过共用氧原子形成各种不同的硅酸根负离子,无限长链的硅酸根离子(如图a所示)的化学式可用通式表示为
。硅、氧原子通过共用氧原子形成各种不同的硅酸根负离子,无限长链的硅酸根离子(如图a所示)的化学式可用通式表示为_____________________________ (用n代表Si原子数,不考虑边界氧原子)。
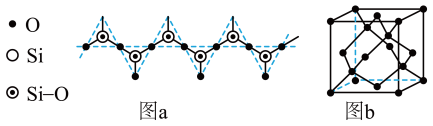
(7)单晶硅的晶体结构与金刚石的一种晶体结构相似(如图b所示),则晶胞中Si原子的体积占晶胞体积的百分率为________ (列出计算式即可)。
回答下列问题:
(1)下列状态的钙中,电离最外层第一个电子所需能量最小的是
A.
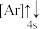 B.
B.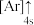 C.
C.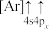 D.
D.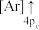
(2)SiO2硬而脆,其原因是
(3)
 的空间构型为
的空间构型为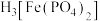 从而掩蔽溶液中的Fe3+,基态Fe3+核外M层有
从而掩蔽溶液中的Fe3+,基态Fe3+核外M层有(4)P4分子中P原子的杂化形式为
(5)CO可与第四周期过渡元素形成羰基配合物,形成配合物时,每个CO提供一对电子与金属原子形成配位键,研究发现金属原子的价电子和CO提供的电子总和等于18。
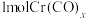 中所含
中所含 键的物质的量为
键的物质的量为(6)天然硅酸盐组成复杂,其复杂性在其阴离子,而阴离子的基本结构单元是硅氧四面体
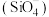 。硅、氧原子通过共用氧原子形成各种不同的硅酸根负离子,无限长链的硅酸根离子(如图a所示)的化学式可用通式表示为
。硅、氧原子通过共用氧原子形成各种不同的硅酸根负离子,无限长链的硅酸根离子(如图a所示)的化学式可用通式表示为
(7)单晶硅的晶体结构与金刚石的一种晶体结构相似(如图b所示),则晶胞中Si原子的体积占晶胞体积的百分率为
您最近一年使用:0次
【推荐3】过氧化锶在工业上常用作家庭及工业用漂白剂、氧化剂等。以工业碳酸锶(含少量BaCO3)为原料,按如图所示流程可制备SrO2•8H2O。

(1)将工业碳酸锶粉碎制成浆液原因是______ 。
(2)酸浸”步骤中锶的浸出率与温度、时间的关系如图所示:
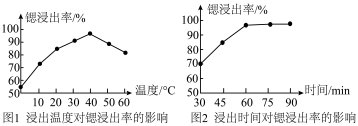
据此合适的工业生产条件为______ 。
(3)“除杂”时溶液中除含有Sr2+和Cl-外,还含有少量的Ba2+。为了除去杂质Ba2+,同时提高原料的利用率,溶液中Sr2+的浓度应不高于______ mol•L-l。(注:已知室温条件,BaSO4的Ksp为1.1×10-10,SrSO4的Ksp为3.3×10-7;残留在溶液中的离子浓度小于1.0×10-5mol/L时,离子完全沉淀。)
(4)“制备”步骤中发生反应的离子方程式为______ 。
(5)①锶(Sr)位于第五周期第IIA族,其价电子排布式为______ 。
②根据离子化合物溶解性判断的经验规律,晶格能越大的,其溶解度往往越小。则在水中溶解度S(SrCl2)______ S(SrF2)(填“>”“<”或“=”)。
③一种SrCl2晶体的晶胞结构如图所示:

由图可知,每个Sr2+周围紧邻且等距离的Cl-个数为______ ;已知晶胞边长为apm,159gSrCl2固体的体积为bcm3,则阿伏伽德罗常数NA的值为______ (用含a、b的式子表示)。
(6)SrO2•8H2O遇CO2会变质,反应的化学方程式为______ 。

(1)将工业碳酸锶粉碎制成浆液原因是
(2)酸浸”步骤中锶的浸出率与温度、时间的关系如图所示:

据此合适的工业生产条件为
(3)“除杂”时溶液中除含有Sr2+和Cl-外,还含有少量的Ba2+。为了除去杂质Ba2+,同时提高原料的利用率,溶液中Sr2+的浓度应不高于
(4)“制备”步骤中发生反应的离子方程式为
(5)①锶(Sr)位于第五周期第IIA族,其价电子排布式为
②根据离子化合物溶解性判断的经验规律,晶格能越大的,其溶解度往往越小。则在水中溶解度S(SrCl2)
③一种SrCl2晶体的晶胞结构如图所示:

由图可知,每个Sr2+周围紧邻且等距离的Cl-个数为
(6)SrO2•8H2O遇CO2会变质,反应的化学方程式为
您最近一年使用:0次



