【化学—选修3:物质结构】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子; B元素是地壳中含量最多的金属元素;C原子核外的M层中有两对成对电子;D是使用最广泛的合金的主要成分。E原子核外最外层只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E+离子的最外层电子排布式___ ,A、B、C的第一电离能最小的是_____ 。
(2)A的最高价含氧酸分子中心原子是_____ 杂化。
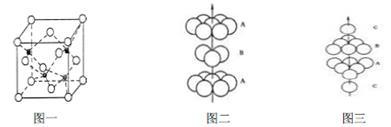
(3)A、B形成某种化合物的晶胞结构如下图一所示(“O”表示B原子),则其化学式为________ ,一个A原子周围距离最近且等距的A原子有_____________ 个。B原子的堆积方式与下图中的_______ 相同。(填“图二”或“图三”)
(4)1183 K 以下D 晶体的晶胞为钾型,而1183 K 以上则转变为铜型,在两种晶胞中最邻近的D 原子间距离相同,则两种晶体中原子的空间利用率之比为____ (可用根号表示)。
(5)开发新型储氢材料是氢能利用的重要研究方向。分子X 可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X 一定不是______ (填标号)。
A. H2O B. CH4 C. HF D. CO(NH2)2
(1)E+离子的最外层电子排布式
(2)A的最高价含氧酸分子中心原子是
(3)A、B形成某种化合物的晶胞结构如下图一所示(“O”表示B原子),则其化学式为

(4)1183 K 以下D 晶体的晶胞为钾型,而1183 K 以上则转变为铜型,在两种晶胞中最邻近的D 原子间距离相同,则两种晶体中原子的空间利用率之比为
(5)开发新型储氢材料是氢能利用的重要研究方向。分子X 可以通过氢键形成“笼状结构”而成为潜在的储氢材料。X 一定不是
A. H2O B. CH4 C. HF D. CO(NH2)2
更新时间:2016-12-09 10:22:59
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
【推荐1】氮化镓(GaN)、磷化镓(GaP)、砷化镓(GaAs)材料都是半导体材料。请回答下列问题:
(1)写出基态P原子的核外电子排布式_______ 。
(2)GaN、GaP、GaAs具有相同的晶体类型,熔点如下表所示,分析其变化原因:_______ 。
(3)GaAs可由(CH3)3Ga和AsH3反应制得。在常温常压下,(CH3)3Ga为无色透明液体,(CH3)3Ga中Ga原子的杂化方式为_______ ;AsH3分子的空间构型为_______ ;与AsH3互为等电子体的一种微粒为_______ 。
(4)一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=_______ g·cm-3。
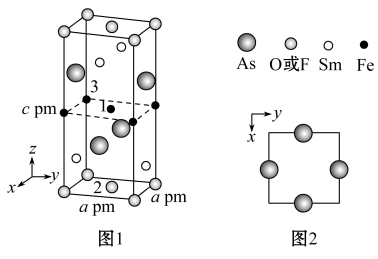
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为 ,则原子2的坐标为
,则原子2的坐标为_______ 。
(1)写出基态P原子的核外电子排布式
(2)GaN、GaP、GaAs具有相同的晶体类型,熔点如下表所示,分析其变化原因:
| 晶体 | GaN | GaP | GaAs |
| 熔点/℃ | 1700 | 1477 | 1238 |
(4)一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为
 ,则原子2的坐标为
,则原子2的坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】我国科学家在铁基超导研究方面取得了一系列的重大突破,标志着我国在凝聚态物理领域已经成为一个强国。LiZnAs 是研究铁基超导材料的重要前体。
(1)LiZnAs 中三种元素的电负性从小到大的顺序为_____ 。
(2)AsF3分子的空间构型为_____ ,As 原子的杂化轨道类型为_____ 。
(3)CO 分子内因配位键的存在,使 C 原子上的电子云密度较高而易与血红蛋白结合, 导致 CO 有剧毒。1mol[Zn(CN)4]2-离子内含有的共价键的数目为_____ ,配原子为_____ 。
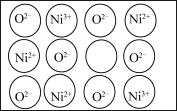
(4)镍的氧化物常用作电极材料的基质。纯粹的 NiO 晶体的结构与 NaCl 的晶体结构相同,为获得更好的导电能力,将纯粹的 NiO 晶体在空气中加热,使部分 Ni2+被氧化成 Ni3+后, 每个晶胞内 O2-的数目和位置均未发生变化,镍离子的位置虽然没变,但其数目减少,造成晶体内产生阳离子空位(如图所示)。化学式为 NiO 的某镍氧化物晶体,阳离子的平均配位数为__________ ,阴离子的平均配位数与纯粹的 NiO 晶体相比____________ (填“增大”“减小”或“不变””,写出能体现镍元素化合价的该晶体的化学式________ 示例:Fe3O4写作 Fe2+Fe23+O4)。
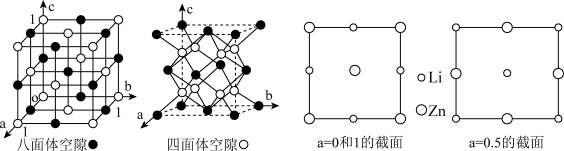
(5)所有的晶体均可看作由某些微粒按一定的方式堆积,另外的某些微粒填充在上述堆 积所形成的空隙中。在面心立方紧密堆积的晶胞中存在两种类型的空隙:八面体空隙和四面体空隙(如下左图所示)。在 LiZnAs 立方晶胞中,Zn 以面心立方形式堆积,Li 和 As 分别填充在 Zn 原子围成的八面体空隙和四面体空隙中,在 a=0,0.5 和 1 三个截面上 Zn 和 Li 按下图所示分布:请在下图 As 原子所在的截面上用“Δ”补画出 As 原子的位置,______________ 并说明 a=__________ 。
(1)LiZnAs 中三种元素的电负性从小到大的顺序为
(2)AsF3分子的空间构型为
(3)CO 分子内因配位键的存在,使 C 原子上的电子云密度较高而易与血红蛋白结合, 导致 CO 有剧毒。1mol[Zn(CN)4]2-离子内含有的共价键的数目为
(4)镍的氧化物常用作电极材料的基质。纯粹的 NiO 晶体的结构与 NaCl 的晶体结构相同,为获得更好的导电能力,将纯粹的 NiO 晶体在空气中加热,使部分 Ni2+被氧化成 Ni3+后, 每个晶胞内 O2-的数目和位置均未发生变化,镍离子的位置虽然没变,但其数目减少,造成晶体内产生阳离子空位(如图所示)。化学式为 NiO 的某镍氧化物晶体,阳离子的平均配位数为

(5)所有的晶体均可看作由某些微粒按一定的方式堆积,另外的某些微粒填充在上述堆 积所形成的空隙中。在面心立方紧密堆积的晶胞中存在两种类型的空隙:八面体空隙和四面体空隙(如下左图所示)。在 LiZnAs 立方晶胞中,Zn 以面心立方形式堆积,Li 和 As 分别填充在 Zn 原子围成的八面体空隙和四面体空隙中,在 a=0,0.5 和 1 三个截面上 Zn 和 Li 按下图所示分布:请在下图 As 原子所在的截面上用“Δ”补画出 As 原子的位置,


您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】A、B、C、D、E代表五种常见元素,它们的核电荷数依次增大。其中元素E的基态3d轨道上有2个电子,A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物。请回答下列问题:
(1)E的基态原子价层电子排布式为_______ 。
(2)A、B及周期表中与A、B均紧邻的元素的第一电离能由大到小的顺序为_______ (用元素符号表示)。
(3)AB2分子中,A的杂化类型是_____ ;1个AB2分子中,含有______ 个π键;与AB2互为等电子体的分子有______ (写一种,下同),离子有_______ 。
(4)AB2形成的晶体的熔点______ (填“高于”、“低于”或“无法判断”)CD形成的晶体的熔点,原因是________ 。
(5)由化合物CD组成的晶体中,阴、阳离子都具有或近似具有球形对称结构,它们都可以看作刚性圆球,并彼此“相切”。如图所示为C、D形成化合物的晶胞结构图以及晶胞的剖面图:
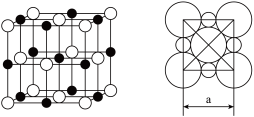
在该晶体中阴离子的配位数为______ ;若a=5.6×10−10 m,则该晶体的密度为______ g·cm−3(精确到小数点后1位)。
(1)E的基态原子价层电子排布式为
(2)A、B及周期表中与A、B均紧邻的元素的第一电离能由大到小的顺序为
(3)AB2分子中,A的杂化类型是
(4)AB2形成的晶体的熔点
(5)由化合物CD组成的晶体中,阴、阳离子都具有或近似具有球形对称结构,它们都可以看作刚性圆球,并彼此“相切”。如图所示为C、D形成化合物的晶胞结构图以及晶胞的剖面图:

在该晶体中阴离子的配位数为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。回答下列问题:
(1)基态Fe3+的电子排布式为___________ ;实验室用KSCN溶液、苯酚( )检验Fe3+,N、O、S的第一电离能由大到小的顺序为
)检验Fe3+,N、O、S的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(2)基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1mol Fe(CO)5分子中含σ键数目为___________ ,与CO互为等电子体的离子是___________ (填化学式,写一种)
(3)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为___________ 。

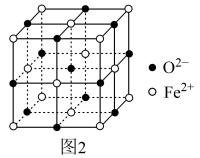
(4)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为___________ ;Fe2+与O2-的最短间距为___________ pm。
(1)基态Fe3+的电子排布式为
 )检验Fe3+,N、O、S的第一电离能由大到小的顺序为
)检验Fe3+,N、O、S的第一电离能由大到小的顺序为(2)基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1mol Fe(CO)5分子中含σ键数目为
(3)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为

(4)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。回答下列问题:
(1)基态Ga原子的价层电子排布式为___________ 。
(2)LiGaH4是一种温和的还原剂,其可由GaCl3和过量的LiH反应制得: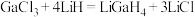 。
。
①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为___________ 。
② 的立体构型为
的立体构型为___________ 。
(3)一种含镓的药物合成方法如图所示:
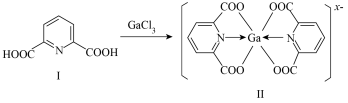
化合物Ⅰ中环上C原子的杂化方式为________ ,1mol化合物Ⅰ中含有的 键的物质的量为
键的物质的量为___________ 。
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:
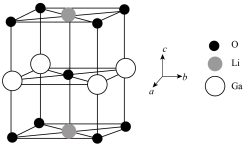
①上述晶胞沿着a轴的投影图为________ (填选项字母)。
A.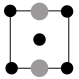 B.
B.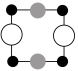 C.
C.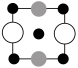
②用 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为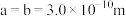 ,
,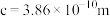 ,则其密度为
,则其密度为________  (列出计算式即可)。
(列出计算式即可)。
(1)基态Ga原子的价层电子排布式为
(2)LiGaH4是一种温和的还原剂,其可由GaCl3和过量的LiH反应制得:
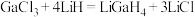 。
。①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
②
 的立体构型为
的立体构型为(3)一种含镓的药物合成方法如图所示:

化合物Ⅰ中环上C原子的杂化方式为
 键的物质的量为
键的物质的量为(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其四方晶胞结构如图所示:

①上述晶胞沿着a轴的投影图为
A.
 B.
B. C.
C.
②用
 表示阿伏加德罗常数的值,晶胞参数为
表示阿伏加德罗常数的值,晶胞参数为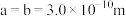 ,
,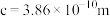 ,则其密度为
,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(MgxFe2-xSiO4)。回答下列问题:
(1)基态Fe原子的价电子排布式为___________ 。橄榄石中,各元素电负性大小顺序为___________ ,铁的化合价为___________ 。
(2)已知一些物质的熔点数据如下表:
①Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是___________ 。
②分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因___________ 。
③SiCl4的空间结构为___________ ,其中Si的轨道杂化形式为___________ 。
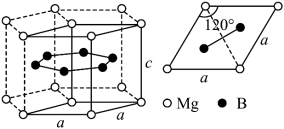
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,________ 个Mg,该物质化学式为_________ ,B-B最近距离为___________ 。
(1)基态Fe原子的价电子排布式为
(2)已知一些物质的熔点数据如下表:
| 物质 | NaCl | SiCl4 | GeCl4 | SnCl4 |
| 熔点/℃ | 800.7 | -68.8 | -51.5 | -34.1 |
②分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因
③SiCl4的空间结构为
(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如下所示,
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】硫、钒、钴、铂、镧的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:

(1)基态钒原子的电子排布式为__________ ,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是_______ .VO43—的几何构型为_________ 。
(2)2-巯基烟酸氧钒配合物(分子结构如图)是副作用小的有效调节血糖的新型药物。
①该药物中硫原子的杂化方式是_______ .所含第二周期元素第一电离能由大到小的排列顺序为_____________ 。
②2-巯基烟酸(分子结构如图)水溶性优于2-巯基烟酸氧钒配合物的原因是___________________ 。
(3)某六方硫钒化合物晶体的晶胞如图所示,该晶胞的化学式为______ 。为该晶胞俯视图,该晶胞的密度为_____ g·cm-3(NA为阿伏伽德罗常数的数值.列出计算式即可)。


(1)基态钒原子的电子排布式为
(2)2-巯基烟酸氧钒配合物(分子结构如图)是副作用小的有效调节血糖的新型药物。
①该药物中硫原子的杂化方式是
②2-巯基烟酸(分子结构如图)水溶性优于2-巯基烟酸氧钒配合物的原因是
(3)某六方硫钒化合物晶体的晶胞如图所示,该晶胞的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】硫是一种重要的非金属元素,广泛存在于自然界,回答下列问题:
(1)基态硫原子的价层电子排布图是___________ 。
(2)硫单质的一种结构为 ,S原子的杂化方式为
,S原子的杂化方式为___________ 。
(3)① 、②
、② 、③
、③ 键角由大到小的顺序是
键角由大到小的顺序是___________ 。(用序号回答即可)
(4)熔点:
___________  (填“>”或“<”)。
(填“>”或“<”)。
(5)分析并比较A: 与B:
与B: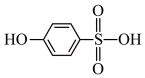 的沸点高低:
的沸点高低:___________ (用A、B表示),原因是___________ 。
(6)ZnS晶胞如图所示: 填在了
填在了 形成的
形成的___________ 空隙中。
②已知晶胞密度为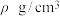 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为
,则晶胞边长为___________ cm。
(1)基态硫原子的价层电子排布图是
(2)硫单质的一种结构为
 ,S原子的杂化方式为
,S原子的杂化方式为(3)①
 、②
、② 、③
、③ 键角由大到小的顺序是
键角由大到小的顺序是(4)熔点:

 (填“>”或“<”)。
(填“>”或“<”)。(5)分析并比较A:
 与B:
与B: 的沸点高低:
的沸点高低:(6)ZnS晶胞如图所示:

 填在了
填在了 形成的
形成的②已知晶胞密度为
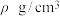 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则晶胞边长为
,则晶胞边长为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】光催化技术是一种在能源和环境领域有着重要应用前景的绿色技术。Ti的某种晶型的氧化物M可用作光催化材料。
(1)基态Ti原子的价层电子排布图为________ 。
(2)在第四周期d区元素中,与Ti 原子未成对电子数相同的元素名称是________ 。
(3)金属钛的原子堆积方式如图1所示,则金属钛晶胞俯视图为_____ 。
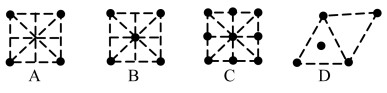
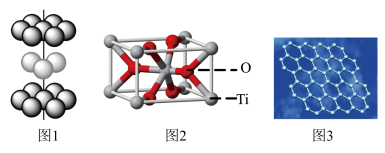
(4)生活环境中的臭气源有氨气、甲硫醇(CH3-SH) 等,M 可以作为高效除臭剂。与氨气互为等电子体的阳离子为_____ ,甲硫醇中硫原子采取的杂化方式为_____ ,与S位于同一周期,且第一电离能小于S 的非金属元素符号为______ ,已知甲硫醇熔沸点小于甲醇(CH3OH),试解释此差异的主要原因___________ 。
(5)M 的晶胞结构如图2,M 化学式为______ 。
(6)石墨烯是单个原子厚度的二维碳纳米材料( 如图3),其比表面积大( 比表面积指单位质量物料所具有的总面积)。石墨烯与M 的结合使用,极大地提高了M 的光催化效果。在石墨烯晶体中,每个最小的六元环占有____ 个C 原子。已知石墨烯中C-C 键长为a pm,则单层石墨烯的比表面积为_____ m2/g(NA表示阿伏伽德罗常数的数值,忽略碳原子的厚度)。
(1)基态Ti原子的价层电子排布图为
(2)在第四周期d区元素中,与Ti 原子未成对电子数相同的元素名称是
(3)金属钛的原子堆积方式如图1所示,则金属钛晶胞俯视图为


(4)生活环境中的臭气源有氨气、甲硫醇(CH3-SH) 等,M 可以作为高效除臭剂。与氨气互为等电子体的阳离子为
(5)M 的晶胞结构如图2,M 化学式为
(6)石墨烯是单个原子厚度的二维碳纳米材料( 如图3),其比表面积大( 比表面积指单位质量物料所具有的总面积)。石墨烯与M 的结合使用,极大地提高了M 的光催化效果。在石墨烯晶体中,每个最小的六元环占有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】硼是一种用途广泛的化工原料,目前硼的用途超过300种。试回答下列问题:
(1)双烯合成反应的催化剂配合物[Cu(CH3C≡N)4]BF4中所含N元素基态原子的电子排布图(轨道表示式)是___________ ;四种元素B、C、N、F第一电离能由大到小的顺序是___________ ;上述配合物中与Cu( I )形成配位键的原子是___________ (填元素符号) ,阴离子 的空间构型为
的空间构型为___________ 。
(2)单质硼有多种同素异形体,无定形硼为棕色粉末,晶体硼呈灰黑色。晶体硼的熔点为2300°C,沸点为2550°C,硬度大,则晶体硼的类型为___________ 晶体,区分晶体硼和无定形硼最可靠的科学方法为对固体进行___________ 。
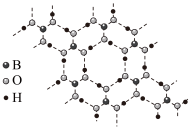
(3)硼酸(H3BO3)是一种具有片层结构的白色晶体,层与层之间存在分子间作用力,层内的H3BO3分子间通过氢键相连(如图所示)。含1molH3BO3的晶体中有___________ mol氢键。硼酸是一元弱酸,与氢氧化钠溶液反应生成Na[ B(OH)4],用“→”标出[B(OH)4]-中的配位键:___________ 。
(4)某种硼氢化镁氨合物的晶胞结构如图所示,属于立方晶系,晶胞棱边夹角均为90°,图中每个黑球代表一个八面体,其中心为金属镁原子,顶点为氨分子;每个白球代表一个四面体,其中心为硼原子,顶点为氢原子。
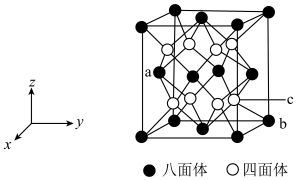
已知a点的坐标为( ,0,
,0, ) ,则c点的坐标为
) ,则c点的坐标为___________ 。该晶胞中n(Mg):n(N):n(B):n(H) =___________ 。
(1)双烯合成反应的催化剂配合物[Cu(CH3C≡N)4]BF4中所含N元素基态原子的电子排布图(轨道表示式)是
 的空间构型为
的空间构型为(2)单质硼有多种同素异形体,无定形硼为棕色粉末,晶体硼呈灰黑色。晶体硼的熔点为2300°C,沸点为2550°C,硬度大,则晶体硼的类型为
(3)硼酸(H3BO3)是一种具有片层结构的白色晶体,层与层之间存在分子间作用力,层内的H3BO3分子间通过氢键相连(如图所示)。含1molH3BO3的晶体中有

(4)某种硼氢化镁氨合物的晶胞结构如图所示,属于立方晶系,晶胞棱边夹角均为90°,图中每个黑球代表一个八面体,其中心为金属镁原子,顶点为氨分子;每个白球代表一个四面体,其中心为硼原子,顶点为氢原子。

已知a点的坐标为(
 ,0,
,0, ) ,则c点的坐标为
) ,则c点的坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】有A、B、C、D、E、F六种元素。A是宇宙中最丰富的元素;B是周期表中电负性数值最大的元素;C的基态原子中2p轨道有三个未成对的单电子;F原子核外电子数是B与C核外电子数之和;D是主族元素,且与副族元素E同周期;E能分别形成红色(或砖红色)的E2O和黑色的EO两种氧化物;D与B可形成离子化合物,其晶胞结构如右图所示。请回答下列问题。
(1)E元素原子基态时的外围电子排布式为________________ 。
(2)A2F分子中F原子的杂化类型是_____ ,F的气态氧化物FO3分子的键角为_______ 。
(3)CA3极易溶于水,其原因是____________________________________________ ,试判断CA3溶于水后,形成CA3·H2O的最合理结构为________ (选填字母)。
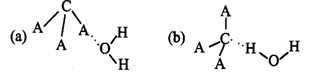
(4)从晶胞结构图中可以看出,D跟B形成的离子化合物的电子式为_______________ ;
该离子化合物晶体的密度为ρ(g·cm-3)。,则晶胞的体积是____________________________ (只要求列出算式)。

(1)E元素原子基态时的外围电子排布式为
(2)A2F分子中F原子的杂化类型是
(3)CA3极易溶于水,其原因是
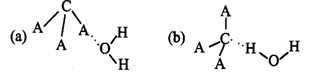
(4)从晶胞结构图中可以看出,D跟B形成的离子化合物的电子式为
该离子化合物晶体的密度为ρ(g·cm-3)。,则晶胞的体积是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】第四周期某些过渡元素在工业生产中有着极其重要的作用。
(1)铬(Cr)被称为“不锈钢的添加剂”。
①写出Cr在周期表中的位置______ ;
②其原子核外电子排布的最高能层符号是______ 。
③在lmolCrO5(其中 Cr为+6价)中,含有过氧键的数目为______ 。
(2)钒(V)是我国的丰产元素,被誉为“工业的味精”,广泛用于催化及钢铁工业。回答下列问题:
①写出基态钒原子的价电子排布图:______ 。
②V2O5常用作SO2转化为SO3的催化剂。SO3的三聚体环状结构如图1所示,该结构中S原子的杂化轨道类型为______ 。
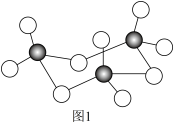

(3)镍(Ni)是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物 Ni(CO)4,其中配原子是______ (填元素符号)。
(4)钛(Ti)被称为“21世纪金属”,钙钛矿(CaTiO3)晶体是工业获取钛的重要原料,其晶胞结构如图2,晶胞参数为a=0.266 nm,晶胞中 Ti、Ca、O分别处于顶角、体心、面心位置。
①Ti与O之间的最短距离为______ nm,
②与Ti紧邻的O个数为______ 。
(1)铬(Cr)被称为“不锈钢的添加剂”。
①写出Cr在周期表中的位置
②其原子核外电子排布的最高能层符号是
③在lmolCrO5(其中 Cr为+6价)中,含有过氧键的数目为
(2)钒(V)是我国的丰产元素,被誉为“工业的味精”,广泛用于催化及钢铁工业。回答下列问题:
①写出基态钒原子的价电子排布图:
②V2O5常用作SO2转化为SO3的催化剂。SO3的三聚体环状结构如图1所示,该结构中S原子的杂化轨道类型为


(3)镍(Ni)是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物 Ni(CO)4,其中配原子是
(4)钛(Ti)被称为“21世纪金属”,钙钛矿(CaTiO3)晶体是工业获取钛的重要原料,其晶胞结构如图2,晶胞参数为a=0.266 nm,晶胞中 Ti、Ca、O分别处于顶角、体心、面心位置。
①Ti与O之间的最短距离为
②与Ti紧邻的O个数为
您最近一年使用:0次



