明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
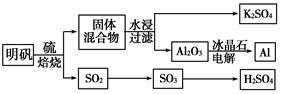
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S 2K2SO4+2Al2O3+9SO2↑+48H2O
2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是______________________ 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是__________________________ 。
(3)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是__________________________ 。

焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S
 2K2SO4+2Al2O3+9SO2↑+48H2O
2K2SO4+2Al2O3+9SO2↑+48H2O请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是
(2)从水浸后的滤液中得到K2SO4晶体的方法是
(3)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是
更新时间:2016-12-09 02:24:34
|
相似题推荐
【推荐1】近几年来关于氮污染的治理备受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示。

若NO、NO2的体积比为1∶1,写出氧化钡生成Ba(NO3)2的化学方程式:_______________________ 。从最终排放的气体来看,氮元素将_______________________ (填“被氧化”或“被还原”)。
(2)用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将_______________________ (填“增大”、“减小”或“不变”)。阳极的电极反应式为_______________________ 。

(3)汽车尾气中催化剂可将NO、CO转化成无害气体。2NO+2CO N2+2CO2 ΔH
N2+2CO2 ΔH
①ΔH=_________________ kJ/mol
②该反应的平衡常数与外界因素X[代表温度、压强、 或催化剂接触面积]的关系如图所示。X是
或催化剂接触面积]的关系如图所示。X是________________ ,能正确表达平衡常数K随X变化的曲线是________________ (填“a”或“b”)。

(4)在一定温度和催化剂作用下:8NH3(g)+8NO(g)+2NO2(g) 9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
①n=_____________________________ ;
②v(NO)=_______________ ;
③NH3的平衡转化率为_______________ 。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图所示。

若NO、NO2的体积比为1∶1,写出氧化钡生成Ba(NO3)2的化学方程式:
(2)用电解法将某工业废水中CN-转变为N2,装置如下图所示。电解过程中,阴极区电解质溶液的pH将

(3)汽车尾气中催化剂可将NO、CO转化成无害气体。2NO+2CO
 N2+2CO2 ΔH
N2+2CO2 ΔH| 化学键 | C≡O | NO中氮氧键 | N≡N | CO2中C=O键 |
| 键能(kJ/mol) | 1076 | 630 | 945 | 803 |
①ΔH=
②该反应的平衡常数与外界因素X[代表温度、压强、
 或催化剂接触面积]的关系如图所示。X是
或催化剂接触面积]的关系如图所示。X是
(4)在一定温度和催化剂作用下:8NH3(g)+8NO(g)+2NO2(g)
 9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。
9N2(g)+12H2O(g)在2L密闭容器中通入4molNH3、4molNO、nmolNO2,经10分钟达到平衡时,c(NH3)=0.5mol/L、c(NO2)=0.25mol/L。①n=
②v(NO)=
③NH3的平衡转化率为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】现代生产、生活和国防中大量使用电池。如照相机、手机、汽车、卫星等均要使用电池。了解常见电池的工作原理是中学生的必修课之一。请同学们用所学知识回答以下问题。
(1)铅蓄电池放电时的总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。请写出放电时正极反应的电极反应式:_________________________ 。
(2)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如图所示。
①请在图中标出电极材料及电解质溶液(写化学式)①___________ ,②____________ ,③_______________ ,④__________________
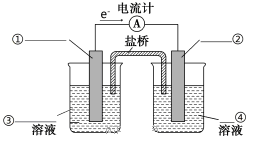
②盐桥中装有含琼胶的KCl饱和溶液,电池工作过程中盐桥中的Cl-向________ 极移动(填“左”或“右”)。
(3)燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。下图是一个化学过程的示意图。
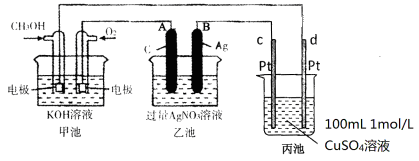
①A(石墨)电极的名称是_______________ 。
②通入CH3OH的电极的电极反应式是________________________________ 。
③乙池中反应的化学方程式为________________________________________ 。
④当电路中通过0.01mol电子时,丙池溶液的c(H+) =__________ mol/L(忽略电解过程中溶液体积的变化)。
(1)铅蓄电池放电时的总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。请写出放电时正极反应的电极反应式:
(2)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如图所示。
①请在图中标出电极材料及电解质溶液(写化学式)①

②盐桥中装有含琼胶的KCl饱和溶液,电池工作过程中盐桥中的Cl-向
(3)燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。下图是一个化学过程的示意图。

①A(石墨)电极的名称是
②通入CH3OH的电极的电极反应式是
③乙池中反应的化学方程式为
④当电路中通过0.01mol电子时,丙池溶液的c(H+) =
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】金属及其化合物在生产生活中具有广泛的应用。
(1)我国科学家设计的铝离子电池装置如图所示。已知电池总反应为nAl+4nAlCl +3(AlCl4)nMoSe2=4nAl2Cl
+3(AlCl4)nMoSe2=4nAl2Cl +3MoSe2。
+3MoSe2。
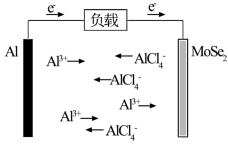
①负极材料为___ (填“A1”或“MoSe2”)。
②电池工作时能量形式由___ 转化为___ 。
③理论上生成2molAl2Cl 时,外电路转移电子的物质的量为
时,外电路转移电子的物质的量为__ mol。
(2)锂—硫电池是重要的新型储能可逆电池,其构造如图所示。
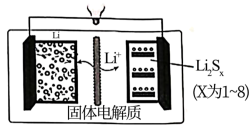
电池充电时,与电源负极所连电极发生的电极反应为___ ,在电池放电时,电池右边电极依次发生Li2S8→Li2S6→Li2S4→Li2S2→Li2S系列转化。若放电前,图右边电极中Li2Sx只有Li2S8,放电后生成产物Li2S、Li2S2物质的量之比为6:1,则1molLi2S8反应得到的电子数为__ 。
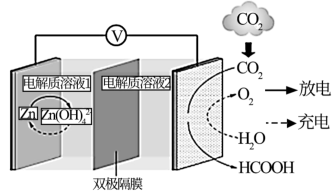
(3)一种新型Zn—CO2水介质电池示意图如图,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸(HCOOH)。充电时电池总反应为__ ;放电时1molCO2转化为HCOOH,转移的电子数为__ mol。
(1)我国科学家设计的铝离子电池装置如图所示。已知电池总反应为nAl+4nAlCl
 +3(AlCl4)nMoSe2=4nAl2Cl
+3(AlCl4)nMoSe2=4nAl2Cl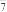 +3MoSe2。
+3MoSe2。
①负极材料为
②电池工作时能量形式由
③理论上生成2molAl2Cl
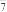 时,外电路转移电子的物质的量为
时,外电路转移电子的物质的量为(2)锂—硫电池是重要的新型储能可逆电池,其构造如图所示。

电池充电时,与电源负极所连电极发生的电极反应为

(3)一种新型Zn—CO2水介质电池示意图如图,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸(HCOOH)。充电时电池总反应为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】一种从废钴锰催化剂[含53.1%(CH3COO)2Co、13.2%(CH3COO)2Mn、23.8%CoCO3、6.5%Mn(OH)2、1.3%SO2及对二甲苯等有机物等]中回收钴和锰的工艺流程如下:

回答下列问题:
(1)步骤①焙烧的目的是_________________________________ 。
(2)步骤②酸浸时,控制盐酸适当过量、溶液加热并充分搅拌,其目的是___________ 。
(3)步骤③MnCl2与H2O2和氨水反应的离子方程式为______________________ 。
(4)步骤④调节pH时采用CH3COOH和CH3 COONa混合溶液,该混合溶液称为缓冲溶液,该溶液中加入少量的酸、碱或稀释时pH变化均不大,其中稀释时pH变化不大的原因是______________________ 。
(5)步骤⑤硝酸溶解CoS生成Co(NO3)2同时生成NO和S,该反应的化学方程式为______________________ 。
(6)步骤⑦若在实验室进行,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有___________ (填仪器名称)。
(7)某工厂用mkg废催化剂最终制得 CoO n kg,则CoO的产率为___________ 。

回答下列问题:
(1)步骤①焙烧的目的是
(2)步骤②酸浸时,控制盐酸适当过量、溶液加热并充分搅拌,其目的是
(3)步骤③MnCl2与H2O2和氨水反应的离子方程式为
(4)步骤④调节pH时采用CH3COOH和CH3 COONa混合溶液,该混合溶液称为缓冲溶液,该溶液中加入少量的酸、碱或稀释时pH变化均不大,其中稀释时pH变化不大的原因是
(5)步骤⑤硝酸溶解CoS生成Co(NO3)2同时生成NO和S,该反应的化学方程式为
(6)步骤⑦若在实验室进行,所需的硅酸盐质仪器除酒精灯和玻璃棒外,还有
(7)某工厂用mkg废催化剂最终制得 CoO n kg,则CoO的产率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐2】电镀污泥[主要含 、
、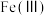 、
、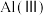 、
、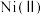 等]中铬镍资源再利用生产红矾钠(
等]中铬镍资源再利用生产红矾钠( )和粗镍,该工业流程如图。
)和粗镍,该工业流程如图。

已知:
① 、
、 、
、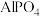 、
、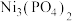 的
的 依次为
依次为 、
、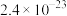 、
、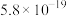 、
、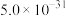 ;
;
②Cr及其化合物的性质与Al类似;
③溶液中金属离子开始沉淀、沉淀完全和沉淀开始溶解的pH如下表所示:
请回答下列问题:
(1)若污泥中Cr以 的形式存在,则“①浸出”时发生反应的化学方程式为
的形式存在,则“①浸出”时发生反应的化学方程式为___________ 。
(2)“②除杂”时,若镍离子浓度为0.05mol/L,则溶液中 浓度范围为
浓度范围为___________ mol/L。
(3)“转溶”时,氢氧化钠加入量不宜过多,其原因为___________ (用离子方程式表示)。
(4)“④氧化”步骤中包括先将 、
、 沉淀,过滤后溶液中继续加入NaOH溶液和
沉淀,过滤后溶液中继续加入NaOH溶液和 。沉淀
。沉淀 、
、 时,pH应控制的范围为
时,pH应控制的范围为___________ ,加入 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(5)操作Ⅲ为___________ 。
(6)若实验取干污泥250g,其中含Cr11.2%,实验所得晶体为59.6g,则Cr元素回收率为___________ (结果保留一位小数)。
 、
、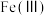 、
、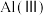 、
、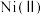 等]中铬镍资源再利用生产红矾钠(
等]中铬镍资源再利用生产红矾钠( )和粗镍,该工业流程如图。
)和粗镍,该工业流程如图。
已知:
①
 、
、 、
、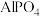 、
、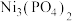 的
的 依次为
依次为 、
、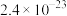 、
、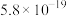 、
、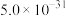 ;
;②Cr及其化合物的性质与Al类似;
③溶液中金属离子开始沉淀、沉淀完全和沉淀开始溶解的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时(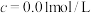 )的pH )的pH | 7.2 | 4.9 | 3.7 | 2.2 |
沉淀完全时( )的pH )的pH | 8.7 | 6.8 | 4.7 | 3.2 |
| 沉淀开始溶解的pH | ― | 12.0 | 7.8 |
(1)若污泥中Cr以
 的形式存在,则“①浸出”时发生反应的化学方程式为
的形式存在,则“①浸出”时发生反应的化学方程式为(2)“②除杂”时,若镍离子浓度为0.05mol/L,则溶液中
 浓度范围为
浓度范围为(3)“转溶”时,氢氧化钠加入量不宜过多,其原因为
(4)“④氧化”步骤中包括先将
 、
、 沉淀,过滤后溶液中继续加入NaOH溶液和
沉淀,过滤后溶液中继续加入NaOH溶液和 。沉淀
。沉淀 、
、 时,pH应控制的范围为
时,pH应控制的范围为 发生反应的离子方程式为
发生反应的离子方程式为(5)操作Ⅲ为
(6)若实验取干污泥250g,其中含Cr11.2%,实验所得晶体为59.6g,则Cr元素回收率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】重铬酸钾( )在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为
)在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为 ,还含杂质
,还含杂质 )为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
)为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
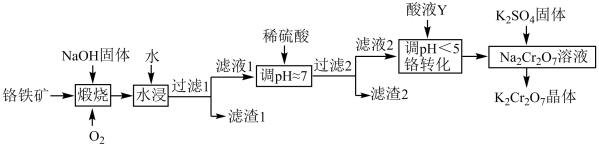
回答下列问题:
(1)基态Cr原子的未成对电子数为_______ 。二氧化硅比二氧化碳熔点高得多的最主要原因是_______ 。
(2)煅烧铬铁矿后生成 和
和 等,已知
等,已知 遇水强烈水解,生成红褐色沉淀,
遇水强烈水解,生成红褐色沉淀, 水解的离子方程式为
水解的离子方程式为_______ ;滤液1中的阴离子主要有 、
、_______ 。
(3)流程中若省去 这一操作,产品中可能含有的杂质是
这一操作,产品中可能含有的杂质是_______ 。
(4)结合离子方程式,从化学平衡移动的角度分析加入酸液Y的作用:_______ 。
(5)由于 是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含
是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含 酸性废水需要进行处理,可用焦亚硫酸钠(
酸性废水需要进行处理,可用焦亚硫酸钠( )将
)将 转化为毒性较低的
转化为毒性较低的 ,室温下再调节溶液的pH,生成
,室温下再调节溶液的pH,生成 沉淀,分离出污泥,保证废水中
沉淀,分离出污泥,保证废水中 的质量浓度小于
的质量浓度小于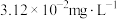 。已知室温下,
。已知室温下,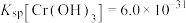 。
。
① 参加反应的离子方程式为
参加反应的离子方程式为_______ 。
②溶液的pH至少要大于_______ 。
 )在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为
)在实验室和工业中都有很广泛的应用,用于制铬矾、火柴、铬颜料、鞣革、电镀、有机合成等。以铬铁矿(主要成分可表示为 ,还含杂质
,还含杂质 )为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
)为原料制备重铬酸钾晶体(不含结晶水)的工艺流程如图所示:
回答下列问题:
(1)基态Cr原子的未成对电子数为
(2)煅烧铬铁矿后生成
 和
和 等,已知
等,已知 遇水强烈水解,生成红褐色沉淀,
遇水强烈水解,生成红褐色沉淀, 水解的离子方程式为
水解的离子方程式为 、
、(3)流程中若省去
 这一操作,产品中可能含有的杂质是
这一操作,产品中可能含有的杂质是(4)结合离子方程式,从化学平衡移动的角度分析加入酸液Y的作用:
(5)由于
 是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含
是一种有毒且有致癌性的强氧化剂,它被国际癌症研究机构划归为第一类致癌物质。排出的含 酸性废水需要进行处理,可用焦亚硫酸钠(
酸性废水需要进行处理,可用焦亚硫酸钠( )将
)将 转化为毒性较低的
转化为毒性较低的 ,室温下再调节溶液的pH,生成
,室温下再调节溶液的pH,生成 沉淀,分离出污泥,保证废水中
沉淀,分离出污泥,保证废水中 的质量浓度小于
的质量浓度小于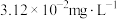 。已知室温下,
。已知室温下,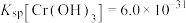 。
。①
 参加反应的离子方程式为
参加反应的离子方程式为②溶液的pH至少要大于
您最近一年使用:0次



