某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是(提示BaSO4(s)⇌Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),Ksp称为溶度积常数。)
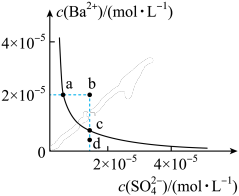

| A.加入Na2SO4可以使溶液由a 点变到b 点 |
| B.通过蒸发可以使溶液由d 点变到c 点 |
| C.d 点无BaSO4沉淀生成 |
| D.a点对应的Ksp大于c点对应的Ksp |
2008·山东·高考真题 查看更多[23]
重庆市巫山县官渡中学2021-2022学年高二下学期第二次月考化学试题河北省安平中学2019-2020学年高二上学期第四次月考化学试题甘肃省玉门市油田第一中学2020-2021学年高二上学期期末考试化学试题黑龙江省大兴安岭呼玛县高级中学2020-2021学年高二上学期第三次月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 沉淀溶解平衡及其影响因素(强化练习)辽宁省沈阳市第一七O中学2019-2020学年高二上学期第二次月考化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高二上学期期中考试化学试题2黑龙江省绥芬河市高级中学2018-2019学年高二上学期期中考试化学试题云南省楚雄州2016-2017学年高二下学期期末考试化学试题河北省邢台市第一中学2017-2018学年高二上学期第一次月考化学试题(已下线)2014年高二化学人教版选修四 17难溶电解质的溶解平衡练习卷(已下线)2011-2012学年山东省临沂市高二上学期期末模块质量调研化学试卷2016-2017学年宁夏育才中学高二上月考二化学卷2(已下线)2010年湖北省襄樊市四校联考-高二上学期期中考试化学卷2015-2016学年湖北省宜昌金东方高级中学高二上学期期末化学试卷2008年普通高等学校招生统一考试理综试题化学部分(山东卷)2015-2016学年宁夏育才中学高二上期末考试化学试卷(已下线)2012-2013学年四川省资阳市高二下学期期末检测化学试卷(已下线)2012-2013学年山东省临沂市重点高中高二上学期期末考试化学试卷(已下线)2011-2012学年海南省洋浦中学高二下学期期末考试化学试卷湖北省宜昌市部分示范高中教学协作体2016-2017学年高二下学期期中考试化学试题湖北省宜昌市示范高中协作体2016-2017学年高二下学期期中考试化学试题2016-2017学年福建省漳州市第一中学高二上学期期末考试化学试卷
更新时间:2019-01-30 18:14:09
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】常温下,往5mL蒸馏水中加入一定量的 固体后,再加入
固体后,再加入 溶液,测得
溶液,测得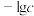 ~进程曲线如图所示,下列说法错误的是
~进程曲线如图所示,下列说法错误的是

 固体后,再加入
固体后,再加入 溶液,测得
溶液,测得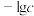 ~进程曲线如图所示,下列说法错误的是
~进程曲线如图所示,下列说法错误的是
A.加入 固体存在沉淀溶解平衡,使得 固体存在沉淀溶解平衡,使得 减少 减少 |
B.加入 溶液后, 溶液后,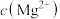 增大,存在沉淀的转化 增大,存在沉淀的转化 |
C.加入 溶液后, 溶液后, 增大, 增大,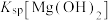 不变 不变 |
D.若增加 溶液的用量,最终pH会大于5 溶液的用量,最终pH会大于5 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】25℃时,Ag2CO3在水中的沉淀溶解平衡曲线如右图所示(已知Ksp(AgCl)=1.8×10-10),下列说法正确的是
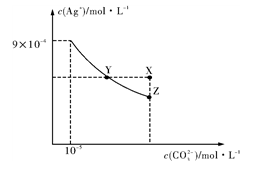
| A.根据图示可计算出Ksp(Ag2CO3)=9×10-9 |
| B.向Ag2CO3饱和溶液中加入K2CO3饱和溶液,可以使Y点移到X点 |
C.反应Ag2CO3(s)+2Cl-(aq) 2AgCl(s)+CO32-(aq)化学平衡常数K=2.5×108 2AgCl(s)+CO32-(aq)化学平衡常数K=2.5×108 |
| D.在0.001mol/LAgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】2023年4月《中华人民共和国黄河保护法》正式实施,保护黄河健康是生态保护事业的重要使命。下列有关说法错误的是
| A.冬春季节冰凌漂浮在黄河水面上与氢键的形成有关 |
B.使用FeS固体除去工业污水中 、 、 等重金属离子,减少对黄河水污染 等重金属离子,减少对黄河水污染 |
| C.水厂处理黄河水制取自来水,可用明矾消毒 |
D.黄河口大闸蟹配食醋味更美,1mol 含有4mol H 含有4mol H |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列用于解释事实的方程式书写不正确的是
| A.某家用管道疏通剂(含铝粒和苛性钠)疏通管道:Al3++3OH-=Al(OH)3↓ |
B.铁盐可作净水剂: |
C.向重铬酸钾溶液中滴加少量浓硫酸,溶液橙色加深: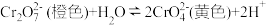 |
D.用饱和碳酸钠溶液处理水垢中的硫酸钙: |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列实验操作和现象均正确,且能推出相应结论的是
选项 | 实验操作 | 现象 | 结论 |
A | 向浓度均为 的 的 、 、 混合溶液中逐滴加入氨水 混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 |  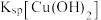 |
B | 常温下,将 、 、 与 与 溶液组成原电池 溶液组成原电池 | 电流计指针偏转, 电极上有气泡产生 电极上有气泡产生 |  金属活动性强于 金属活动性强于 |
C | 室温下,用 计测得同浓度 计测得同浓度 、 、 溶液的pH 溶液的pH |  溶液的 溶液的 大于 大于 溶液的 溶液的 |  结合质子的能力比 结合质子的能力比 的强 的强 |
D | 分别向盛有 醋酸和饱和硼酸溶液的试管中滴加等浓度 醋酸和饱和硼酸溶液的试管中滴加等浓度 溶液 溶液 | 前者产生无色气泡,后者无明显现象 | 酸性:醋酸>碳酸>硼酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
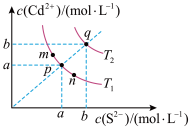
【推荐2】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示(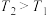 )。下列说法错误的是
)。下列说法错误的是
 )。下列说法错误的是
)。下列说法错误的是
A.图中a和b分别为 、 、 温度下CdS在水中的物质的量浓度 温度下CdS在水中的物质的量浓度 |
B.图中各点对应的 的关系为: 的关系为: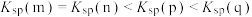 |
C.向m点的溶液中加入少量 固体,溶液组成由m沿mpn线向p方向移动 固体,溶液组成由m沿mpn线向p方向移动 |
| D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】下列实验操作、实验现象和实验结论均正确的是
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向一定浓度CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S酸性比H2SO4强 |
| B | 测定等浓度的NaClO溶液和Na2SO3溶液的pH | 前者的pH比后者的大 | 非金属性:S>Cl |
| C | 2mL0.1mol·L-1MgCl2溶液中滴加2滴1mol·L-1NaOH溶液,再滴加2滴0.1mol·L-1FeCl3溶液 | 先生成白色沉淀,后生成红褐色沉淀 | Ksp[Mg(OH)2]>|Ksp[Fe(OH)3] |
| D | 向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,振荡后加入几滴有机物Ⅹ溶液,加热 | 未出现砖红色沉淀 | Ⅹ不可能是葡萄糖 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次


 是常见难溶物,将过量硫化锌粉末置于水中达到溶解平衡:
是常见难溶物,将过量硫化锌粉末置于水中达到溶解平衡: {已知
{已知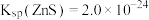 ,
, ,
, ,
, 的电离常数
的电离常数 ,
, },下列有关说法
},下列有关说法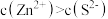
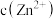 保持不变
保持不变 的沉淀转化平衡常数
的沉淀转化平衡常数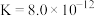 ,无法实现有效转化
,无法实现有效转化 形式存在
形式存在

