下图为一些常见物质的转化关系图(部分反应物与生成物未标出)。A、C、E、G为单质,其中A、C、G为金属,E为气体。B为常见无色液体,L为红褐色固体,I的焰色反应呈紫色。常温下A、G投入J的浓溶液无明显现象,K是反应①所得溶液中的唯一溶质。
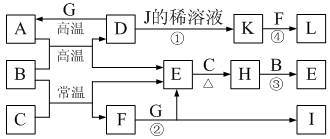
⑴A在元素周期表中的位置为_______ ,H的电子式为________ 。
⑵写出有关反应的离子方程式:
反应①的离子方程式为__________ 。
反应②的离子方程式为__________ 。
⑶反应③中每生成1 mol E,转移电子的物质的量为__________ 。

⑴A在元素周期表中的位置为
⑵写出有关反应的离子方程式:
反应①的离子方程式为
反应②的离子方程式为
⑶反应③中每生成1 mol E,转移电子的物质的量为
9-10高二下·江苏·期末 查看更多[1]
(已下线)09-10年如皋市高二下学期期末考试化学卷
更新时间:2016-12-09 00:45:40
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】从铜氨废液{含[Cu(NH3)3•CO]+、[Cu(NH3)2]+、[Cu(NH3)4]2+、NH3、CH3COO-、CO 等}中回收铜的工艺流程如图。
等}中回收铜的工艺流程如图。
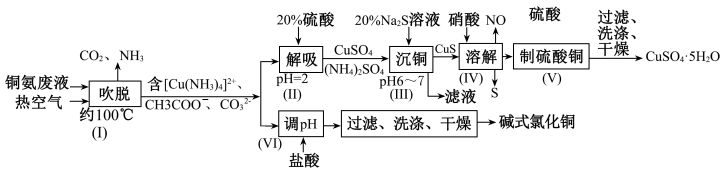
(1)步骤(I)“吹脱”的目的是____ 。(写一条即可);由步骤(II)可确定NH3与H+的结合能力比与Cu2+的____ (填“强”或“弱)。
(2)步骤(III)“沉铜”时,Na2S的用量比理论用量多,目的是____ 。
(3)步骤(IV)反应中,氧化产物与还原产物的物质的量之比为____ 。
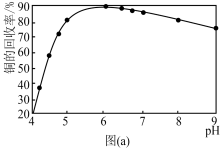
(4)步骤(VI)发生反应生成难溶Cu2(OH)3Cl的离子方程式为____ ,pH与铜的回收率关系如图(a)所示,为尽可能提高铜的回收率,需控制的pH约为____ 。
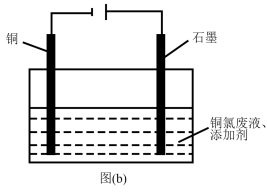
(5)“吹脱”后的铜氨废液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生反应的电极反应式为____ ;添加NaCl和H2SO4均可提高电导率和电流效率,从而提高铜的回收率。从环境角度考虑,较好的是____ (填“NaCl”或“H2SO4”)。
 等}中回收铜的工艺流程如图。
等}中回收铜的工艺流程如图。
(1)步骤(I)“吹脱”的目的是
(2)步骤(III)“沉铜”时,Na2S的用量比理论用量多,目的是
(3)步骤(IV)反应中,氧化产物与还原产物的物质的量之比为
(4)步骤(VI)发生反应生成难溶Cu2(OH)3Cl的离子方程式为

(5)“吹脱”后的铜氨废液中加入适量的添加剂可直接电解回收金属铜,装置如图(b)所示,阴极主要发生反应的电极反应式为

您最近一年使用:0次
【推荐2】铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1 857 ℃。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:
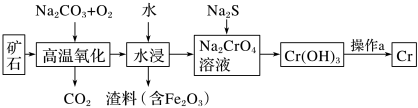
①Fe(CrO2)2中各元素化合价均为整数,则铬为__ 价。
②高温氧化时反应的化学方程式为________ 。
③操作a由两种均发生了化学反应的过程构成,其内容分别是___ 、铝热反应。
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式______ 、______ 。
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含CrO 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
①写出CrO 在酸性条件下被Fe2+还原为Cr3+的离子方程式:
在酸性条件下被Fe2+还原为Cr3+的离子方程式:_______ 。
②若处理含1 mol CrO (不考虑其他含铬微粒)的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为_______ 。
(1)工业上以铬铁矿[主要成分是Fe(CrO2)2]为原料冶炼铬的流程如图所示:

①Fe(CrO2)2中各元素化合价均为整数,则铬为
②高温氧化时反应的化学方程式为
③操作a由两种均发生了化学反应的过程构成,其内容分别是
(2)Cr(OH)3是两性氢氧化物,请写出其分别与NaOH、稀硫酸反应时生成的两种盐的化学式
(3)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(CrxFeyOz):先向含CrO
 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分Fe2+)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出CrO
 在酸性条件下被Fe2+还原为Cr3+的离子方程式:
在酸性条件下被Fe2+还原为Cr3+的离子方程式:②若处理含1 mol CrO
 (不考虑其他含铬微粒)的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为
(不考虑其他含铬微粒)的污水时恰好消耗10 mol FeSO4,则当铁铬氧体中n(Fe2+)∶n(Fe3+)=3∶2时,铁铬氧体的化学式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】浓硝酸在工业生产中有着举足轻重的作用,某化学学习小组开展与浓硝酸有关的实验。Ⅰ.首先采用图装置对浓硝酸与木炭的反应进行探究。请回答下列问题:

(1)a装置名称为______ 。检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,立即放入该装置,滴加浓硝酸可观察到其中气体的颜色为______ ,反应的化学方程式是____________________ 。
(2)C中盛有足量淀粉-KI溶液,反应一段时间后可观察到C中的现象为______ 。
(3)B的作用是____________________ 。
Ⅱ.其次,他们测得铁与不同浓度硝酸反应时各还原产物的物质的量相对含量与硝酸溶液浓度的关系如图所示:

(4)下列说法正确的是______ (填序号)。
A.硝酸的浓度越大,其还原产物中高价态的N元素成分越多
B.硝酸与铁反应往往同时生成多种还原产物
C.铁能与大于12.2 mol/L HNO3溶液反应说明不存在“钝化”现象
(5)在上述反应条件下,反应后铁以 形式存在于溶液中。当硝酸浓度为9.75 mol/L时,如果生成的还原产物为1 mol,那么转移的电子的物质的量是
形式存在于溶液中。当硝酸浓度为9.75 mol/L时,如果生成的还原产物为1 mol,那么转移的电子的物质的量是______ 。

(1)a装置名称为
(2)C中盛有足量淀粉-KI溶液,反应一段时间后可观察到C中的现象为
(3)B的作用是
Ⅱ.其次,他们测得铁与不同浓度硝酸反应时各还原产物的物质的量相对含量与硝酸溶液浓度的关系如图所示:

(4)下列说法正确的是
A.硝酸的浓度越大,其还原产物中高价态的N元素成分越多
B.硝酸与铁反应往往同时生成多种还原产物
C.铁能与大于12.2 mol/L HNO3溶液反应说明不存在“钝化”现象
(5)在上述反应条件下,反应后铁以
 形式存在于溶液中。当硝酸浓度为9.75 mol/L时,如果生成的还原产物为1 mol,那么转移的电子的物质的量是
形式存在于溶液中。当硝酸浓度为9.75 mol/L时,如果生成的还原产物为1 mol,那么转移的电子的物质的量是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】下列物质之间有如下反应关系,已知E在空气里可以转化成C。
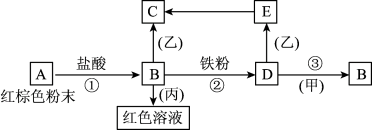
(1)写出下列物质的化学式:A___________ ;D___________ ;甲___________ ;丙___________ ;
(2)写出E→C的化学反应方程式:___________ 。写出D→B的离子反应方程式:___________ 。
(3)E在空气里转化成C的现象是___________ 。

(1)写出下列物质的化学式:A
(2)写出E→C的化学反应方程式:
(3)E在空气里转化成C的现象是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】下图是中学常见物质间的转化关系。已知:
a.A为淡黄色固体,B为导致“温室效应”的主要物质;
b.E为常见金属,J为红褐色沉淀;
c.G在实验室中常用于检验B的存在;
d.L是一种重要的工业原料,常用于制造炸药,浓溶液常呈黄色。
回答下列问题:

(1)A的电子式____________ 。
(2)反应①的化学方程式为___________ ,反应②的离子方程式为______________ ,
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为__________ L。
a.A为淡黄色固体,B为导致“温室效应”的主要物质;
b.E为常见金属,J为红褐色沉淀;
c.G在实验室中常用于检验B的存在;
d.L是一种重要的工业原料,常用于制造炸药,浓溶液常呈黄色。
回答下列问题:

(1)A的电子式
(2)反应①的化学方程式为
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示。
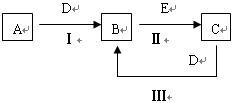
(1)若A是能使湿润的红色试纸变蓝的气体;C、D均为空气的主要成分,E是一种无色无味的有毒气体。①写出E的化学式_______ ;
②写出反应Ⅰ的化学方程式_______ 。
(2)若A是淡黄色化合物;常温下D是无色气体;C中含有的阴、阳离子均为10电子粒子
①写出A的电子式_______
②写出反应Ⅱ的化学方程式_______
(3)若A是地壳中含量最多的金属,B在火焰上灼烧时火焰呈黄色,B与C中均含有A元素,且B与C在溶液中混合时能生成白色沉淀
①写出B的化学式_______
②写出反应Ⅲ的离子方程式_______
(4)若A是黑色粉末,常温下B是黄绿色气体,C溶液呈碱性,有漂白性。写出反应Ⅲ的离子方程式_______ ;

(1)若A是能使湿润的红色试纸变蓝的气体;C、D均为空气的主要成分,E是一种无色无味的有毒气体。①写出E的化学式
②写出反应Ⅰ的化学方程式
(2)若A是淡黄色化合物;常温下D是无色气体;C中含有的阴、阳离子均为10电子粒子
①写出A的电子式
②写出反应Ⅱ的化学方程式
(3)若A是地壳中含量最多的金属,B在火焰上灼烧时火焰呈黄色,B与C中均含有A元素,且B与C在溶液中混合时能生成白色沉淀
①写出B的化学式
②写出反应Ⅲ的离子方程式
(4)若A是黑色粉末,常温下B是黄绿色气体,C溶液呈碱性,有漂白性。写出反应Ⅲ的离子方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】下列转化中,A和C均为单质,其中A为常见金属,C为气体,常温下B为液体(部分产物省略)。
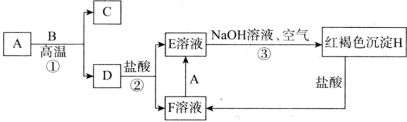
回答下列问题:
(1)A的化学式为___________ ,D的俗名为___________ 。
(2)上述反应①、②、③中属于氧化还原反应的是___________ (填序号)。
(3)反应①的化学方程式为___________ 。
(4)③的反应过程中的实验现象为___________ 。
(5)除去F溶液中混有的少量E的离子方程式为___________ 。

回答下列问题:
(1)A的化学式为
(2)上述反应①、②、③中属于氧化还原反应的是
(3)反应①的化学方程式为
(4)③的反应过程中的实验现象为
(5)除去F溶液中混有的少量E的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】已知有以下物质相互转化
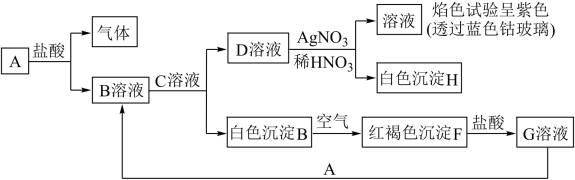
试回答:
(1)写出E的化学式___ ,H的化学式___ 。
(2)写出由E转变成F的化学方程式____ 。
(3)检验G溶液中的金属阳离子的方法是___ ;向G溶液加入A的有关离子反应方程式___ 。
(4)写出A在一定条件下与水反应的化学方程式___ 。

试回答:
(1)写出E的化学式
(2)写出由E转变成F的化学方程式
(3)检验G溶液中的金属阳离子的方法是
(4)写出A在一定条件下与水反应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙____________ 、丙____________ 、F___________
(2)写出下列反应的化学方程式或离子方程式:
①金属A和水反应的离子方程式___________
②物质E和金属B反应的离子方程式__________________
③物质D和G反应的化学方程式____________

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙
(2)写出下列反应的化学方程式或离子方程式:
①金属A和水反应的离子方程式
②物质E和金属B反应的离子方程式
③物质D和G反应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】下表为长式周期表的一部分,其中的序号代表对应的元素。
(1)写出上表中元素⑨的三价离子的结构示意图_______ 。
(2)元素⑩的晶体中原子堆积方式是_______ ,晶体中原子的空间利用率是_______
(3)元素②的第二电离能_______ Na(填写“>”“=”或“<”)的第二电离能;元素⑨的氧化物MXO晶体晶胞结构为NaCl型,由于晶体缺陷,x值为0.88,若晶体中的M分别为M2﹢、M3﹢,此晶体中M2﹢与M3﹢的最简整数比为_______
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是_______ 。
(5)用惰性电极电解足量的由元素⑦与元素⑧形成的化合物的水溶液,写出电解反应的离子方程式为_______ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | |||||||||||||
| ⑦ | ⑧ | ||||||||||||||||
| ⑨ | ⑩ |
(2)元素⑩的晶体中原子堆积方式是
(3)元素②的第二电离能
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是
(5)用惰性电极电解足量的由元素⑦与元素⑧形成的化合物的水溶液,写出电解反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】下表为元素周期表的一部分,请参照元素①-⑩在表中的位置,回答下列问题:
(1)自然界物质种类最多的元素在周期表中的位置是_____________________
(2)⑧⑨⑩的离子半径由大到小的顺序为_________ (填化学用语)。
(3)写出由⑥、⑧、⑩元素形成的一种离子化合物的电子式_____________________
(4)②的最高价氧化物对应的水化物与盐酸反应的离子方程式____________________
(5)根据斜线性质相似规则,③的氧化物,氢氧化物有两性,写出③的单质与⑧的最高价氧化物的水化物反应的化学方程式___________________________
(6)已知W+X=Y+Z,W、X、Y、Z分别是由①⑤⑥三种元素形成的四种十电子粒子,
写出该反应式__________________________
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
| 3 | ⑧ | ⑨ | ⑩ |
(2)⑧⑨⑩的离子半径由大到小的顺序为
(3)写出由⑥、⑧、⑩元素形成的一种离子化合物的电子式
(4)②的最高价氧化物对应的水化物与盐酸反应的离子方程式
(5)根据斜线性质相似规则,③的氧化物,氢氧化物有两性,写出③的单质与⑧的最高价氧化物的水化物反应的化学方程式
(6)已知W+X=Y+Z,W、X、Y、Z分别是由①⑤⑥三种元素形成的四种十电子粒子,
写出该反应式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】下表为元素周期表的一部分,请回答有关问题

(1)⑤和⑧的元素符号是_______ 和_______ 。
(2)表中最活泼的金属元素是___________ ,形成化合物种类最多的元素是_________ (填写元素名称)。
(3)表中能形成两性氢氧化物的元素是___________ ,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:__________________ ;__________________ 。
(4)证明元素⑥、⑦非金属性强弱,用一个化学方程式表示:_________________________ 。

(1)⑤和⑧的元素符号是
(2)表中最活泼的金属元素是
(3)表中能形成两性氢氧化物的元素是
(4)证明元素⑥、⑦非金属性强弱,用一个化学方程式表示:
您最近一年使用:0次



