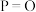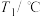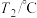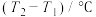红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
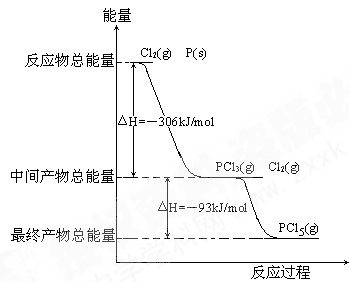
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式______________________________ 。
(2)PCl5分解成PCl3和Cl2的热化学方程式______________________________ ,上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80molPCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1[分解率即分解量除起始量]等于___________ ;。
(3)P和Cl2分两步反应生成1molPCl5的△H3=_________ ,P和Cl2一步反应生成1molPCl5的△H4______ △H3(填“大于”、“小于”或“等于”)。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_____________ 。

根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式
(2)PCl5分解成PCl3和Cl2的热化学方程式
(3)P和Cl2分两步反应生成1molPCl5的△H3=
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
10-11高二上·福建厦门·阶段练习 查看更多[1]
(已下线)2010年福建省厦门市杏南中学高二上学期10月月考理科化学卷
更新时间:2010-11-09 15:31:12
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】CO2的捕捉、封存与再利用是实现温室气体减排的重要途径之一。请回答:
(1)二氧化碳的电子式为__________ 。
(2)一种正在开发的利用二氧化碳制取甲酸(HCOOH)的途径如图所示,图中能量主要转化方式为_____________ ,CO2和H2O转化为甲酸的化学方程式为____________ 。

(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。
①恒容容器中,能加快该反应速率的是_______ 。
a.升高温度 b.从体系中分离出CH3OH c.加入高效催化剂 d.降低压强
②在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2的物质的量随时间变化如图所示。从反应开始到5min末,用H2浓度变化表示的平均反应速率________________ 。
③在相同温度、恒容的条件下,能说明该反应已达平衡状态的是_______ (填序号)。
a.CO2、H2、CH3OH、H2O的浓度均不再改变化
b.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
c.容器中混合气体的密度不变
d.v消耗(H2)=3v消耗(CH3OH)
e.体系压强不变
(4)下列一些共价键的键能如下表所示:
反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),______ (填“吸收”或“放出”) 的热量为_____ kJ
(1)二氧化碳的电子式为
(2)一种正在开发的利用二氧化碳制取甲酸(HCOOH)的途径如图所示,图中能量主要转化方式为

(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。
①恒容容器中,能加快该反应速率的是
a.升高温度 b.从体系中分离出CH3OH c.加入高效催化剂 d.降低压强
②在体积为2L的密闭容器中,充入1molCO2和3molH2,测得CO2的物质的量随时间变化如图所示。从反应开始到5min末,用H2浓度变化表示的平均反应速率
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
③在相同温度、恒容的条件下,能说明该反应已达平衡状态的是
a.CO2、H2、CH3OH、H2O的浓度均不再改变化
b.n(CO2):n(H2):n(CH3OH):n(H2O)=1:1:1:1
c.容器中混合气体的密度不变
d.v消耗(H2)=3v消耗(CH3OH)
e.体系压强不变
(4)下列一些共价键的键能如下表所示:
| 化学键 | H-H | H-O | C=O | C-H | C-O |
| 键能kJ/mol | 436 | 463 | 803 | 414 | 326 |
反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】合成氨是人类科学技术上的一项重大突破,对社会发展与进步作出了巨大贡献。
(1)450℃时,在一个体积为2L的恒容密闭容器中充入0.4 mol N2和0.6 mol H2(10min时改变某一条件),测得反应过程中N2、H2和NH3的物质的量随时间变化如下表:
①5~10 min内,生成NH3的平均反应速率是_______ mol/(L·min)。
②下列能作为判断该反应达到化学平衡状态的依据是_______ (填字母序号)。
A.v(N2)正=3v(H2)逆 B.容器内压强保持不变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子量不变
③第10 min时改变的条件是使用了高效催化剂,理由是_______ 。
(2)合成氨的反应原理为:N2(g)+3H2(g) 2NH3(g) ΔH。
2NH3(g) ΔH。
相关化学键键能数据如下:
由此计算ΔH=_______ kJ/mol,低温下,合成氨反应_______ (填“能”或“不能”)自发进行。已知合成氨反应N2(g)+3H2(g) 2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)
2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g) N2(g)+3H2(g)的活化能Ea2=
N2(g)+3H2(g)的活化能Ea2=_______ kJ/mol。
(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应Ⅰ:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H =﹣906kJ/mol
4NO(g)+6H2O(g) △H =﹣906kJ/mol
反应II:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) △H =﹣1267kJ/mol
2N2(g)+6H2O(g) △H =﹣1267kJ/mol
①该条件下,N2(g)+O2(g) 2NO(g) △H =
2NO(g) △H = _______ kJ/mol
②为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol NH3和2 mol O2,测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应_______ (填“反应Ⅰ”或“反应II”)。520℃时,反应Ⅰ的平衡常数K=_______ (只列算式不计算)。
(1)450℃时,在一个体积为2L的恒容密闭容器中充入0.4 mol N2和0.6 mol H2(10min时改变某一条件),测得反应过程中N2、H2和NH3的物质的量随时间变化如下表:
| 时间 物质的量 | 5 min | 10 min | 15 min | 20 min | 25 min |
| n(N2)/mol | 0.36 | 0.35 | 0.275 | 0.25 | 0.25 |
| n(H2)/mol | 0.48 | 0.45 | 0.225 | 0.15 | 0.15 |
| n(NH3)/mol | 0.08 | 0.1 | 0.25 | 0.30 | 0.30 |
①5~10 min内,生成NH3的平均反应速率是
②下列能作为判断该反应达到化学平衡状态的依据是
A.v(N2)正=3v(H2)逆 B.容器内压强保持不变
C.容器内混合气体的密度保持不变 D.容器内混合气体的平均相对分子量不变
③第10 min时改变的条件是使用了高效催化剂,理由是
(2)合成氨的反应原理为:N2(g)+3H2(g)
 2NH3(g) ΔH。
2NH3(g) ΔH。相关化学键键能数据如下:
| 化学键 | H—H | N≡N | N—H |
| E /(kJ/mol) | 436 | 946 | 391 |
由此计算ΔH=
 2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g)
2NH3(g)的活化能Ea1=499kJ/mol,由此计算氨分解反应2NH3(g) N2(g)+3H2(g)的活化能Ea2=
N2(g)+3H2(g)的活化能Ea2=(3)已知:氨在某催化剂催化氧化过程中主要有以下两个竞争反应:
反应Ⅰ:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H =﹣906kJ/mol
4NO(g)+6H2O(g) △H =﹣906kJ/mol反应II:4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H =﹣1267kJ/mol
2N2(g)+6H2O(g) △H =﹣1267kJ/mol①该条件下,N2(g)+O2(g)
 2NO(g) △H =
2NO(g) △H = ②为分析催化剂对反应的选择性,在1 L密闭容器中充入1 mol NH3和2 mol O2,测得有关物质的物质的量随温度变化如图所示。

该催化剂在较低温度时主要选择反应
您最近一年使用:0次
【推荐3】已知氢气的燃烧热为285 kJ·mol−1,氨气在氧气中燃烧的热化学方程式为:4NH3(g) + 3O2(g)  2N2(g) + 6H2O(l) ΔH = -1526 kJ·mol−1
2N2(g) + 6H2O(l) ΔH = -1526 kJ·mol−1
回答下列问题:
(1)写出表示氢气燃烧热的热化学方程式_______ ,氢气作为未来理想燃料的优点是_______ 。
(2)根据上述信息可知:N2(g) + 3H2(g) 2NH3(g) ΔH =
2NH3(g) ΔH =_______ ,若H-H的键能为436 kJ·mol−1,N-H的键能为400 kJ·mol−1,则N≡N的键能为_______ kJ·mol−1。
(3)工业上,合成氨反应在催化剂表面的变化如图所示,下列说法错误的是_______(填标号)。
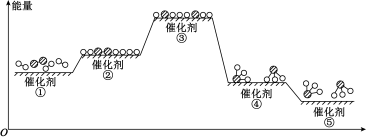
 2N2(g) + 6H2O(l) ΔH = -1526 kJ·mol−1
2N2(g) + 6H2O(l) ΔH = -1526 kJ·mol−1回答下列问题:
(1)写出表示氢气燃烧热的热化学方程式
(2)根据上述信息可知:N2(g) + 3H2(g)
 2NH3(g) ΔH =
2NH3(g) ΔH =(3)工业上,合成氨反应在催化剂表面的变化如图所示,下列说法错误的是_______(填标号)。

| A.①→②表示催化剂的吸附过程,该过程吸收能量 |
| B.②→③→④的过程中有非极性键的断裂和形成 |
| C.合成氨反应正反应的活化能小于逆反应的活化能 |
| D.过程⑤中有化学键的断裂 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】请根据所学化学反应原理,解决以下问题:
(1)依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s) 设计的原电池,可以提供稳定的电流.装置如图所示,其中盐桥中装有琼脂-饱和KCl溶液.

回答下列问题:
①电极X的材料和电解质溶液Y分别为________ 、________ ;
②盐桥中K+移向________ (填A或B);
③银电极发生的电极反应为________ ;
④用此做电源电解硝酸银溶液(用碳棒做电极)的化学方程式为________ ;
(2)已知25℃、101kPa时,16.0g气态肼(N2H4)在氧气中完全燃烧生成氮气和水,放出热量312kJ,则该热化学反应方程式________ ;
(3)已知:C(s)+O2(g)═CO2(g)△H1=-396.5kJ•mol-1;
H2(g)+ O2═H2O(g)△H2=-241.8kJ•mol-1;
O2═H2O(g)△H2=-241.8kJ•mol-1;
CO(g)+ O2(g)═CO2(g)△H3=-283.0kJ•mol-1.
O2(g)═CO2(g)△H3=-283.0kJ•mol-1.
根据盖斯定律写出单质碳和水蒸气生成水煤气的热化学方程式:________ 。
(1)依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s) 设计的原电池,可以提供稳定的电流.装置如图所示,其中盐桥中装有琼脂-饱和KCl溶液.

回答下列问题:
①电极X的材料和电解质溶液Y分别为
②盐桥中K+移向
③银电极发生的电极反应为
④用此做电源电解硝酸银溶液(用碳棒做电极)的化学方程式为
(2)已知25℃、101kPa时,16.0g气态肼(N2H4)在氧气中完全燃烧生成氮气和水,放出热量312kJ,则该热化学反应方程式
(3)已知:C(s)+O2(g)═CO2(g)△H1=-396.5kJ•mol-1;
H2(g)+
 O2═H2O(g)△H2=-241.8kJ•mol-1;
O2═H2O(g)△H2=-241.8kJ•mol-1;CO(g)+
 O2(g)═CO2(g)△H3=-283.0kJ•mol-1.
O2(g)═CO2(g)△H3=-283.0kJ•mol-1.根据盖斯定律写出单质碳和水蒸气生成水煤气的热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。______ 。
②中和热测定时采用稍过量的氢氧化钠的原因:______ 。
③测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ/mol)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是______ (填字母)。
A.实验装置保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.一次就把NaOH溶液全倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和反应的中和热的数值与57.3kJ•mol-1相比较会______ (填“偏大”“偏小”或“无影响”)。
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如图:
反应Ⅲ:S(s)+O2(g)=SO2(g) △H3=-297kJ•mol-1
反应Ⅱ的热化学方程式:_____ 。
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据:
则N2(g)+3H2(g) 2NH3(g) △H=
2NH3(g) △H=______ kJ•mol-1(用小写字母表示)。
(4)一定条件下,在水溶液均为1mol以下离子Cl-、ClO-、ClO 、ClO
、ClO 、ClO
、ClO 的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO
的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO +2Cl-(aq)的△H=
+2Cl-(aq)的△H=______ kJ•mol-1。

②中和热测定时采用稍过量的氢氧化钠的原因:
③测定稀硫酸和稀氢氧化钠中和热(中和热为57.3kJ/mol)的实验装置如图所示。某兴趣小组的实验数值结果小于57.3kJ/mol原因可能是
A.实验装置保温、隔热效果差
B.读取混合液的最高温度记为终点温度
C.一次就把NaOH溶液全倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后未洗涤,直接测定H2SO4溶液的温度
④用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和反应的中和热的数值与57.3kJ•mol-1相比较会
(2)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如图:

反应Ⅲ:S(s)+O2(g)=SO2(g) △H3=-297kJ•mol-1
反应Ⅱ的热化学方程式:
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据:
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | a | b | c |
 2NH3(g) △H=
2NH3(g) △H=(4)一定条件下,在水溶液均为1mol以下离子Cl-、ClO-、ClO
 、ClO
、ClO 、ClO
、ClO 的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO
的能量(kJ)相对大小如图所示,则3ClO-(aq)=ClO +2Cl-(aq)的△H=
+2Cl-(aq)的△H=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】中国长征系列火箭常用偏二甲肼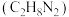 、液态氢等作为燃料,液态氧、四氧化二氮
、液态氢等作为燃料,液态氧、四氧化二氮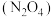 等作为助燃剂。火箭某一级发射使用的燃料是偏二甲肼
等作为助燃剂。火箭某一级发射使用的燃料是偏二甲肼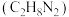 和四氧化二氮组合。
和四氧化二氮组合。
(1)已知:1.5g偏二甲肼(液态)完全燃烧生成液态水放出50kJ热量。则偏二甲肼的摩尔燃烧焓为______ ,请写出其中表示偏二甲肼燃烧摩尔焓的热化学方程式:__________________ 。
(2)运载火箭的第三级使用的推进剂是液氢和液氧。
已知下列在298K时的热化学方程式:
I.
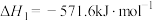
Ⅱ
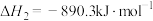
Ⅲ.
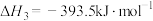
①已知
 ,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:
,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:__________________ 。
②如表所示是部分化学键的键能参数:
已知白磷的摩尔燃烧焓为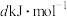 ,白磷及其完全燃烧的产物的结构如图所示,则表中x=
,白磷及其完全燃烧的产物的结构如图所示,则表中x=______ (用含a、b、c、d的代数式表示)。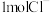 、
、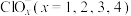 的能量(单位:kJ)相对大小如图所示。
的能量(单位:kJ)相对大小如图所示。______ (用离子符号表示)。
(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表:
①温度差的平均值为______ ℃。
②近似认为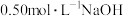 溶液和
溶液和 硫酸的密度都是
硫酸的密度都是 ,中和后生成的溶液的比热容
,中和后生成的溶液的比热容 。则测得的中和热
。则测得的中和热
______ (结果保留1位小数)。
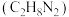 、液态氢等作为燃料,液态氧、四氧化二氮
、液态氢等作为燃料,液态氧、四氧化二氮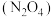 等作为助燃剂。火箭某一级发射使用的燃料是偏二甲肼
等作为助燃剂。火箭某一级发射使用的燃料是偏二甲肼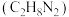 和四氧化二氮组合。
和四氧化二氮组合。(1)已知:1.5g偏二甲肼(液态)完全燃烧生成液态水放出50kJ热量。则偏二甲肼的摩尔燃烧焓为
(2)运载火箭的第三级使用的推进剂是液氢和液氧。
已知下列在298K时的热化学方程式:
I.

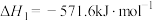
Ⅱ

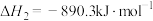
Ⅲ.

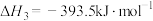
①已知

 ,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:
,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:②如表所示是部分化学键的键能参数:
化学键 | 键能 |
|
|
|
|
|
|
|
|
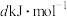 ,白磷及其完全燃烧的产物的结构如图所示,则表中x=
,白磷及其完全燃烧的产物的结构如图所示,则表中x=
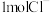 、
、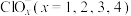 的能量(单位:kJ)相对大小如图所示。
的能量(单位:kJ)相对大小如图所示。
(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表:
实验次数 | 起始温度 | 终止温度 | 温度差 | ||
|
| 平均值 | |||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
②近似认为
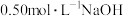 溶液和
溶液和 硫酸的密度都是
硫酸的密度都是 ,中和后生成的溶液的比热容
,中和后生成的溶液的比热容 。则测得的中和热
。则测得的中和热
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】研究 之间的转化具有重要意义。
之间的转化具有重要意义。
已知:

将一定量 气体充入恒容的密闭容器中,控制反应温度为
气体充入恒容的密闭容器中,控制反应温度为 。
。
(1)下列可以作为反应达到平衡的判据是___________(填编号)。
(2)反应温度 时,体系中
时,体系中 、
、 随t(时间)变化曲线如图实线所示。保持其它条件不变,改变反应温度为
随t(时间)变化曲线如图实线所示。保持其它条件不变,改变反应温度为 ,
, 随t(时间)变化曲线如图虚线所示。
随t(时间)变化曲线如图虚线所示。
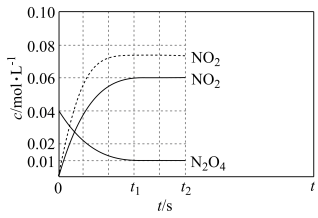
①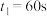 ,在0~60s时段,反应速率
,在0~60s时段,反应速率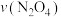 为
为___________ 
②反应温度为
___________ (填“大于”或“小于”) 。
。
③温度 时反应达平衡后,将反应容器的容积减少一半,平衡向
时反应达平衡后,将反应容器的容积减少一半,平衡向___________ (填“正反应”或“逆反应”)方向移动。
④ 时刻反应达到平衡,混合气体平衡总压强为p,
时刻反应达到平衡,混合气体平衡总压强为p, 气体的平衡转化率为75%,则反应
气体的平衡转化率为75%,则反应 的平衡常数
的平衡常数
___________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)NO氧化反应: 分两步进行,其反应过程能量变化示意图如图。
分两步进行,其反应过程能量变化示意图如图。
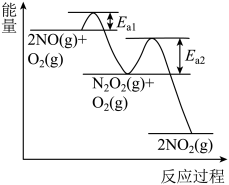
Ⅰ.

Ⅱ.

决定NO氧化反应速率的步骤是___________ (填“Ⅰ”或“Ⅱ”)。
 之间的转化具有重要意义。
之间的转化具有重要意义。已知:


将一定量
 气体充入恒容的密闭容器中,控制反应温度为
气体充入恒容的密闭容器中,控制反应温度为 。
。(1)下列可以作为反应达到平衡的判据是___________(填编号)。
| A.气体的压强不变 | B. |
| C.K不变 | D.容器内颜色不变 |
(2)反应温度
 时,体系中
时,体系中 、
、 随t(时间)变化曲线如图实线所示。保持其它条件不变,改变反应温度为
随t(时间)变化曲线如图实线所示。保持其它条件不变,改变反应温度为 ,
, 随t(时间)变化曲线如图虚线所示。
随t(时间)变化曲线如图虚线所示。
①
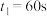 ,在0~60s时段,反应速率
,在0~60s时段,反应速率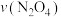 为
为
②反应温度为

 。
。③温度
 时反应达平衡后,将反应容器的容积减少一半,平衡向
时反应达平衡后,将反应容器的容积减少一半,平衡向④
 时刻反应达到平衡,混合气体平衡总压强为p,
时刻反应达到平衡,混合气体平衡总压强为p, 气体的平衡转化率为75%,则反应
气体的平衡转化率为75%,则反应 的平衡常数
的平衡常数
(3)NO氧化反应:
 分两步进行,其反应过程能量变化示意图如图。
分两步进行,其反应过程能量变化示意图如图。
Ⅰ.


Ⅱ.


决定NO氧化反应速率的步骤是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。在氨气足量的情况下,不同c(NO2)/c(NO)、不同温度对脱氮率的影响如图所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响:___________ 。


您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】完成下列问题
(1)一定条件下,在体积为5L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达到平衡后,降低温度,A的体积分数将减小。

①此反应平衡常数表达式为K=_______ 。
②该反应的△H_______ 0(填“>”“<”或“=”)。
③该反应的反应速率v随时间t的变化关系如图2所示,根据图2判断,在t3时刻改变的外界条件是_______ 。

在恒温恒容密闭容器中发生该反应,下列能作为达到平衡状态的判断依据是_______ (填标号)。
a.体系压强不变
b.气体的平均摩尔质量保持不变
c.气体的密度保持不变
d.A的消耗速率等于B的生成速率
(2)习近平主席在《中央城镇化工作会议》发出号召:“让居民望得见山、看得见水、记得住乡愁”。消除含氮、硫、氯等化合物对大气和水体的污染对建设美丽家乡,打造宜居环境具有重要意义。 NO2和CO是常见的环境污染气体,汽车尾气中C、NO2在一定条件下可以发生反应:4CO(g) + 2NO2(g) 4CO2(g) + N2(g) ΔH=-1200kJ/mol,在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。
4CO2(g) + N2(g) ΔH=-1200kJ/mol,在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。

①从反应开始到10 min的平衡状态,N2的平均反应速率为_______ 。从11 min起,其他条件不变,压缩容器的容积为1 L,则n(NO2)的变化曲线可能为图中的_______ (填abcd字母)。
②对于该反应,温度不同(T2 > T1)、其他条件相同时,下列图像表示正确的是_______ (填序号)。


(1)一定条件下,在体积为5L的密闭容器中,A、B、C三种气体的物质的量n(mol)随时间t(min)的变化如图1所示。已知达到平衡后,降低温度,A的体积分数将减小。

①此反应平衡常数表达式为K=
②该反应的△H
③该反应的反应速率v随时间t的变化关系如图2所示,根据图2判断,在t3时刻改变的外界条件是

在恒温恒容密闭容器中发生该反应,下列能作为达到平衡状态的判断依据是
a.体系压强不变
b.气体的平均摩尔质量保持不变
c.气体的密度保持不变
d.A的消耗速率等于B的生成速率
(2)习近平主席在《中央城镇化工作会议》发出号召:“让居民望得见山、看得见水、记得住乡愁”。消除含氮、硫、氯等化合物对大气和水体的污染对建设美丽家乡,打造宜居环境具有重要意义。 NO2和CO是常见的环境污染气体,汽车尾气中C、NO2在一定条件下可以发生反应:4CO(g) + 2NO2(g)
 4CO2(g) + N2(g) ΔH=-1200kJ/mol,在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。
4CO2(g) + N2(g) ΔH=-1200kJ/mol,在一定温度下,向容积固定为2 L的密闭容器中充入一定量的CO和NO2,NO2的物质的量随时间的变化曲线如图所示。
①从反应开始到10 min的平衡状态,N2的平均反应速率为
②对于该反应,温度不同(T2 > T1)、其他条件相同时,下列图像表示正确的是


您最近一年使用:0次