直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH)n(SO4)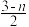 ]m(n>2,m≤10)的实验流程如下:
]m(n>2,m≤10)的实验流程如下:

已知:盐基度= ×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
(1)实验加入硫酸的作用是____________,取样分析Fe2+浓度,其目的是____________。
(2)用pH试纸测定溶液pH的操作方法为____________,若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数____________(填“偏高”、“偏低”、“无影响”)
(3)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2]⇌[Fe2(OH)n(SO4)3-n/2]m,则水解反应的化学方程式为____________.
(4)产品盐基度的测定方法:
Ⅰ称取m g固体试样,置于400mL聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.
Ⅱ室温下放置10min,再加入10mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀.
Ⅲ加入5滴酚酞指示剂,立即用物质的量浓度为c mol•L-1的氢氧化钠标准液滴定至终点,消耗体积为VmL.
Ⅳ向聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0mL.
①达到滴定终点的现象为____________。
②已知试样中Fe3+的质量分数为w1,则该试样的盐基度(w)的计算表达式为____________。
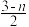 ]m(n>2,m≤10)的实验流程如下:
]m(n>2,m≤10)的实验流程如下:
已知:盐基度=
 ×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.
×100%.式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量.所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%.(1)实验加入硫酸的作用是____________,取样分析Fe2+浓度,其目的是____________。
(2)用pH试纸测定溶液pH的操作方法为____________,若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数____________(填“偏高”、“偏低”、“无影响”)
(3)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2]⇌[Fe2(OH)n(SO4)3-n/2]m,则水解反应的化学方程式为____________.
(4)产品盐基度的测定方法:
Ⅰ称取m g固体试样,置于400mL聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.
Ⅱ室温下放置10min,再加入10mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀.
Ⅲ加入5滴酚酞指示剂,立即用物质的量浓度为c mol•L-1的氢氧化钠标准液滴定至终点,消耗体积为VmL.
Ⅳ向聚乙烯烧杯中,加入25mL盐酸标准溶液,再加20mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿.然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0mL.
①达到滴定终点的现象为____________。
②已知试样中Fe3+的质量分数为w1,则该试样的盐基度(w)的计算表达式为____________。
更新时间:2016-12-09 15:34:01
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】CO2和CH4是两种温室气体,研究它们具有重要的意义。
(1)已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ· mol-1、-285.8 kJ· mol-1和-283.0 kJ·mol-1。则
 △H=
△H=_________ kJ·mol-1
(2)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示为: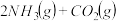
 △H=-86.98 kJ·mol-1
△H=-86.98 kJ·mol-1
反应中影响CO2平衡转化率的因素很多,右图为某特定条件下,不同水碳比[n(H2O/n(CO2)]和温度对CO2平衡转化率的影响曲线。

①为提高CO2的平衡转化率,生产中除控制温度外还可以采取的措施有___________________ 、____________________ 。
②当温度高于190℃后,CO2平衡转化率出现如图所示的变化趋势,其原因是_______________ 。
(3)向1.0 L密闭容器中通入0.2 mol NH3(g)和0.1 mol CO2(g),在一定温度下发生反应则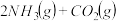
 ,反应时间与气体总压强(p)的数据如下表:
,反应时间与气体总压强(p)的数据如下表:
 用起始压强和总压强计算平衡时NH3的转化率为
用起始压强和总压强计算平衡时NH3的转化率为_________ ,0~80 min内CO2的平均反应速率是__________ 。
(4)氨基甲酸铵(NH2COONH4)极易水解成碳酸铵,在酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入到1 L 0.1 mol·L-1的盐酸中直到pH=7(室温下,忽略溶液体积变化),共用去0.052 mol氨基甲酸铵,溶液中几乎不含碳元素。此时溶液中c(NH4+)=__________ ,NH4+水解平衡常数为__________ 。
(1)已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ· mol-1、-285.8 kJ· mol-1和-283.0 kJ·mol-1。则

 △H=
△H=(2)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示为:
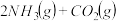
 △H=-86.98 kJ·mol-1
△H=-86.98 kJ·mol-1反应中影响CO2平衡转化率的因素很多,右图为某特定条件下,不同水碳比[n(H2O/n(CO2)]和温度对CO2平衡转化率的影响曲线。

①为提高CO2的平衡转化率,生产中除控制温度外还可以采取的措施有
②当温度高于190℃后,CO2平衡转化率出现如图所示的变化趋势,其原因是
(3)向1.0 L密闭容器中通入0.2 mol NH3(g)和0.1 mol CO2(g),在一定温度下发生反应则
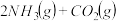
 ,反应时间与气体总压强(p)的数据如下表:
,反应时间与气体总压强(p)的数据如下表: 用起始压强和总压强计算平衡时NH3的转化率为
用起始压强和总压强计算平衡时NH3的转化率为(4)氨基甲酸铵(NH2COONH4)极易水解成碳酸铵,在酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入到1 L 0.1 mol·L-1的盐酸中直到pH=7(室温下,忽略溶液体积变化),共用去0.052 mol氨基甲酸铵,溶液中几乎不含碳元素。此时溶液中c(NH4+)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】实验室利用橄榄石尾矿(主要成分为MgO及少量FeO、Fe2O3、Al2O3等)制备纯净氯化镁晶体(MgCl2·6H2O),实验流程如下:

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有_______ (任写1种)。
(2)气体X是_______ (写化学式),调节溶液pH时,控制pH范围为_______ 。
(3)加入H2O2的目的是_______ 。
(4)“一系列操作”主要包括加入足量盐酸,然后经过_______ 、过滤、洗涤,即得到氯化镁晶体。
(5)准确称取2.000g氯化镁晶体产品于250mL锥形瓶中,加水50mL使其完全溶解,加入100mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断振荡下,用0.500mol·L-1的EDTA(含Y4-)标准溶液进行滴定,其反应原理为Mg2++Y4-=MgY2-,滴定终点时消耗EDTA标准溶液的体积18.00mL。
①则产品中MgCl2·6H2O的质量分数为_______ 。
②下列滴定操作会导致测量结果偏低的是_______ (填字母)。
a.锥形瓶洗涤后没有干燥 b.滴定时锥形瓶中有液体溅出
c.滴定终点时俯视读数 d.滴定管滴定前有气泡,滴定后气泡消失

已知几种金属阳离子形成氢氧化物沉淀时的pH如下表:
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时 | 7.6 | 2.7 | 4.2 | 9.6 |
| 沉淀完全时 | 9.6 | 3.7 | 5.4 | 11.1 |
回答下列问题:
(1)“浸取”步骤中,能加快浸取速率的方法有
(2)气体X是
(3)加入H2O2的目的是
(4)“一系列操作”主要包括加入足量盐酸,然后经过
(5)准确称取2.000g氯化镁晶体产品于250mL锥形瓶中,加水50mL使其完全溶解,加入100mL氨性缓冲液和少量铬黑T指示剂,溶液显酒红色,在不断振荡下,用0.500mol·L-1的EDTA(含Y4-)标准溶液进行滴定,其反应原理为Mg2++Y4-=MgY2-,滴定终点时消耗EDTA标准溶液的体积18.00mL。
①则产品中MgCl2·6H2O的质量分数为
②下列滴定操作会导致测量结果偏低的是
a.锥形瓶洗涤后没有干燥 b.滴定时锥形瓶中有液体溅出
c.滴定终点时俯视读数 d.滴定管滴定前有气泡,滴定后气泡消失
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】维持 的稳定对生命体的生理活动具有重要意义。
的稳定对生命体的生理活动具有重要意义。
已知:常温下,在不同试剂中加入酸或碱后体系 的变化如下表所示。
的变化如下表所示。
(1)
___________ (忽略通入 气体前后体系的体积变化)。
气体前后体系的体积变化)。
(2)结合化学用语解释ⅱ显酸性的原因:_________________________________ 。
(3)试剂ⅱ中微粒浓度关系正确的有___________ (填序号)
a.
b.
c.
(4)由表中数据可知,试剂ⅱ的 受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的
受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的 几乎不变的作用称为缓冲作用。下列具有缓冲作用的溶液是
几乎不变的作用称为缓冲作用。下列具有缓冲作用的溶液是___________ (填序号)。
a. b.
b.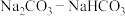 c.
c. d.
d.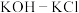
(5)研究表明,人体血液中存在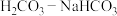 等体系,通过平衡的移动起到稳定血液
等体系,通过平衡的移动起到稳定血液 的作用。当少量的强碱进入血液中时,血液缓冲体系中
的作用。当少量的强碱进入血液中时,血液缓冲体系中 的值将
的值将___________ (填“变大”、“变小”或“不变)。
 的稳定对生命体的生理活动具有重要意义。
的稳定对生命体的生理活动具有重要意义。已知:常温下,在不同试剂中加入酸或碱后体系
 的变化如下表所示。
的变化如下表所示。试剂 |
| ||
初始 | 通入 | 加入 | |
i. | 7 | a | 12 |
ii.
配制成 | 4.76 | 4.67 | 4.85 |

 气体前后体系的体积变化)。
气体前后体系的体积变化)。(2)结合化学用语解释ⅱ显酸性的原因:
(3)试剂ⅱ中微粒浓度关系正确的有
a.

b.

c.

(4)由表中数据可知,试剂ⅱ的
 受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的
受一定量的酸和碱的影响不大。溶液的这种能对抗外来少量强酸、强碱或适当稀释,而保持溶液的 几乎不变的作用称为缓冲作用。下列具有缓冲作用的溶液是
几乎不变的作用称为缓冲作用。下列具有缓冲作用的溶液是a.
 b.
b.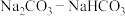 c.
c. d.
d.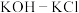
(5)研究表明,人体血液中存在
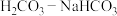 等体系,通过平衡的移动起到稳定血液
等体系,通过平衡的移动起到稳定血液 的作用。当少量的强碱进入血液中时,血液缓冲体系中
的作用。当少量的强碱进入血液中时,血液缓冲体系中 的值将
的值将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol·L-1的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤①称量5.6g废铁屑时,若砝码与物品的位置放反了,则称得的废铁屑的质量会____ (填“增大”“减小”或“不变”)。
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________________ 。
(3)装置C的作用是__________________________ 。
(4)步骤④中洗涤时所用的洗涤剂最好是______ (填标号)。
A.稀硝酸 B.无水乙醇 C.苯
(5)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用cmol·L-1的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
蒸馏水煮沸的原因:______________ ,KMnO4标准溶液用______ (酸或碱)式滴定管,产品的纯度为_______ (列出计算表达式即可)。
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:


I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol·L-1的硫酸,连接好装置(如图)后水浴加热至反应完全。
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤①称量5.6g废铁屑时,若砝码与物品的位置放反了,则称得的废铁屑的质量会
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是
(3)装置C的作用是
(4)步骤④中洗涤时所用的洗涤剂最好是
A.稀硝酸 B.无水乙醇 C.苯
(5)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后用cmol·L-1的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
蒸馏水煮沸的原因:
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:

| 操作步骤 | 实验现象 | 解释原因 |
| 组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
| 气体产物经过试管B时 | 品红溶液褪色 | (6) 产物中含有 |
| 气体产物经过试管C时 | 试管C中出现白色沉淀 | (7)C中反应的化学方程式为 |
| 将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (8) | (9) 溶液中含有 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
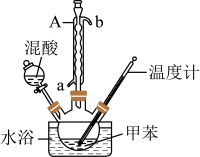
【推荐2】一硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置(夹持及搅拌装置已略去)制备一硝基甲苯,实验步骤如下:
①配制浓硫酸和浓硝酸的混合物(混酸,足量);
②在三颈烧瓶中加入15mL甲苯(密度为0.866g•cm-3);
③装好其他试剂,并组装好仪器;
④向三颈烧瓶中加入混酸,并不断搅拌;
⑤控制温度,反应大约10min至三颈烧瓶底部有大量液体(淡黄色油状)出现;
⑥分离出一硝基甲苯,经提纯最终得到一硝基甲苯12.5g。
根据上述实验,回答下列问题:
(1)仪器A的名称是______ ,作用是______ 。
(2)本实验的关键是控制温度在30℃左右,如果温度过高,可能会产生_____ (填一种物质的名称)等副产物。写出甲苯与混酸反应生成2,4,6-三硝基甲苯的化学方程式:______ 。
分离产品的方案如图:
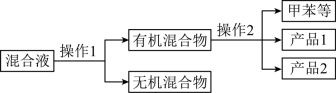
(3)操作1一定需要用到的玻璃仪器是______ ,操作2的名称是______ 。
(4)经测定产品2的核磁共振氢谱中有3组峰,则产品2的结构简式为______ 。
(5)本实验中一硝基甲苯的产率为______ (结果保留三位有效数字)。
①配制浓硫酸和浓硝酸的混合物(混酸,足量);
②在三颈烧瓶中加入15mL甲苯(密度为0.866g•cm-3);
③装好其他试剂,并组装好仪器;
④向三颈烧瓶中加入混酸,并不断搅拌;
⑤控制温度,反应大约10min至三颈烧瓶底部有大量液体(淡黄色油状)出现;
⑥分离出一硝基甲苯,经提纯最终得到一硝基甲苯12.5g。

根据上述实验,回答下列问题:
(1)仪器A的名称是
(2)本实验的关键是控制温度在30℃左右,如果温度过高,可能会产生
分离产品的方案如图:

(3)操作1一定需要用到的玻璃仪器是
(4)经测定产品2的核磁共振氢谱中有3组峰,则产品2的结构简式为
(5)本实验中一硝基甲苯的产率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】采用废铁屑还原软锰矿(软锰矿主要成分是 ,还含少量Fe、Mg、Ni、Si等元素的氧化物杂质)来制备Mn的工艺流程如图所示:
,还含少量Fe、Mg、Ni、Si等元素的氧化物杂质)来制备Mn的工艺流程如图所示:

已知:① ,
, ;②溶液中某离子浓度
;②溶液中某离子浓度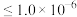 mol⋅L
mol⋅L 时,认为该离子沉淀完全;③室温时生成氢氧化物的pH见下表
时,认为该离子沉淀完全;③室温时生成氢氧化物的pH见下表
回答下列问题:
(1)在“浸出液”中加入“ ”时发生反应的离子方程式为
”时发生反应的离子方程式为___________ ;硫酸酸化的 可与
可与 (难溶于水)反应生成
(难溶于水)反应生成 和
和 ,此反应的离子方程式为
,此反应的离子方程式为___________ 。
(2) (室温)时,溶液中残余的
(室温)时,溶液中残余的 的浓度为
的浓度为___________ mol⋅L ,加入MnS“除杂”后的滤渍为
,加入MnS“除杂”后的滤渍为___________ 。
(3)“沉锰”过程中温度和pH对 和
和 沉淀率的影响如下图所示。由图可知,“沉锰”的合适条件是
沉淀率的影响如下图所示。由图可知,“沉锰”的合适条件是___________ ,“沉锰”除去的杂质金属离子是___________ 。

(4)若沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。当温度超过30℃,沉锰反应的锰沉淀率随温度升高而下降的原因是___________ 。
 ,还含少量Fe、Mg、Ni、Si等元素的氧化物杂质)来制备Mn的工艺流程如图所示:
,还含少量Fe、Mg、Ni、Si等元素的氧化物杂质)来制备Mn的工艺流程如图所示:
已知:①
 ,
, ;②溶液中某离子浓度
;②溶液中某离子浓度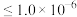 mol⋅L
mol⋅L 时,认为该离子沉淀完全;③室温时生成氢氧化物的pH见下表
时,认为该离子沉淀完全;③室温时生成氢氧化物的pH见下表| 离子 |  |  |  |  |  |
| 开始沉淀的pH | 7.5 | 2.7 | 8.1 | 7.7 | 8.3 |
| 完全沉淀的pH | 9.7 | 3.7 | 9.4 | 8.4 | 9.8 |
(1)在“浸出液”中加入“
 ”时发生反应的离子方程式为
”时发生反应的离子方程式为 可与
可与 (难溶于水)反应生成
(难溶于水)反应生成 和
和 ,此反应的离子方程式为
,此反应的离子方程式为(2)
 (室温)时,溶液中残余的
(室温)时,溶液中残余的 的浓度为
的浓度为 ,加入MnS“除杂”后的滤渍为
,加入MnS“除杂”后的滤渍为(3)“沉锰”过程中温度和pH对
 和
和 沉淀率的影响如下图所示。由图可知,“沉锰”的合适条件是
沉淀率的影响如下图所示。由图可知,“沉锰”的合适条件是
(4)若沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。当温度超过30℃,沉锰反应的锰沉淀率随温度升高而下降的原因是
您最近一年使用:0次
【推荐1】化学电池一直是化学工作者研究的热点之一。
Ⅰ.早期的锌汞纽扣式电池,以锌和氧化汞为电极材料,氢氧化钾溶液为电解液的原电池,有效的解决电池使用寿命短、易发生漏液等问题。
电池总反应为:Zn+HgO = ZnO+Hg 。
(1)该电池的正极反应式是___________ 。
(2)但是该工厂的污水中会含有一定量的+2价的汞离子,通常采用向污水中通入一定量的硫化氢,反应的离子方程式为___________ 。
(3)该方法的缺点是产物的颗粒比较小,大部分悬浮于污水中,通常采用投入一定量的明矾晶体进行后续处理,请解释其原因___________ 。
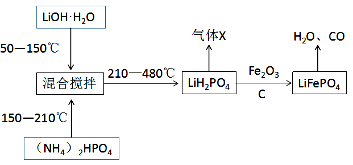
II.锂离子电池由于轻便、比能量大等优点,成为当今社会最为常见的电池。其中的重要材料磷酸亚铁锂(LiFePO4)通常按照下列流程进行生产:
请回答下列问题:
(4)生产过程中“混合搅拌”的目的是__________ 。气体X除了水蒸气之外,还含有___________ (填写化学式)。
(5)请写出一定条件下由LiH2PO4生成LiFePO4的化学方程式__________ ,当生成1mol磷酸亚铁锂时,转移的电子数目为___________ 。
Ⅰ.早期的锌汞纽扣式电池,以锌和氧化汞为电极材料,氢氧化钾溶液为电解液的原电池,有效的解决电池使用寿命短、易发生漏液等问题。
电池总反应为:Zn+HgO = ZnO+Hg 。
(1)该电池的正极反应式是
(2)但是该工厂的污水中会含有一定量的+2价的汞离子,通常采用向污水中通入一定量的硫化氢,反应的离子方程式为
(3)该方法的缺点是产物的颗粒比较小,大部分悬浮于污水中,通常采用投入一定量的明矾晶体进行后续处理,请解释其原因
II.锂离子电池由于轻便、比能量大等优点,成为当今社会最为常见的电池。其中的重要材料磷酸亚铁锂(LiFePO4)通常按照下列流程进行生产:

请回答下列问题:
(4)生产过程中“混合搅拌”的目的是
(5)请写出一定条件下由LiH2PO4生成LiFePO4的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】粗盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验回答下列问题。
(1)如何运用最简方法检验溶液中有无SO42-?________________ 。如果有,应该如何除去SO42-?______________________ 。
(2)在粗盐经过溶解→过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是___________________ 。
(3)将经过操作(2)后的溶液过滤。请问这一操作能除掉哪些杂质?_______________________ 。
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:___________________ ;过滤时:_________________ ;蒸发时:____________ 。
(1)如何运用最简方法检验溶液中有无SO42-?
(2)在粗盐经过溶解→过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是
(3)将经过操作(2)后的溶液过滤。请问这一操作能除掉哪些杂质?
(4)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
溶解时:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】如图是中学化学中常用于混合物分离和提纯的装置,请根据装置回答问题:
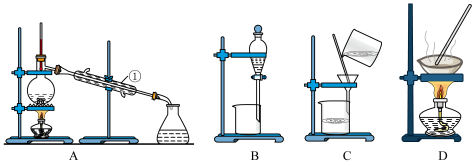
(1)在装置C和D中都用到玻璃棒,装置C中玻璃棒的作用是___________ ,装置D中玻璃棒的作用是___________ 。
(2)装置A中的①的名称是是___________ ,冷却水的方向是___________ 。装置B在分液时为是液体顺利滴下,应进行的操作是______________________ 。
(3)从氯化钠溶液中得到氯化钠固体,应选择___________ (填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置__________ 。检验自来水中Cl-是否除净的方法:取少量锥形瓶中的水于洁净试管中,滴加___________ ,不产生白色沉淀表明Cl-已除净;从碘水中分离出I2,选择装置___________ ,该分离方法的名称是________ 。

(1)在装置C和D中都用到玻璃棒,装置C中玻璃棒的作用是
(2)装置A中的①的名称是是
(3)从氯化钠溶液中得到氯化钠固体,应选择
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】为测定某Na2SO3样品(含少量Na2SO4杂质)的纯度,实验室按以下步骤进行;①称取ag样品,置于烧杯中;②加入适量蒸馏水,使样品溶解,然后配制成250mL溶液;③准确量取25.00mL步骤②中配得的溶液;
然后,可采用下列两种方法进行测定:

请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的的仪器是E和______ (填字母);
(2)在方法一④中加入过量稀盐酸的目的是________________________________ ;
(3)在方法一测定得到Na2SO3样品的纯度是_______________ (列出算式,可不化简);
(4)在方法二中,是否需要加入指示剂_______ (填“是”或“否”),请简述理由________ ;
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果________________________
(填“偏高”、“偏低”、“无影响”)。
然后,可采用下列两种方法进行测定:
| 方法一 | 方法二 |
| ④将25.00mL溶液置于烧杯中,加入过量的稀盐酸充分搅拌; ⑤加入过量BaCl2溶液,充分搅拌,使沉淀完全; ⑥过滤、洗涤、干燥沉淀、称量得到bg固体。 | ④将25.00mL溶液置于锥形瓶中; ⑤用0.1 mol/L的酸性KMnO4溶液进行滴定,达到滴定终点时,消耗10.00mL溶液。 |

请根据上述实验,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用的的仪器是E和
(2)在方法一④中加入过量稀盐酸的目的是
(3)在方法一测定得到Na2SO3样品的纯度是
(4)在方法二中,是否需要加入指示剂
(5)在方法二中达到滴定终点读取数据时,俯视液面,则测定结果
(填“偏高”、“偏低”、“无影响”)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,将其中的Ca2+转化为草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸(如盐酸)可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如图实验步骤测定血液样品中Ca2+的浓度。
步骤1:配制KMnO4标准溶液。如图是配制100 mLKMnO4标准溶液的过程。
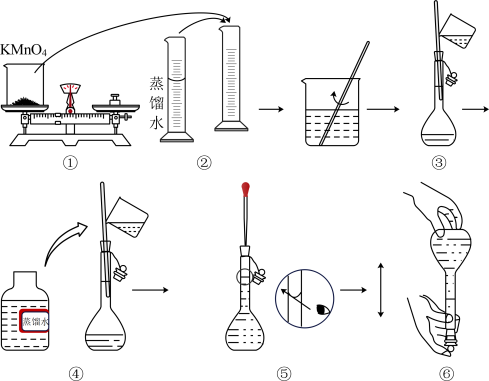
(1)需用的仪器有天平、药匙、烧杯、玻璃棒、量简、胶头滴管、_______ 。请你观察图示判断,其中不正确的操作有_______ (填序号)。
(2)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将_______ (填“偏大”或“偏小”)。
步骤2:测定血液样品中Ca2+的浓度。抽取血样20.00mL,经上述处理得到草酸,再用0.020 mol/LKMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mLKMnO4溶液。
(3)已知:CaC2O4+2HCl=CaCl2+H2C2O4;2KMnO4+5H2C2O4+6HCl=2MnCl2+2KCl+10CO2↑+8H2O。经过计算,血液样品中Ca2+的浓度为_______ mg/cm3 (保留2位有效数字)。
(4)在用KNMnO4溶液对所得草酸进行滴定的过程中,若出现下列情况,测定结果偏低的是_______ 。
A.滴定前用待滴定的草酸溶液润洗锥形瓶
B.在振荡锥形瓶时不慎将瓶内溶液溅出
C.若在滴定过程中不慎将数滴KMnO4溶液滴在锥形瓶外
D.用蒸馏水洗涤酸式滴定管后即使用,没有用KMnO4溶液润洗
E.用蒸领水洗净锥形瓶后,装入待测草酸溶液,加入少量的蒸增水再进行滴定
F.酸式滴定管在滴定前有气泡,滴定后气泡消失
步骤1:配制KMnO4标准溶液。如图是配制100 mLKMnO4标准溶液的过程。

(1)需用的仪器有天平、药匙、烧杯、玻璃棒、量简、胶头滴管、
(2)如果用图示的操作所配制的溶液进行实验,在其他操作正确的情况下,所配制的溶液浓度将
步骤2:测定血液样品中Ca2+的浓度。抽取血样20.00mL,经上述处理得到草酸,再用0.020 mol/LKMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mLKMnO4溶液。
(3)已知:CaC2O4+2HCl=CaCl2+H2C2O4;2KMnO4+5H2C2O4+6HCl=2MnCl2+2KCl+10CO2↑+8H2O。经过计算,血液样品中Ca2+的浓度为
(4)在用KNMnO4溶液对所得草酸进行滴定的过程中,若出现下列情况,测定结果偏低的是
A.滴定前用待滴定的草酸溶液润洗锥形瓶
B.在振荡锥形瓶时不慎将瓶内溶液溅出
C.若在滴定过程中不慎将数滴KMnO4溶液滴在锥形瓶外
D.用蒸馏水洗涤酸式滴定管后即使用,没有用KMnO4溶液润洗
E.用蒸领水洗净锥形瓶后,装入待测草酸溶液,加入少量的蒸增水再进行滴定
F.酸式滴定管在滴定前有气泡,滴定后气泡消失
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】利用莫尔盐制备草酸亚铁晶体 的实验及样品纯度的检验实验设计如下,回答下列问题:
的实验及样品纯度的检验实验设计如下,回答下列问题:
已知: 时,
时, 易被氧气氧化。
易被氧气氧化。
Ⅰ.莫尔盐 的制备
的制备
实验步骤:将绿矾与适量的硫酸铵固体混合溶于水中,加入适量的稀硫酸调节 至
至 ,蒸发浓缩,趁热过滤,冷却结晶,过滤、洗涤、干燥,得产品。
,蒸发浓缩,趁热过滤,冷却结晶,过滤、洗涤、干燥,得产品。
(1)用稀硫酸调溶液 至
至 的目的是
的目的是_______ 。
Ⅱ.草酸亚铁晶体的制备
实验步骤:将莫尔盐溶于适量稀硫酸并装入三颈烧瓶中,通过仪器 滴加草酸溶液,水浴加热,充分反应后过滤,洗涤,得淡黄色固体草酸亚铁晶体。
滴加草酸溶液,水浴加热,充分反应后过滤,洗涤,得淡黄色固体草酸亚铁晶体。 的名称是
的名称是_______ ,导管A的作用是_______ 。
Ⅲ.草酸亚铁晶体样品纯度的检验
草酸亚铁晶体样品中可能含有的杂质为 ,采用
,采用 滴定法测定该样品的组成,实验步骤如下:
滴定法测定该样品的组成,实验步骤如下:
①准确称取 草酸亚铁晶体样品,溶于稀硫酸中,配成
草酸亚铁晶体样品,溶于稀硫酸中,配成 溶液。
溶液。
②取 ①中所得的溶液,用
①中所得的溶液,用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 。③向滴定后的溶液中加入适量锌粉,充分反应后过滤,洗涤,洗涤液并入滤液中。
。③向滴定后的溶液中加入适量锌粉,充分反应后过滤,洗涤,洗涤液并入滤液中。
④继续用 标准溶液滴定步骤③中所得滤液至终点,消耗
标准溶液滴定步骤③中所得滤液至终点,消耗 标准溶液
标准溶液 。
。
已知: ;
;
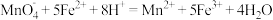 。
。
(3)步骤②中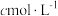 的
的 溶液装在
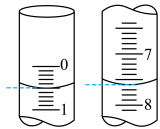
溶液装在_______ (填“酸式滴定管”或“碱式滴定管”)中;步骤④中若滴定开始和结束时,滴定管中的液面如下图所示,则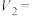
_______ 。_______ ;步骤③中加入锌粉的目的是_______ 。
(5)草酸亚铁晶体样品的纯度为_______ (用含 的式子表示)。
的式子表示)。
 的实验及样品纯度的检验实验设计如下,回答下列问题:
的实验及样品纯度的检验实验设计如下,回答下列问题:已知:
 时,
时, 易被氧气氧化。
易被氧气氧化。Ⅰ.莫尔盐
 的制备
的制备实验步骤:将绿矾与适量的硫酸铵固体混合溶于水中,加入适量的稀硫酸调节
 至
至 ,蒸发浓缩,趁热过滤,冷却结晶,过滤、洗涤、干燥,得产品。
,蒸发浓缩,趁热过滤,冷却结晶,过滤、洗涤、干燥,得产品。(1)用稀硫酸调溶液
 至
至 的目的是
的目的是Ⅱ.草酸亚铁晶体的制备
实验步骤:将莫尔盐溶于适量稀硫酸并装入三颈烧瓶中,通过仪器
 滴加草酸溶液,水浴加热,充分反应后过滤,洗涤,得淡黄色固体草酸亚铁晶体。
滴加草酸溶液,水浴加热,充分反应后过滤,洗涤,得淡黄色固体草酸亚铁晶体。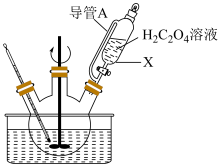
 的名称是
的名称是Ⅲ.草酸亚铁晶体样品纯度的检验
草酸亚铁晶体样品中可能含有的杂质为
 ,采用
,采用 滴定法测定该样品的组成,实验步骤如下:
滴定法测定该样品的组成,实验步骤如下:①准确称取
 草酸亚铁晶体样品,溶于稀硫酸中,配成
草酸亚铁晶体样品,溶于稀硫酸中,配成 溶液。
溶液。②取
 ①中所得的溶液,用
①中所得的溶液,用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 。③向滴定后的溶液中加入适量锌粉,充分反应后过滤,洗涤,洗涤液并入滤液中。
。③向滴定后的溶液中加入适量锌粉,充分反应后过滤,洗涤,洗涤液并入滤液中。④继续用
 标准溶液滴定步骤③中所得滤液至终点,消耗
标准溶液滴定步骤③中所得滤液至终点,消耗 标准溶液
标准溶液 。
。已知:
 ;
;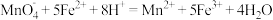 。
。(3)步骤②中
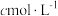 的
的 溶液装在
溶液装在
(5)草酸亚铁晶体样品的纯度为
 的式子表示)。
的式子表示)。
您最近一年使用:0次

 气体
气体 固体
固体
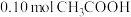

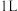 的溶液
的溶液

