常温下,下列叙述不正确的是
| A.c(H+)>c(OH-)的溶液一定显酸性 |
| B.pH=3 的弱酸溶液与 pH=11 的强碱溶液等体积混合后溶液呈酸性 |
| C.pH=5 的硫酸溶液稀释到原来的 500 倍,稀释后 c(SO42-)与 c(H+)之比约为 1∶10 |
| D.中和 10 mL 0.1 mol/L 醋酸与 100 mL 0.01 mol/L 醋酸所需 NaOH 的物质的量不同 |
16-17高二·陕西西安·期中 查看更多[6]
2016-2017学年陕西西安中学高二实验班上期中化学卷【全国百强校】广西桂林市第十八中学2017-2018学年高二下学期期中考试化学试题黑龙江省实验中学2020-2021学年高二上学期期中考试化学试题(已下线)第24讲 水的电离和溶液的pH(精讲)-2022年一轮复习讲练测(已下线)【知识图鉴】单元讲练测选择性必修1第3单元01讲核心(已下线)第2讲 溶液的酸碱性和pH计算
更新时间:2016-12-15 14:15:28
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列液体均处于25℃,有关叙述正确的是
| A.某物质的溶液pH<7,则该物质一定是酸 |
| B.相同条件下,pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| C.将1L 0.1mol·L-1的Ba(OH)2溶液稀释为2L,pH=12 |
| D.pH=8的NaOH溶液稀释100倍,其pH=6 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】在25℃的条件下,将体积都为10mL,pH都等于3的醋酸和盐酸,加水稀释到amL和bmL,测得稀释后溶液的pH均为5,则稀释时加入水的体积为( )
| A.a>b=1000mL | B.a=b>1000mL | C.a<b | D.a=b |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】室温下,向20.00mL 盐酸中滴加
盐酸中滴加 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。下列说法错误的是
NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。下列说法错误的是
 盐酸中滴加
盐酸中滴加 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。下列说法错误的是
NaOH溶液,溶液的pH随NaOH溶液体积的变化如图。下列说法错误的是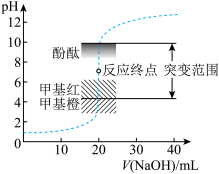
A.NaOH与盐酸恰好完全反应时, |
| B.选择变色范围在pH突变范围内的指示剂,可减小实验误差 |
| C.选择甲基红指示反应终点,误差比甲基橙的大 |
D.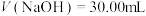 时,水电离受到抑制 时,水电离受到抑制 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】常温下,下列说法正确的是
A.某溶液中水电离出的氢离子浓度为 ,则溶液一定呈中性 ,则溶液一定呈中性 |
B. 的盐酸与 的盐酸与 的 的 溶液混合,测得 溶液混合,测得 ,则 ,则 为弱碱 为弱碱 |
C.物质的量浓度相等的盐溶液 与 与 ,若 ,若 ,则 ,则 为强酸 为强酸 |
D.测得 溶液 溶液 ,取该溶液 ,取该溶液 ,滴入 ,滴入 浓溶液,测得 浓溶液,测得 ,若 ,若 ,则 ,则 是弱酸 是弱酸 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】 时,某二元酸
时,某二元酸 的
的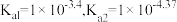 。
。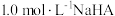 溶液稀释过程中
溶液稀释过程中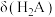 、
、 、
、 与
与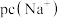 的关系如图。已知:
的关系如图。已知: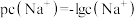 ,
, 表示微粒的分布分数,如
表示微粒的分布分数,如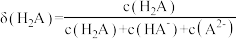 ,a、b两点坐标分别为
,a、b两点坐标分别为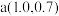 、
、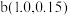 。下列说法错误的是
。下列说法错误的是

 时,某二元酸
时,某二元酸 的
的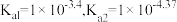 。
。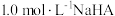 溶液稀释过程中
溶液稀释过程中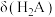 、
、 、
、 与
与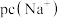 的关系如图。已知:
的关系如图。已知: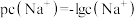 ,
, 表示微粒的分布分数,如
表示微粒的分布分数,如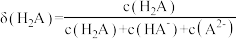 ,a、b两点坐标分别为
,a、b两点坐标分别为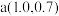 、
、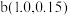 。下列说法错误的是
。下列说法错误的是
A.曲线X为 的变化曲线 的变化曲线 | B.a点: |
C.b点: | D.c点: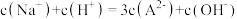 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是
| A.等体积等pH的盐酸和醋酸溶液加水稀释10倍后,c(Clˉ)<c(CH3COOˉ) |
| B.分别中和pH相等、体积相等的两溶液,所需NaOH的物质的量相同 |
| C.常温下,pH<7的溶液一定是酸溶液 |
| D.相同浓度的盐酸和醋酸两溶液,中和等体积等浓度的NaOH溶液,醋酸消耗的体积多 |
您最近一年使用:0次



