含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。N在元素周期表中的位置:______________ 。元素C、N最简单气态氢化物中稳定性更强的是: ____________ .(填化学式)
I.氨气应用于侯德榜制碱工艺,原理如下图所示:
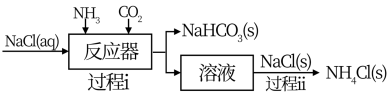
(1)过程i通入NH3和CO2的顺序是___________ 。
(2)过程ii有利于析出更多NH4Cl(s)的原因是_____________ 。
(3)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,原因是(用化学方程式表示)_________________ 。 而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为____________ 。
Ⅱ.电镀工业中含CN-的废水在排放前的处理过程如下:
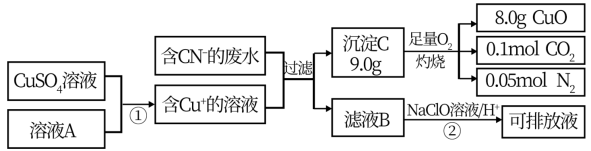
(1)溶液A具有的性质是(填“氧化性”或“还原性”)_______ . C的化学式为:______ 。
(2)反应② 可将CN一转化为无害物质,其离子方程式为:_____________ 。
I.氨气应用于侯德榜制碱工艺,原理如下图所示:

(1)过程i通入NH3和CO2的顺序是
(2)过程ii有利于析出更多NH4Cl(s)的原因是
(3)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,原因是(用化学方程式表示)
Ⅱ.电镀工业中含CN-的废水在排放前的处理过程如下:

(1)溶液A具有的性质是(填“氧化性”或“还原性”)
(2)反应② 可将CN一转化为无害物质,其离子方程式为:
更新时间:2017-05-29 17:22:52
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】工业上以制作印刷电路的废液(含 、
、 、
、 、
、 )生产
)生产 和蚀刻液重新生成的流程如下:
和蚀刻液重新生成的流程如下: 是一种白色粉末,微溶于水、不溶于乙醇。
是一种白色粉末,微溶于水、不溶于乙醇。
请回答下列问题:
(1)Y中所含溶质的化学式为___________ 。
(2)下列说法正确的是___________ 。
A. 微溶于水、不溶于乙醇是因为水的极性比乙醇小
微溶于水、不溶于乙醇是因为水的极性比乙醇小
B.相同条件下,滤渣1和X分别与等浓度的盐酸反应,滤渣①的反应速率快
C. 分子的VSEPR模型为平面三角形
分子的VSEPR模型为平面三角形
D.基态亚铜的价层电子排布式为 ,故
,故 与稀硫酸不反应
与稀硫酸不反应
E.工业上对滤渣2用浓硫酸进行了处理,符合绿色化学的原则
(3)写出上述流程中生成 的化学方程式
的化学方程式___________ 。
(4)浓硫酸是一种高沸点的酸,溶于水放出大量的热,请从物质结构与微粒之间作用力的角度解释上述硫酸的两点性质___________ 。
(5)滤液1需要加过量Z,检验Z过量的方法是___________ 。
 、
、 、
、 、
、 )生产
)生产 和蚀刻液重新生成的流程如下:
和蚀刻液重新生成的流程如下: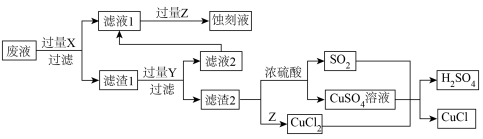
 是一种白色粉末,微溶于水、不溶于乙醇。
是一种白色粉末,微溶于水、不溶于乙醇。请回答下列问题:
(1)Y中所含溶质的化学式为
(2)下列说法正确的是
A.
 微溶于水、不溶于乙醇是因为水的极性比乙醇小
微溶于水、不溶于乙醇是因为水的极性比乙醇小B.相同条件下,滤渣1和X分别与等浓度的盐酸反应,滤渣①的反应速率快
C.
 分子的VSEPR模型为平面三角形
分子的VSEPR模型为平面三角形D.基态亚铜的价层电子排布式为
 ,故
,故 与稀硫酸不反应
与稀硫酸不反应E.工业上对滤渣2用浓硫酸进行了处理,符合绿色化学的原则
(3)写出上述流程中生成
 的化学方程式
的化学方程式(4)浓硫酸是一种高沸点的酸,溶于水放出大量的热,请从物质结构与微粒之间作用力的角度解释上述硫酸的两点性质
(5)滤液1需要加过量Z,检验Z过量的方法是
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐2】化合物A(200g•mol-1<M<300g•mol-1)由3种常见元素组成,某兴趣小组进行了如图实验:
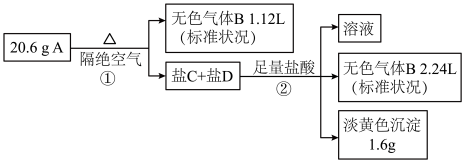
已知:A的焰色为紫色;气体B能使品红溶液褪色;盐C和盐D的组成元素和A相同,且C、D的物质的量之比为1:1。
请回答:
(1)组成A的元素有______ 。
(2)A的化学式为_______ 。
(3)A隔绝空气加热发生反应的化学方程式是_______ 。
(4)化合物A具有强还原性,在潮湿空气中可能转化为由两种酸式盐组成的混合物,反应的化学方程式是______ 。

已知:A的焰色为紫色;气体B能使品红溶液褪色;盐C和盐D的组成元素和A相同,且C、D的物质的量之比为1:1。
请回答:
(1)组成A的元素有
(2)A的化学式为
(3)A隔绝空气加热发生反应的化学方程式是
(4)化合物A具有强还原性,在潮湿空气中可能转化为由两种酸式盐组成的混合物,反应的化学方程式是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】连二亚硫酸钠(Na2S2O4,俗称保险粉)广泛用于纺织工业的还原性染色清洗、印花等,其是一种淡黄色粉末,易溶于水,难溶于乙醇。实验室用锌粉法制备Na2S2O4的流程及实验装置(夹持及加热装置已略)如图所示。
(1)装有NaOH溶液的仪器名称是___________ ;通SO2前先向三口烧瓶中通入N2的目的是___________ ;纯化SO2时需通过盛有___________ 的洗气装置,再通过浓硫酸。
(2)步骤Ⅱ发生反应的化学方程式为___________ 。
(3)下列说法不正确 的是___________(填标号)。
(4)加入NaCl盐析并冷却至室温后的后续处理包括过滤、蒸馏水洗涤、乙醇洗涤、干燥,其中用乙醇洗涤的目的是___________ 。
(5)准确称取产品mg于烧杯中,加入20.00mL中性甲醛溶液,搅拌至产品完全溶解
(Na2S2O4+2HCHO+H2O=NaHSO3·CH2O+NaHSO2·CH2O),加水配成250mL溶液,移取25.00mL于锥形瓶中,酸化后用cmol·L-1I2标准溶液滴定(滴定反应:NaHSO2·CH2O+2I2+2H2O=NaHSO4+4HI+HCHO),接近终点时加入淀粉作指示剂,继续滴定至终点。平行滴定三次,平均消耗I2标准溶液VmL。产品中Na2S2O4的质量分数为___________ (列出含m、c、V的表达式即可)。


(1)装有NaOH溶液的仪器名称是
(2)步骤Ⅱ发生反应的化学方程式为
(3)下列说法
| A.将锌粉和水制成悬浊液可增大反应物的接触面积,提高反应速率 |
| B.图中干燥管中盛放的物质可以是碱石灰 |
| C.步骤Ⅱ反应结束后的分离操作需要用到的玻璃仪器有分液漏斗、玻璃棒、烧杯 |
| D.步骤I于35~45℃条件下反应,应选用水浴加热的方式控制温度 |
(4)加入NaCl盐析并冷却至室温后的后续处理包括过滤、蒸馏水洗涤、乙醇洗涤、干燥,其中用乙醇洗涤的目的是
(5)准确称取产品mg于烧杯中,加入20.00mL中性甲醛溶液,搅拌至产品完全溶解
(Na2S2O4+2HCHO+H2O=NaHSO3·CH2O+NaHSO2·CH2O),加水配成250mL溶液,移取25.00mL于锥形瓶中,酸化后用cmol·L-1I2标准溶液滴定(滴定反应:NaHSO2·CH2O+2I2+2H2O=NaHSO4+4HI+HCHO),接近终点时加入淀粉作指示剂,继续滴定至终点。平行滴定三次,平均消耗I2标准溶液VmL。产品中Na2S2O4的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有___ 。
(2)磷精矿粉酸浸时发生反应:2Ca5(PO4)3(OH)+3H2O+10H2SO4 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4___ H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,___ 。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__ 。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:___ 。

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42-残留,加入BaCO3可进一步提高硫的脱除率,其离子方程式是__ 。

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有
(2)磷精矿粉酸浸时发生反应:2Ca5(PO4)3(OH)+3H2O+10H2SO4
 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4①该反应体现出酸性关系:H3PO4
②结合元素周期律解释①中结论:P和S电子层数相同,
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42-残留,加入BaCO3可进一步提高硫的脱除率,其离子方程式是
您最近一年使用:0次
【推荐2】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A原子的电子只有一种自旋取向,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10电子分子,B、C处于同一周期,两者可以形成许多种共价化合物,C、F处于同一主族,B原子最外p能级上的电子处于半充满状态,C的最外层电子数是内层电子数的3倍,E的最外层电子数比最内层电子数多1。元素H原子M能层为全充满状态,且核外只有一个未成对电子的某金属元素,回答下列问题:
(1)E元素基态原子的简化电子排布式为____ 。F元素基态原子的价电子排布图为____ 。
(2)F、G元素对应的最高价含氧酸中酸性较强的化学式为___ 。离子半径:D+___ (填“<”“>”或“=”)B3-。
(3)元素C的简单气态氢化物的沸点____ (填“高于”或“低于”)元素F的简单气态氢化物的沸点,其主要原因是____ 。
(4)元素C与氟元素相比,非金属性较强的是____ (用元素符号表示),下列表述中能证明这一事实的是____ (填序号字母)。
a.常温下氟气的颜色比C单质的颜色深 b.氟气与C的氢化物剧烈反应,产生C的单质
c.氟与C形成的化合物中C元素呈正价态 d.比较两元素的单质与氢气化合时得电子的数目
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为____ 。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:____ 。
(6)E元素原子的第一电离能____ 镁(填“>”“<”或“=”),镁燃烧时会产生耀眼的白光,原因是____ 。
(7)元素H的原子核外电子有____ 种空间运动状态,化合物HC在加热条件下容易转化为H2C,从原子结构的角度解释原因____ 。
(1)E元素基态原子的简化电子排布式为
(2)F、G元素对应的最高价含氧酸中酸性较强的化学式为
(3)元素C的简单气态氢化物的沸点
(4)元素C与氟元素相比,非金属性较强的是
a.常温下氟气的颜色比C单质的颜色深 b.氟气与C的氢化物剧烈反应,产生C的单质
c.氟与C形成的化合物中C元素呈正价态 d.比较两元素的单质与氢气化合时得电子的数目
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为
(6)E元素原子的第一电离能
(7)元素H的原子核外电子有
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐3】Ⅰ、前20号元素A、B、C、D,其中A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)C在周期表中的位置__________________________ ;
(2)B 元素的原子结构示意图____________________________ ;
(3)化合物D2C的电子式______________________________ ;
(4)B最简单气态氢化物与最简单的有机物的稳定性强弱关系(用相应的化学式表示):____ > ____ ;
(5)C、D离子的半径大小关系为C______ D (填:>、=、<);
(6)B的氢化物与B的最高价氧化物对应水化物反应的生成物中含有的的化学键有__________ 填选项)。
A、只含离子键 B、既有离子键又有共价键
C、只含有共价键 D、既有极性共价键又有非极性共价键
Ⅱ、利用下图装置来验证同主族元素非金属性的变化规律:
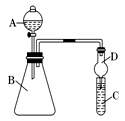
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾溶液,观察到C中溶液现象是:___________ ,即可证明。干燥管D的作用是___________________ 。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用_________________ 溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中______________ 的现象。但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,因此应在B、D之间增加一个盛有足量__________ 的洗气装置(选填下列字母)
A.浓盐酸 B.浓NaOH溶液 C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
(1)C在周期表中的位置
(2)B 元素的原子结构示意图
(3)化合物D2C的电子式
(4)B最简单气态氢化物与最简单的有机物的稳定性强弱关系(用相应的化学式表示):
(5)C、D离子的半径大小关系为C
(6)B的氢化物与B的最高价氧化物对应水化物反应的生成物中含有的的化学键有
A、只含离子键 B、既有离子键又有共价键
C、只含有共价键 D、既有极性共价键又有非极性共价键
Ⅱ、利用下图装置来验证同主族元素非金属性的变化规律:

(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾溶液,观察到C中溶液现象是:
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中
A.浓盐酸 B.浓NaOH溶液 C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】锆产品广泛用于陶瓷、化工、电子等行业。我国是氧氯化锆的主要生产和出口国,产能占世界总产能的 以上。用
以上。用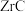 (杂质主要含C和
(杂质主要含C和 )生产ZrOCl2·8H2O的工艺流程如图所示:
)生产ZrOCl2·8H2O的工艺流程如图所示:
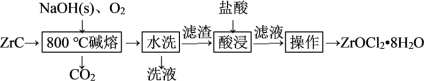
已知:Ⅰ.Na2ZrO3不溶于水,易溶于无机酸。
Ⅱ.ZrOCl2·8H2O的溶解度随温度升高和酸度降低而升高。
回答下列问题:
(1)“碱熔”前,对ZrC进行机械粉碎的目的是___________ 。
(2)“碱熔”时,固体 与ZrC的混合物应放在
与ZrC的混合物应放在___________ 质坩埚中进行煅烧。煅烧过程中,生成Na2ZrO3的化学方程式为___________ 。“碱熔”过程中,配料比 与
与 的质量比
的质量比 对锆转化率的影响如表。最适宜的配料比为
对锆转化率的影响如表。最适宜的配料比为___________ 。
(3)“水洗”的目的是___________ 。
(4)“酸浸”时,滤渣中的Na2ZrO3转化为可溶性的ZrOCl2,以ZrO2+的形式存在于溶液中,其离子方程式为___________ 。
(5)用EDTA可快速测定酸浸液中锆的含量,其操作步骤如下:
①用移液管吸取 酸浸液于
酸浸液于 锥形瓶中,加水
锥形瓶中,加水 ;
;
②以 的盐酸调节溶液
的盐酸调节溶液 范围在ZrO2+,加
范围在ZrO2+,加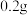 盐酸羟胺,加热煮沸;
盐酸羟胺,加热煮沸;
③加 滴二甲酚橙,趁热用
滴二甲酚橙,趁热用 的EDTA标准溶液进行滴定,EDTA与ZrO2+按
的EDTA标准溶液进行滴定,EDTA与ZrO2+按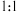 的比例进行螯合;
的比例进行螯合;
④直至溶液由紫红色变为亮黄色且 保持不变,即为终点。滴定过程中消耗
保持不变,即为终点。滴定过程中消耗 的相关数据如图。
的相关数据如图。
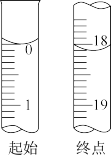
请根据相关数据,计算酸浸液中锆的含量 以
以 计
计 为
为 ___________ mg·mL-1保留两位小数 。
。
(6)为减少产品损失,“操作”中的洗涤液最好选用___________ 。
 以上。用
以上。用 (杂质主要含C和
(杂质主要含C和 )生产ZrOCl2·8H2O的工艺流程如图所示:
)生产ZrOCl2·8H2O的工艺流程如图所示: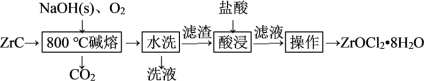
已知:Ⅰ.Na2ZrO3不溶于水,易溶于无机酸。
Ⅱ.ZrOCl2·8H2O的溶解度随温度升高和酸度降低而升高。
回答下列问题:
(1)“碱熔”前,对ZrC进行机械粉碎的目的是
(2)“碱熔”时,固体
 与ZrC的混合物应放在
与ZrC的混合物应放在 与
与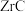 的质量比
的质量比 对锆转化率的影响如表。最适宜的配料比为
对锆转化率的影响如表。最适宜的配料比为| 配料比 | 1.0 | 1.1 | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 |
| 转化率/% | 84.02 | 89.07 | 91.97 | 93.73 | 99.06 | 99.12 | 99.11 |
(3)“水洗”的目的是
(4)“酸浸”时,滤渣中的Na2ZrO3转化为可溶性的ZrOCl2,以ZrO2+的形式存在于溶液中,其离子方程式为
(5)用EDTA可快速测定酸浸液中锆的含量,其操作步骤如下:
①用移液管吸取
 酸浸液于
酸浸液于 锥形瓶中,加水
锥形瓶中,加水 ;
;②以
 的盐酸调节溶液
的盐酸调节溶液 范围在ZrO2+,加
范围在ZrO2+,加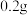 盐酸羟胺,加热煮沸;
盐酸羟胺,加热煮沸;③加
 滴二甲酚橙,趁热用
滴二甲酚橙,趁热用 的EDTA标准溶液进行滴定,EDTA与ZrO2+按
的EDTA标准溶液进行滴定,EDTA与ZrO2+按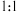 的比例进行螯合;
的比例进行螯合;④直至溶液由紫红色变为亮黄色且
 保持不变,即为终点。滴定过程中消耗
保持不变,即为终点。滴定过程中消耗 的相关数据如图。
的相关数据如图。
请根据相关数据,计算酸浸液中锆的含量
 以
以 计
计 为
为  。
。(6)为减少产品损失,“操作”中的洗涤液最好选用
您最近一年使用:0次
【推荐2】偏钒酸镁在化工“新型材料”光电领域有着重要的用途。以硼泥[主要成分是MgO(52.12%)还有Fe2O3、FeO、Al2O3、SiO2等杂质]为原料设计制备偏钒酸镁的生产工艺如图所示:
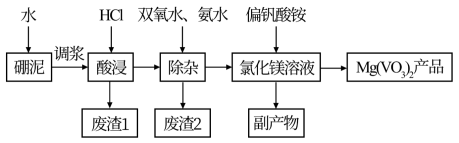
回答下列问题:
(1)Mg(VO3)2中V的化合价为___________ ,副产物的电子式为_________________ 。
(2)酸浸时,反应温度需控制在80℃,在实验室可采取的措施为_____________________________ 。写出“酸浸”后溶液中存在的金属阳离子_________ ,废渣1可用于制作_____________________ ,该物质在信息传输中具有重要应用。
(3)“除杂”过程加入双氧水的目的是________________________________________ (用离子方程式表示)。此过程中使Fe3+、Al3+浓度均小于1×10-6 mol·L-1,在室温下需调节pH ____________ (已知Ksp[Fe(OH)3] =1×10-39,Ksp [Al(OH)3]=1×10-33, pH=9.3时,Mg2+开始沉淀]。
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作:___________________________________ 。
(5)偏钒酸铵可由VOSO4溶液中加入氯酸钾将其氧化,然后用氨水调节pH即可制得,写出VO2+被氯酸钾氧化的离子方程式_______________________________________ 。
(6)现用at硼泥生产Mg(VO3)2,若生产过程的产率为b%,则能生产出Mg(VO3)2产品的质量为_________ t(用含a、b的代数式表示)。

回答下列问题:
(1)Mg(VO3)2中V的化合价为
(2)酸浸时,反应温度需控制在80℃,在实验室可采取的措施为
(3)“除杂”过程加入双氧水的目的是
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作:
(5)偏钒酸铵可由VOSO4溶液中加入氯酸钾将其氧化,然后用氨水调节pH即可制得,写出VO2+被氯酸钾氧化的离子方程式
(6)现用at硼泥生产Mg(VO3)2,若生产过程的产率为b%,则能生产出Mg(VO3)2产品的质量为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】某工厂废渣的主要成分为ZnO、PbO、 、CuO、
、CuO、 等(
等( 与
与 性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
(1)“焙烧”产生的气体是___________ (填分子式),该气体的用途是___________ (填一条)。
(2)“氨浸”所得滤液1中的阳离子主要成分为 、
、 ,该步骤温度不宜过高,其原因是
,该步骤温度不宜过高,其原因是___________ ,“沉铜”时发生反应的离子方程式为___________ 。
(3)“滤渣4”的主要成分为___________ (填化学式)。
(4)“滤液3”的主要溶质为 ,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为
,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为___________ 。
(5)“转化”时生成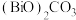 的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为
的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为___________ 。
(6)铁酸铋具有铁电性和反铁磁性,其晶胞结构如图所示,晶胞参数为a pm。___________ 。
②该晶体的密度=___________  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、CuO、
、CuO、 等(
等( 与
与 性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
性质相似),以该工厂废渣为主要原料回收其中金属元素的工艺流程如图所示:
(1)“焙烧”产生的气体是
(2)“氨浸”所得滤液1中的阳离子主要成分为
 、
、 ,该步骤温度不宜过高,其原因是
,该步骤温度不宜过高,其原因是(3)“滤渣4”的主要成分为
(4)“滤液3”的主要溶质为
 ,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为
,以惰性电极电解该滤液可以回收单质Ga,电解时阴极主要电极反应式为(5)“转化”时生成
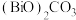 的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为
的同时放出能使澄清石灰水变浑浊的气体,该步骤的化学方程式为(6)铁酸铋具有铁电性和反铁磁性,其晶胞结构如图所示,晶胞参数为a pm。
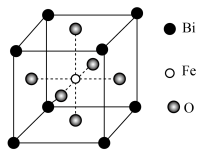
②该晶体的密度=
 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】制备乙炔的电石渣对环境污染极为严重,因此需要对水体进行净化处理。现取500mL电石渣废水(阳离子主要为Ca2+),测定水质的数据如下表所示。
注:SS表示固体悬浮物
模拟工业处理流程如下:
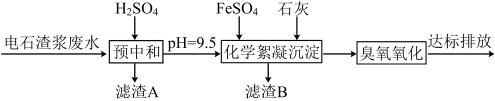
已知:i.常温时CaSO4微溶于水; ii.溶解度: CaSO4>Fe(OH)2>FeS。
(1)①采用20%的硫酸对废水进行预中和处理,pH变化如下图所示。硫酸的用量和废水中固体悬浮物(SS)含量的关系是_______ 。

②废水中SS含量随时间变化如下表所示。
为降低成本,减少硫酸投加量的最好办法是_______ 。
③滤渣A的主要成分有SS和_______ 。
(2)根据表中数据,回答下列问题。
①化学絮凝沉淀过程中,加入FeSO4发生反应的离子方程式是______ 。
②熟石灰能促进沉淀的生成,结合离子方程式,从平衡角度分析其原因是_______ 。
(3)用臭氧进一步处理废水中的氰化物和残留硫化物,若将500mL废水中的CN-完全氧化成N2和CO2,转移______ mol e-。
项目 | pH | S2-(mg/L) | CN-(mg/L) | SS(mg/L) |
平均 | 14 | 1000 | 5.2 | 2500 |
模拟工业处理流程如下:

已知:i.常温时CaSO4微溶于水; ii.溶解度: CaSO4>Fe(OH)2>FeS。
(1)①采用20%的硫酸对废水进行预中和处理,pH变化如下图所示。硫酸的用量和废水中固体悬浮物(SS)含量的关系是

②废水中SS含量随时间变化如下表所示。
| 静置时间(h) | 1 | 2 | 3 | 4 | 5 | 6 | 24 |
| SS含量(mg/L) | 2500 | 1800 | 1300 | 900 | 820 | 800 | 780 |
③滤渣A的主要成分有SS和
(2)根据表中数据,回答下列问题。
不同熟石灰投加量下的废水处理效果 | ||||
加药量(g) | 分析结果 | |||
FeSO4 | Ca(OH)2 | pH | S2-(mg/L) | SS(mg/L) |
4.8 | 0.50 | 5.5 | 15 | >250 |
0.85 | 6.8 | 3.0 | <50 | |
1.15 | 9.3 | 0.95 | <50 | |
1.25 | 10.5 | 0.89 | <50 | |
②熟石灰能促进沉淀的生成,结合离子方程式,从平衡角度分析其原因是
(3)用臭氧进一步处理废水中的氰化物和残留硫化物,若将500mL废水中的CN-完全氧化成N2和CO2,转移
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】工农业废水以及生活污水的大量排放造成水体污染。工业上处理水体中NO3-的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验过程如下。
(1)先用稀硫酸洗去废铁屑表面的铁锈,然后用蒸馏水将铁屑洗净。
①除锈反应的离子方程式是_______________________ 。
②判断铁屑洗净的方法是______________________ 。
(2)将KNO3溶液的pH调至2.5。
①从氧化还原的角度分析调制溶液pH的原因是________________ 。
②研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是________________ 。
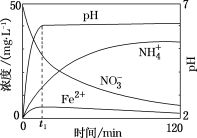
(3)将上述处理过的足量铁屑投入⑵的溶液中。下图表示该反应过程中,体系内相关离子浓度、pH随时间变化关系。t1时刻前该反应的离子方程式是______________ 。
(4)工业上可用纳米铁粉处理地下水中的污染物。一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为_____________ 。
(5)铁炭混合物(铁屑和活性炭的混合物)也可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如下图所示:
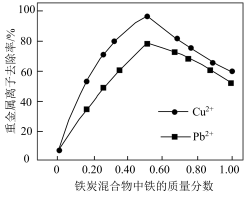
①当铁炭混合物中铁的质量分数为0时,也能去除少量的Cu2+和Pb2+,其原因是____________ 。
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是___________ 。
(1)先用稀硫酸洗去废铁屑表面的铁锈,然后用蒸馏水将铁屑洗净。
①除锈反应的离子方程式是
②判断铁屑洗净的方法是
(2)将KNO3溶液的pH调至2.5。
①从氧化还原的角度分析调制溶液pH的原因是
②研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是
(3)将上述处理过的足量铁屑投入⑵的溶液中。下图表示该反应过程中,体系内相关离子浓度、pH随时间变化关系。t1时刻前该反应的离子方程式是

(4)工业上可用纳米铁粉处理地下水中的污染物。一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B(OH)4-,其离子方程式为
(5)铁炭混合物(铁屑和活性炭的混合物)也可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如下图所示:

①当铁炭混合物中铁的质量分数为0时,也能去除少量的Cu2+和Pb2+,其原因是
②当铁炭混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】湿法炼锌工业废水中主要阳离子有 。废水除铊的工艺流程如下。
。废水除铊的工艺流程如下。
① 能够在
能够在 为
为 的范围内以离子态稳定存在,不易与
的范围内以离子态稳定存在,不易与 形成沉淀
形成沉淀
② 易与废水中的有机物分子形成稳定的配合物,为了简便,通常用
易与废水中的有机物分子形成稳定的配合物,为了简便,通常用 表示
表示
③部分物质的
④排放标准:Tl的含量低于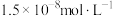
(1)已知“氧化”步骤中 被还原为
被还原为 且
且 氧化不彻底,请写出该反应的离子方程式:
氧化不彻底,请写出该反应的离子方程式:___________ 。
(2)“预中和”步骤,加 至溶液的
至溶液的 约为7,可减少“硫化”步骤中
约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少___________ (填化学式)污染物的生成。
(3)“硫化”步骤的主要目的是除去___________ (填离子符号)。
(4)根据 计算,若使溶液中
计算,若使溶液中 的含量低于排放标准,溶液的
的含量低于排放标准,溶液的 应大于
应大于___________ ,但是实际工艺流程需在“中和”步骤加 至溶液的
至溶液的 约为9,此时仍只有
约为9,此时仍只有 左右的铊离子能得到去除,其可能原因是
左右的铊离子能得到去除,其可能原因是___________ 。
(5)“脱钙”步骤的目的是___________ 。
(6)“离子交换”步骤中可用普鲁士蓝{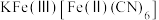 }(其摩尔质量为
}(其摩尔质量为 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的 如下[
如下[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。若该晶体的密度为
部分)的体心]。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为___________  (设
(设 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。
 。废水除铊的工艺流程如下。
。废水除铊的工艺流程如下。
①
 能够在
能够在 为
为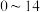 的范围内以离子态稳定存在,不易与
的范围内以离子态稳定存在,不易与 形成沉淀
形成沉淀②
 易与废水中的有机物分子形成稳定的配合物,为了简便,通常用
易与废水中的有机物分子形成稳定的配合物,为了简便,通常用 表示
表示③部分物质的

| 物质 |  |  |  |  |
 | 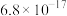 |  |  |  |
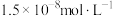
(1)已知“氧化”步骤中
 被还原为
被还原为 且
且 氧化不彻底,请写出该反应的离子方程式:
氧化不彻底,请写出该反应的离子方程式:(2)“预中和”步骤,加
 至溶液的
至溶液的 约为7,可减少“硫化”步骤中
约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少(3)“硫化”步骤的主要目的是除去
(4)根据
 计算,若使溶液中
计算,若使溶液中 的含量低于排放标准,溶液的
的含量低于排放标准,溶液的 应大于
应大于 至溶液的
至溶液的 约为9,此时仍只有
约为9,此时仍只有 左右的铊离子能得到去除,其可能原因是
左右的铊离子能得到去除,其可能原因是(5)“脱钙”步骤的目的是
(6)“离子交换”步骤中可用普鲁士蓝{
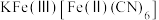 }(其摩尔质量为
}(其摩尔质量为 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的 如下[
如下[ 未标出,占据四个互不相邻的小立方体(晶胞的
未标出,占据四个互不相邻的小立方体(晶胞的 部分)的体心]。若该晶体的密度为
部分)的体心]。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为 (设
(设 为阿伏伽德罗常数的值)。
为阿伏伽德罗常数的值)。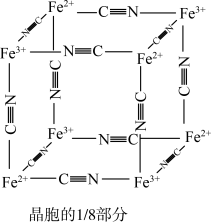
您最近一年使用:0次



