已知醋酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH⇌CH3COO-+H+ K=1.75×10-5。
(1)计算0.01mol/L的CH3COOH溶液的pH=_________ 。(已知lg1.75=0.24)
(2)25℃,将0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后溶液的pH=10,则该混合溶液中由水电离出的c(OH-)=___________ mol/L,写出该混合溶液中下列算式的精确结果(不能做近似计算),c(Na+)-c(CH3COO-)=______________ mol/L。
(3)下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是___________ 。
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量镁粉 f.加入少量0.10 mol·L-1的NaOH溶液
(4)SOCl2是一种液态化合物,向盛有10mL水的锥形瓶中,小心滴加8~10滴SOCl2,可观察到剧烈反应,液面上有雾形成,产生可以使品红溶液褪色的气体,往溶液中滴加AgNO3溶液,有白色沉淀析出,请写出SOCl2与水反应的化学方程式______________________________ ,蒸干AlCl3溶液不能得到无水AlCl3,用SOCl2和AlCl3·6H2O混合加热可以得到无水AlCl3,试解释原因______________________
(5)常温下,反应 的平衡常数K=
的平衡常数K=__________ 。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
(1)计算0.01mol/L的CH3COOH溶液的pH=
(2)25℃,将0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后溶液的pH=10,则该混合溶液中由水电离出的c(OH-)=
(3)下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量镁粉 f.加入少量0.10 mol·L-1的NaOH溶液
(4)SOCl2是一种液态化合物,向盛有10mL水的锥形瓶中,小心滴加8~10滴SOCl2,可观察到剧烈反应,液面上有雾形成,产生可以使品红溶液褪色的气体,往溶液中滴加AgNO3溶液,有白色沉淀析出,请写出SOCl2与水反应的化学方程式
(5)常温下,反应
 的平衡常数K=
的平衡常数K=
更新时间:2017-10-28 13:19:01
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】现有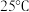 时
时 的
的 溶液
溶液 ,欲用以下几种方法将其
,欲用以下几种方法将其 调为11,回答下列问题。(假设稀溶液混合后的总体积等于两溶液的体积之和)
调为11,回答下列问题。(假设稀溶液混合后的总体积等于两溶液的体积之和)
(1)此 的
的 溶液中由水电离产生的
溶液中由水电离产生的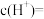
___________ ;
(2)加水稀释,需加水的体积为___________  ;
;
(3)加入 的盐酸,需加盐酸的体积为
的盐酸,需加盐酸的体积为___________  ;
;
(4)加入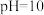 的
的 溶液,需加
溶液,需加 溶液的体积为
溶液的体积为___________  ;
;
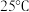 时
时 的
的 溶液
溶液 ,欲用以下几种方法将其
,欲用以下几种方法将其 调为11,回答下列问题。(假设稀溶液混合后的总体积等于两溶液的体积之和)
调为11,回答下列问题。(假设稀溶液混合后的总体积等于两溶液的体积之和)(1)此
 的
的 溶液中由水电离产生的
溶液中由水电离产生的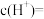
(2)加水稀释,需加水的体积为
 ;
;(3)加入
 的盐酸,需加盐酸的体积为
的盐酸,需加盐酸的体积为 ;
;(4)加入
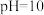 的
的 溶液,需加
溶液,需加 溶液的体积为
溶液的体积为 ;
;
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】25℃时将pH=8的Ba(OH)2溶液稀释1000倍,则稀释后的溶液中c(Ba2+)与c(OH-)之比为_______
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】现有常温下的4种溶液:①0.01 mol·L-1 CH3COOH溶液;②0.01 mol·L-1 HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。
回答下列问题:
(1)4种溶液中水的电离程度最大的是_______ (填序号);
(2)将4种溶液同等程度稀释10倍后,溶液pH由大到小的顺序是_______ (填序号);
(3)若将①④混合后所得溶液中的c(CH3COO-)>c(H+),则下列说法正确的是_______ ;
A.溶液一定呈酸性B.溶液一定呈碱性
C.溶液一定呈中性D.溶液可能呈酸性、中性或碱性
(4)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②_______ ③(填“>”“<”或“=”)。
(5)若将②④混合后所得溶液的pH=10,则消耗②和④溶液的体积比:V(HCl)∶V(NaOH)=_______ ;
(6)若将②稀释106倍所得溶液中c(H+)∶c(Cl-)=_______ ;
回答下列问题:
(1)4种溶液中水的电离程度最大的是
(2)将4种溶液同等程度稀释10倍后,溶液pH由大到小的顺序是
(3)若将①④混合后所得溶液中的c(CH3COO-)>c(H+),则下列说法正确的是
A.溶液一定呈酸性B.溶液一定呈碱性
C.溶液一定呈中性D.溶液可能呈酸性、中性或碱性
(4)若将②③混合后所得溶液的pH=7,则消耗溶液的体积:②
(5)若将②④混合后所得溶液的pH=10,则消耗②和④溶液的体积比:V(HCl)∶V(NaOH)=
(6)若将②稀释106倍所得溶液中c(H+)∶c(Cl-)=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】某酸HA是一元弱酸,25℃时的电离平衡常数Ka=4.0×10-8。
(1)写出该酸的电离方程式___ ,其电离平衡常数表达式Ka=____ 。
(2)25℃时,向1mol·L-1HA溶液中加入1 mol·L-1 盐酸,会____ (“抑制”或“促进”)HA的电离,c(H+)____ (填“增大”、“减小”或“不变”), 电离平衡常数Ka___ (填“增大”、“减小”或“不变”)。
(3)25℃时,若HA的起始浓度为0.01mol·L-1,则平衡时c(H+)=___ mol/L。
(1)写出该酸的电离方程式
(2)25℃时,向1mol·L-1HA溶液中加入1 mol·L-1 盐酸,会
(3)25℃时,若HA的起始浓度为0.01mol·L-1,则平衡时c(H+)=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡:
NH3+H2O NH3·H2O
NH3·H2O NH4++OH-
NH4++OH-
(1)向氨水中加入MgCl2固体时,平衡向______ 反应方向移动,现象为____________ 。
(2)向氨水中通入HCl,平衡向_______ 反应方向移动,此时溶液中浓度减小的粒子有___________ 、___________ 、___________ 。
(3)向浓氨水中加入少量碱石灰,平衡向______ 反应方向移动,溶液pH值_________ (填“增大”、“减小”或“不变”),现象为______________________ 。实验室常利用该原理制备氨气,在此过程中碱石灰的另一个作用是_______ 。
NH3+H2O
 NH3·H2O
NH3·H2O NH4++OH-
NH4++OH-(1)向氨水中加入MgCl2固体时,平衡向
(2)向氨水中通入HCl,平衡向
(3)向浓氨水中加入少量碱石灰,平衡向
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】根据下列化合物:①NaOH;②H2SO4;③CH3COOH;④NaHCO3; ⑤CH3COONa;⑥NH4Cl;⑦CH3COONH4;⑧NH4HSO4;⑨NH3·H2O;⑩Al2(SO4)3,请回答下列问题:
(1)若浓度均为0.1 mol/L、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_____ n(填“>”、“<”或“=”)。
(2)已知水存在如下平衡: ,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是
,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是________
A.向水中加入NaHSO4固体 B.向水中加NaHCO3固体
C.加热至100℃ [其中c(H+)=1×10-6 mol/L] D.向水中加入NH4Cl固体
(3) NH4Cl 溶液显酸性的原因是__________ (用离子方程式表示)。
(4)泡沫灭火器的原理是_________ (用离子方程式表示)。
(5)物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH 浓度由大到小的顺序是
浓度由大到小的顺序是__________ (填序号)。
(1)若浓度均为0.1 mol/L、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m
(2)已知水存在如下平衡:
 ,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是
,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是A.向水中加入NaHSO4固体 B.向水中加NaHCO3固体
C.加热至100℃ [其中c(H+)=1×10-6 mol/L] D.向水中加入NH4Cl固体
(3) NH4Cl 溶液显酸性的原因是
(4)泡沫灭火器的原理是
(5)物质的量浓度相同的⑥、⑦、⑧、⑨四种稀溶液中,NH
 浓度由大到小的顺序是
浓度由大到小的顺序是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】(1)取 的
的 溶液,加入
溶液,加入 的氨水,测得溶液导电性变化如图所示,则加入氨水前
的氨水,测得溶液导电性变化如图所示,则加入氨水前 的电离度(分子电离的百分数)为
的电离度(分子电离的百分数)为________ ,加入 的氨水,溶液导电能力增强的原因:
的氨水,溶液导电能力增强的原因:________________________________________________ 。

(2)将醋酸铵固体溶于水,配成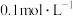 溶液,已知醋酸的电离平衡常数为
溶液,已知醋酸的电离平衡常数为 ,一水合氨的电离平衡常数为
,一水合氨的电离平衡常数为 ,实验发现两者近似相等,请写出醋酸铵水解的离子方程式:
,实验发现两者近似相等,请写出醋酸铵水解的离子方程式:________________________________ ,水解平衡常数的表达式:________________ (用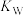 、
、 与
与 表示)。
表示)。
 的
的 溶液,加入
溶液,加入 的氨水,测得溶液导电性变化如图所示,则加入氨水前
的氨水,测得溶液导电性变化如图所示,则加入氨水前 的电离度(分子电离的百分数)为
的电离度(分子电离的百分数)为 的氨水,溶液导电能力增强的原因:
的氨水,溶液导电能力增强的原因:
(2)将醋酸铵固体溶于水,配成
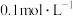 溶液,已知醋酸的电离平衡常数为
溶液,已知醋酸的电离平衡常数为 ,一水合氨的电离平衡常数为
,一水合氨的电离平衡常数为 ,实验发现两者近似相等,请写出醋酸铵水解的离子方程式:
,实验发现两者近似相等,请写出醋酸铵水解的离子方程式: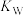 、
、 与
与 表示)。
表示)。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】根据要求填写下列空白:
I.在氨水中存在下列电离平衡:NH3·H2O
 +OH-。
+OH-。
(1)下列情况能引起电离平衡正向移动的有_______ (填字母,下同)。
①加NH4Cl固体 ②加NaOH溶液 ③通入HCl ④加CH3COOH溶液 ⑤加水 ⑥加压
a.①③⑤ b.①④⑥ c.③④⑤ d.①②④
(2)在含有酚酞的0.1 mol· L-1氨水中加入少量的NH4Cl晶体,溶液颜色
a.变蓝色 b.变深 c.变浅 d.不变
(3)增大 的浓度而不增大OH-的浓度,应采取的措施是
的浓度而不增大OH-的浓度,应采取的措施是 _______ (填字母)。
a.适当升高温度 b.加入NH4Cl固体 c.通入NH3 d.加入少量浓盐酸
(4)在一定温度下,用水缓慢稀释1 mol·L-1氨水的过程中,溶液中随着水量的增加,
_______ (填“增大”“减小”或“不变”,下同),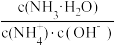
_______ 。
II.常温下,pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
(5)①加水稀释10倍后,醋酸溶液中的c(H+)_______ (填“>”“= ”或“<”,下同)盐酸溶液中的c(H+)。
②加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸_______ 盐酸。
③使温度都升高20°C ,溶液中c(H+):醋酸_______ 盐酸。
I.在氨水中存在下列电离平衡:NH3·H2O

 +OH-。
+OH-。(1)下列情况能引起电离平衡正向移动的有
①加NH4Cl固体 ②加NaOH溶液 ③通入HCl ④加CH3COOH溶液 ⑤加水 ⑥加压
a.①③⑤ b.①④⑥ c.③④⑤ d.①②④
(2)在含有酚酞的0.1 mol· L-1氨水中加入少量的NH4Cl晶体,溶液颜色
a.变蓝色 b.变深 c.变浅 d.不变
(3)增大
 的浓度而不增大OH-的浓度,应采取的措施是
的浓度而不增大OH-的浓度,应采取的措施是 a.适当升高温度 b.加入NH4Cl固体 c.通入NH3 d.加入少量浓盐酸
(4)在一定温度下,用水缓慢稀释1 mol·L-1氨水的过程中,溶液中随着水量的增加,

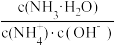
II.常温下,pH相同、体积相同的醋酸和盐酸两种溶液,采取以下措施:
(5)①加水稀释10倍后,醋酸溶液中的c(H+)
②加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积:醋酸
③使温度都升高20°C ,溶液中c(H+):醋酸
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】水溶液广泛存在于生命体及其赖以生存的环境中。其中,弱电解质的电离平衡和盐类的水解平衡都与生命活动、工农业生产息息相关。请回答下列问题:
(1)某温度下,纯水中的c(H+)=4.0×10-7mol·L-1,此时c(OH-)=______ mol·L-1,这种水显_____ (填“酸”“碱”或“中”)性;若温度不变,向水中滴入稀盐酸,用pH试纸测得溶液的pH=3,则溶液中c(OH-)=___________ mol·L-1。
(2)25 ℃时,在等体积的①pH=1的H2SO4溶液、②0.5 mol·L-1的Ba(OH)2溶液、③pH=5的NH4Cl溶液中,发生电离的水的物质的量之比是___________ 。
(3)已知某二元酸H2A在水溶液中存在以下电离: H2A = H++HA-、HA- H++A2-,则0.1 mol·L-1 H2A溶液中所有离子浓度的大小顺序为
H++A2-,则0.1 mol·L-1 H2A溶液中所有离子浓度的大小顺序为___________ 。
(4)利用TiCl4的水解制备TiO2,反应的化学方程式为___________ ,制备时为使反应趋于完全,采取的措施是___________ ,所得的TiO2·xH2O经___________ 得到TiO2。
(1)某温度下,纯水中的c(H+)=4.0×10-7mol·L-1,此时c(OH-)=
(2)25 ℃时,在等体积的①pH=1的H2SO4溶液、②0.5 mol·L-1的Ba(OH)2溶液、③pH=5的NH4Cl溶液中,发生电离的水的物质的量之比是
(3)已知某二元酸H2A在水溶液中存在以下电离: H2A = H++HA-、HA-
 H++A2-,则0.1 mol·L-1 H2A溶液中所有离子浓度的大小顺序为
H++A2-,则0.1 mol·L-1 H2A溶液中所有离子浓度的大小顺序为(4)利用TiCl4的水解制备TiO2,反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】铁、钴(Co)、镍(Ni)是同族元素,主要化合价均为+2、+3价,都是较活泼的金属,它们的化合物在工业上有重要的应用.
(1)配制FeSO4溶液时,需加入稀硫酸,其目的是_________________________
(2)写出CoCl2与氯水反应的化学方程式______________________________
(3) Co2+和Fe3+均可与KSCN溶液发生相似的反应,向CoCl2溶液中加入KSCN溶液,生成某种蓝色离子,该离子中钴元素的质量分数约为20%。则该离子的化学式为__________________ 。
(4)碳酸镍可用于电镀、陶瓷器着色等。镍矿渣中镍元素的主要存在形式是Ni(OH)2和NiS,从镍矿渣出发制备碳酸镍的反应如下:
先向镍矿渣中加入稀硫酸和NaClO3浸取出Ni2+,反应的离子方程式有①_____________________ ②NiS+ ClO3-+H+-Ni2++S+Cl-+H2O(未配平),此反应中还原产物与氧化产物的物质的量比为_________ 。再加入Na2CO3溶液沉镍,即制得碳酸镍,检验Ni2+是否沉淀完全的方法_____________________________________
(1)配制FeSO4溶液时,需加入稀硫酸,其目的是
(2)写出CoCl2与氯水反应的化学方程式
(3) Co2+和Fe3+均可与KSCN溶液发生相似的反应,向CoCl2溶液中加入KSCN溶液,生成某种蓝色离子,该离子中钴元素的质量分数约为20%。则该离子的化学式为
(4)碳酸镍可用于电镀、陶瓷器着色等。镍矿渣中镍元素的主要存在形式是Ni(OH)2和NiS,从镍矿渣出发制备碳酸镍的反应如下:
先向镍矿渣中加入稀硫酸和NaClO3浸取出Ni2+,反应的离子方程式有①
您最近一年使用:0次

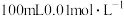 的
的 的
的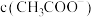 :①
:① 的体积:①
的体积:①

