(1)已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且c(Cl-):c(ClO-)的值与温度高低有关。当n(KOH)=amol时,若某温度下,反应后c(Cl-):c(ClO-)=11,则溶液中c(ClO-):c(ClO3-)=_________________
(2)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5molCuSO4可氧化P的物质的量为________ mol。生成1molCu3P时,参加反应的P的物质的量为________ mol。
(3)一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO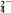 )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 16.0g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V的极小值为
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 16.0g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V的极小值为________ mL。
(4)向一定量的Fe、FeO、Fe3O4的混合物中,加入1 mol/L 硝酸的溶液100 mL,恰好使混合物全部溶解,且放出336 mL(标准状况下)的气体,向所得溶液中加入KSCN溶液,溶液无红色出现;若取相同质量的Fe、FeO、Fe3O4的混合物,加入1 mol/L的稀硫酸溶液,也恰好使混合物完全溶解(假设还原产物唯一),反应后向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的的稀硫酸的体积是__________ mL。
(2)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5molCuSO4可氧化P的物质的量为
(3)一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO
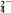 )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 16.0g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V的极小值为
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 16.0g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V的极小值为(4)向一定量的Fe、FeO、Fe3O4的混合物中,加入1 mol/L 硝酸的溶液100 mL,恰好使混合物全部溶解,且放出336 mL(标准状况下)的气体,向所得溶液中加入KSCN溶液,溶液无红色出现;若取相同质量的Fe、FeO、Fe3O4的混合物,加入1 mol/L的稀硫酸溶液,也恰好使混合物完全溶解(假设还原产物唯一),反应后向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的的稀硫酸的体积是
更新时间:2017-11-02 17:54:23
|
相似题推荐
计算题
|
较难
(0.4)
解题方法
【推荐1】0.04molKMnO4固体加热发生分解反应,一段时间后,收集到amol气体,向反应后残留固体中加入足量浓盐酸,又收集到bmol气体,设此时Mn元素全部以Mn2+形式存在溶液中,请回答下列问题:
(1)a+b的取值范围为___ ;
(2)计算若a+b=0.09mol时,KMnO4固体的分解率为___ 。
本题涉及方程式:
2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
K2MnO4+8HCl(浓)=2KCl+MnCl2+2Cl2↑+4H2O
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)a+b的取值范围为
(2)计算若a+b=0.09mol时,KMnO4固体的分解率为
本题涉及方程式:
2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
K2MnO4+8HCl(浓)=2KCl+MnCl2+2Cl2↑+4H2O
MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐2】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。
(1)Cu和Cu2O的混合物中铜的物质的量为________ mol
(2)产生的NO在标准状况下的体积为______ L
(3)硝酸的物质的量浓度为_____________ mol/L
(4)Cu、Cu2O与硝酸反应后剩余HNO3为______ mol
(1)Cu和Cu2O的混合物中铜的物质的量为
(2)产生的NO在标准状况下的体积为
(3)硝酸的物质的量浓度为
(4)Cu、Cu2O与硝酸反应后剩余HNO3为
您最近一年使用:0次
【推荐3】氧化还原反应原理及物质的量的相关计算在生产、生活中应用广泛。
(1)某同学写出以下化学反应方程式(未配平):①NH3+NO→HNO2+H2O,②NO+HNO3→N2O3+H2O,③N2O4+H2O→HNO2+HNO3,其中一定不可能实现的是(填序号)_______ 。
(2)ClO2可用于污水的杀菌和饮用水的净化。KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为 ,此反应的离子方程式为
,此反应的离子方程式为_______ 。
(3)已知亚硝酸钠(NaNO2)可以与氯化铵(NH4Cl)反应生成氮气、氯化钠及其它产物,写出该反应的化学反应方程式_______ 。
(4)一定条件下,当溶液中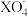 与H2O2物质的量比恰好为2:5时,溶液中
与H2O2物质的量比恰好为2:5时,溶液中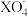 离子被还原为较低价态,则X元素的化合价变为
离子被还原为较低价态,则X元素的化合价变为_______ 。
(5)将不纯的NaOH样品2g(含少量Na2CO3和水),放入50mL2mol/L的盐酸中,充分反应后,溶液呈酸性,中和剩余的酸又用去40mLlmol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为_______ 。
(6)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压,放电管来制取臭氧:
①在臭氧发生装置中装入氧气100mL,经反应最后气体体积变为95mL(体积均在标准状况下测定),则混合气体的密度是_______ g/L(保留一位小数);
②实验室将氧气和臭氧的混合气体0.896L(标准状况),通入盛有20.0g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6g。则原混合气中臭氧的体积分数_______ 。
(1)某同学写出以下化学反应方程式(未配平):①NH3+NO→HNO2+H2O,②NO+HNO3→N2O3+H2O,③N2O4+H2O→HNO2+HNO3,其中一定不可能实现的是(填序号)
(2)ClO2可用于污水的杀菌和饮用水的净化。KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为
 ,此反应的离子方程式为
,此反应的离子方程式为(3)已知亚硝酸钠(NaNO2)可以与氯化铵(NH4Cl)反应生成氮气、氯化钠及其它产物,写出该反应的化学反应方程式
(4)一定条件下,当溶液中
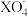 与H2O2物质的量比恰好为2:5时,溶液中
与H2O2物质的量比恰好为2:5时,溶液中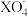 离子被还原为较低价态,则X元素的化合价变为
离子被还原为较低价态,则X元素的化合价变为(5)将不纯的NaOH样品2g(含少量Na2CO3和水),放入50mL2mol/L的盐酸中,充分反应后,溶液呈酸性,中和剩余的酸又用去40mLlmol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为
(6)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压,放电管来制取臭氧:
①在臭氧发生装置中装入氧气100mL,经反应最后气体体积变为95mL(体积均在标准状况下测定),则混合气体的密度是
②实验室将氧气和臭氧的混合气体0.896L(标准状况),通入盛有20.0g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6g。则原混合气中臭氧的体积分数
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐1】为探究化合物A(仅含三种元素,摩尔质量为198g/mol)的组成与性质,设计并完成以下实验:取3.96g化合物A溶于水中,一段时间后全部转化为B(红褐色沉淀)、C(一种碱)和气体单质D(可使带火星的木条复燃),向溶液中加入100mL0.6mol/L稀硫酸,再加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将沉淀洗涤后充分灼烧,得到红棕色固体粉末1.60g;将所得溶液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A所含的元素为____ ,化合物A与H2O反应的离子方程式为:____ 。
(2)化合物A可由FeCl3和KClO在强碱性条件下制得,其反应的离子方程式为:____ 。
(1)化合物A所含的元素为
(2)化合物A可由FeCl3和KClO在强碱性条件下制得,其反应的离子方程式为:
您最近一年使用:0次
【推荐2】请按要求完成下列各题:
(1)黑火药爆炸时发生反应:2KNO3+S+3C═K2S+N2↑+3CO2↑,其中被还原的元素是___ ,被氧化的元素是___ 。
(2)配平以下方程式:___ K2Cr2O7+___ HCl═___ KCl+___ CrCl3+___ Cl2↑+___ H2O
(3)已知19.2gCu与过量的200ml5mol/L稀硝酸充分反应,反应方程式如下,请计算(忽略反应前后溶液体积的变化).
3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O
①转移电子的物质的量为___ mol;标准状况下,产生NO气体的体积为___ mL。
②反应后,NO3-的物质的量浓度为___ mol/L。
(1)黑火药爆炸时发生反应:2KNO3+S+3C═K2S+N2↑+3CO2↑,其中被还原的元素是
(2)配平以下方程式:
(3)已知19.2gCu与过量的200ml5mol/L稀硝酸充分反应,反应方程式如下,请计算(忽略反应前后溶液体积的变化).
3Cu+8HNO3
 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O①转移电子的物质的量为
②反应后,NO3-的物质的量浓度为
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐3】钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物.
(1)钾和硝酸钾反应可制得氧化钾K+KNO3→K2O+N2(未配平),每生成9.4gK2O消耗的还原剂有___________ g
(2)超氧化钾和过氧化钾都能与二氧化碳反应均生成氧气和K2CO3,在医院、矿井、潜水、高空飞行中用作供氧剂.请尝试写出超氧化钾与二氧化碳反应的化学方程式____________ ,为了维持封闭环境气压稳定可以使用超氧化钾和过氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它们的物质的量之比为______
(3)KO2加热至600℃部分分解得到固态混合物 A.6.30g A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),如果产物A只含有两种化合物,写出所有可能组成的化学式组合,并计算A中两种化合物的物质的量之比._________________ 、________________________
(1)钾和硝酸钾反应可制得氧化钾K+KNO3→K2O+N2(未配平),每生成9.4gK2O消耗的还原剂有
(2)超氧化钾和过氧化钾都能与二氧化碳反应均生成氧气和K2CO3,在医院、矿井、潜水、高空飞行中用作供氧剂.请尝试写出超氧化钾与二氧化碳反应的化学方程式
(3)KO2加热至600℃部分分解得到固态混合物 A.6.30g A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),如果产物A只含有两种化合物,写出所有可能组成的化学式组合,并计算A中两种化合物的物质的量之比.
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
【推荐1】氯气是一种重要的化工原料。KClO3与浓盐酸发生反应:
KClO3+6HCl(浓)——KCl+3Cl2↑+3H2O
该反应中氧化剂是_____________ ,还原剂是____________ 。
被氧化的元素和被还原的元素的质量之比为____________ 。
转移1mol电子时,产生标准状况下的Cl2____________ L。
KClO3+6HCl(浓)——KCl+3Cl2↑+3H2O
该反应中氧化剂是
被氧化的元素和被还原的元素的质量之比为
转移1mol电子时,产生标准状况下的Cl2
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
【推荐2】铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生4480 mL的NO2气体和336 mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的NaOH溶液,生成沉淀的质量为多少克?____________________
您最近一年使用:0次

 和0.87g
和0.87g 的固体混和物,加热一段时间后剩余固体为4.81g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A。提示:
的固体混和物,加热一段时间后剩余固体为4.81g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A。提示: 。请计算:
。请计算:

