已知:硼镁矿主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:

回答下列有关问题:
(1)将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为____________________________________ 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是____________ 。
(3)镁-H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+=Mg2++2H2O,则正极反应式为_____________________________ 。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为_____________ (提示:I2+2S2O32-=2I-+S4O62-)(结果保留一位小数)。

回答下列有关问题:
(1)将硼砂溶于热水后,常用稀H2SO4调pH=2~3制取H3BO3,该反应的离子方程式为
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是
(3)镁-H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+=Mg2++2H2O,则正极反应式为
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020 g粗硼制成的BI3完全分解,生成的I2用0.30 mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。该粗硼样品的纯度为
更新时间:2017-11-04 10:35:37
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】回答下列关于N及其化合物的问题:
(1)配制Fe(NO3)2溶液时可否加入少量HNO3抑制Fe2+水解?_______ ,原因是__________________________________________ 。
(2)汽车尾气中含有大量NO2,会导致环境污染,在汽车尾气管装上电化学转化装置在碱性水溶液环境中形成原电池,可部分解除NO2的污染,则该装置的正极反应方程式为_________________________________ ;该装置的负极原料为NH3,当电路中转移8mole-时,负极消耗NH3的质量理论值约为________ ,(保留小数点后一位小数)实际上消耗NH3的量远大于该理论值的原因可能为_________________________________________ 。
(3)NaOH溶液也可解除NO2的污染,该反应的化学方程式为_____________________________ 。
(4)第(3)问反应可产生致癌物质NaNO2,该物质中N元素的化合价为_____ 价,酸性环境中的NaNO2可用H2O2氧化处理,处理过程的离子方程式为___________________ ,若改用O2来氧化,则68g的H2O2相当于O2的质量为____ ;(保留小数点后一位小数)使用H2O2作为氧化剂的优点是________________________________________________ 。
(1)配制Fe(NO3)2溶液时可否加入少量HNO3抑制Fe2+水解?
(2)汽车尾气中含有大量NO2,会导致环境污染,在汽车尾气管装上电化学转化装置在碱性水溶液环境中形成原电池,可部分解除NO2的污染,则该装置的正极反应方程式为
(3)NaOH溶液也可解除NO2的污染,该反应的化学方程式为
(4)第(3)问反应可产生致癌物质NaNO2,该物质中N元素的化合价为
您最近一年使用:0次
【推荐2】五氧化二钒(V2O5)为强氧化剂,易被还原成各种低价氧化物,在工业生产中常用作催化剂,即触媒。实验室以含钒废料(含V2O3、CuO、MnO、SiO2、Al2O3、有机物)为原料制备V2O5的一种流程如图:
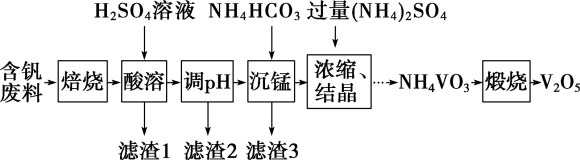
已知Ⅰ.25℃时,难溶电解质的溶度积常数如表所示:
Ⅱ.NH4VO3在水中的溶解度:20℃、4.8 ;60℃、24.2
;60℃、24.2 。
。
回答下列问题:
(1)“焙烧”的目的是___________ 。
(2)“滤渣1”的用途为___________ (写出一种即可)。
(3)滤渣2成分为___________ 。通过列式计算说明,常温下,若“调pH”为6,Cu2+是否沉淀完全___________ 。(溶液中离子浓度小于
 时,认为该离子沉淀完全)
时,认为该离子沉淀完全)
(4)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为___________ 。
(5)滤渣3成分为MnCO3,请写出“沉锰”的离子方程式___________ 。
(6) V2O5最重要的应用是在接触法制硫酸时,作SO2氧化为SO3的催化剂。该催化反应中VO2为中间产物,请用化学方程式表示该催化过程:___________ 、___________ 。

已知Ⅰ.25℃时,难溶电解质的溶度积常数如表所示:
| 难溶电解质 |  |  |  |
| Ksp | 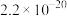 | 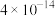 |  |
 ;60℃、24.2
;60℃、24.2 。
。回答下列问题:
(1)“焙烧”的目的是
(2)“滤渣1”的用途为
(3)滤渣2成分为

 时,认为该离子沉淀完全)
时,认为该离子沉淀完全)(4)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为
(5)滤渣3成分为MnCO3,请写出“沉锰”的离子方程式
(6) V2O5最重要的应用是在接触法制硫酸时,作SO2氧化为SO3的催化剂。该催化反应中VO2为中间产物,请用化学方程式表示该催化过程:
您最近一年使用:0次
【推荐3】磁选后的炼铁高钛炉渣,主要成分有TiO2、SiO2、Al2O3、MgO、CaO以及少量的Fe2O3。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
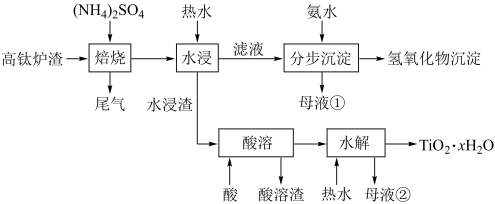
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表,回答下列问题:
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐,Al2O3转化为NH4Al(SO4)2,写出向NH4Al(SO4)2中加入过量氨水的离子方程式:___________ 。
(2)pH约为2.0,在“分步沉淀时用氨水逐步调节pH至11.6,其中使Fe3+、Al3+完全沉淀的pH值范围:___________ 。
(3)根据表中信息,计算Mg(OH)2 的Ksp=___________ 。
(4)“水浸渣”在160℃ “酸溶”最适合的酸是___________ 。“酸溶渣”的成分是___________ 、___________ 。
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是:___________ 。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得___________ ,循环利用。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表,回答下列问题:
| 金属离子 | Fe3+ | Al3+ | Mg2+ | Ca2+ |
| 开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
| 沉淀完全(c=1.0×10-5mol·L-1)的pH | 3.2 | 4.7 | 11.0 | 13.8 |
(1)“焙烧”中,TiO2、SiO2几乎不发生反应,Al2O3、MgO、CaO、Fe2O3转化为相应的硫酸盐,Al2O3转化为NH4Al(SO4)2,写出向NH4Al(SO4)2中加入过量氨水的离子方程式:
(2)pH约为2.0,在“分步沉淀时用氨水逐步调节pH至11.6,其中使Fe3+、Al3+完全沉淀的pH值范围:
(3)根据表中信息,计算Mg(OH)2 的Ksp=
(4)“水浸渣”在160℃ “酸溶”最适合的酸是
(5)“酸溶”后,将溶液适当稀释并加热,TiO2+水解析出TiO2·xH2O沉淀,该反应的离子方程式是:
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】2018年北京市公交行业迈入氢能源时代。“制氢”“储氢”“用氢”等一直都是能源研究的热点。工业上制取H2有多种方法.如:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=+131.5kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+206.2kJ·mol-1
③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H3=+247.4kJ·mol-1
④2H2O(g)=2H2(g)+O2(g) △H4=+483.6kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:____________________ .
(2)氢气燃料电池能大幅度提高能量的转化率。相同条件下,其能量密度(能量密度之比等于单位质量的可燃物转移电子数之比)是甲醇燃料电池的_______ 倍(计算结果保留两位有效数字)。
(3)科学家研发的“全氢电池"的工作原理如图所示,该电池工作一段时间后,右池溶液的导电 能力几乎不变。下列有关该电 池的说法正确的是_____ (填字母代号)。
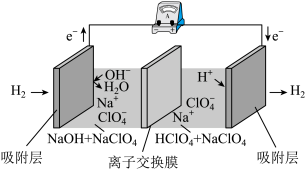
a.电池的总反应是2H2 +O2 = 2H2O
b.左边电极上的电势高于右边电极上的电势
c.负极的电极反应是H2 - 2e- + 2OH- = 2H2O
d.装置中所用的是阴离子交换膜
e.产生能源的源泉是酸和碱的中和能
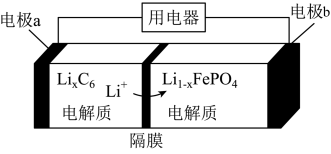
(4)LiFePO4电池稳定性高、安全、对环境友好,该电池的总反应式是Li1-xFePO4+LixC6 LiFePO4+C6,其放电时的工作原理如图所示。则:充电时,电极a的电极名称为
LiFePO4+C6,其放电时的工作原理如图所示。则:充电时,电极a的电极名称为_______________ ; 放电时电极b的电极反应式为______________________________ .
①C(s)+H2O(g)=CO(g)+H2(g) △H1=+131.5kJ·mol-1
②CH4(g)+H2O(g)=CO(g)+3H2(g) △H2=+206.2kJ·mol-1
③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H3=+247.4kJ·mol-1
④2H2O(g)=2H2(g)+O2(g) △H4=+483.6kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:
(2)氢气燃料电池能大幅度提高能量的转化率。相同条件下,其能量密度(能量密度之比等于单位质量的可燃物转移电子数之比)是甲醇燃料电池的
(3)科学家研发的“全氢电池"的工作原理如图所示,该电池工作一段时间后,右池溶液的导电 能力几乎不变。下列有关该电 池的说法正确的是

a.电池的总反应是2H2 +O2 = 2H2O
b.左边电极上的电势高于右边电极上的电势
c.负极的电极反应是H2 - 2e- + 2OH- = 2H2O
d.装置中所用的是阴离子交换膜
e.产生能源的源泉是酸和碱的中和能
(4)LiFePO4电池稳定性高、安全、对环境友好,该电池的总反应式是Li1-xFePO4+LixC6
 LiFePO4+C6,其放电时的工作原理如图所示。则:充电时,电极a的电极名称为
LiFePO4+C6,其放电时的工作原理如图所示。则:充电时,电极a的电极名称为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】用0.5mol·L-1的盐酸与0.55 mol·L-1的NaOH 溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题:

(1)从实验装置上看,图中尚缺少的 种玻璃仪器是___________ 。
(2)取50mL NaOH 溶液和50mL 盐酸溶液进行实验,实验数据如下表。
①由上述实验数据可得,温度差的平均值为___________ ℃。
②近似认为 溶液和
溶液和  盐酸溶液的密度都是
盐酸溶液的密度都是  中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热
中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热 
___________  (取小数点后一位)。
(取小数点后一位)。
(3)已知盐酸和氢氧化钠发生中和反应生成1mol H2O 时反应放出的热量为57.3kJ,本次实验产生偏差的原因可能是___________ (填字母)。
a. 实验装置保温、隔热效果差
b. 分多次把 NaOH 溶液倒入盛有硫酸的小烧杯中
c. 用温度计测定 NaOH 溶液起始温度后直接测定 溶液的温度
溶液的温度
(4)我国要在 2030年前实现碳达峰、2060年前实现碳中和的目标, CO2的捕集与转化是研究的重要课题。一种电化学法将 CO2转化为乙烯的原理如图所示,电解所用电极材料均为惰性电极。

①阴极上的电极反应式为___________ 。
②以铅蓄电池为电源,每生成0.2mol乙烯,理论上需消耗铅蓄电池中 硫酸的物质的量为___________ 。
(5)工业上含氮化合物污染物处理。
①以 NO2、 O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电池的正极反应式为___________ 。

② 纳米铁粉可用于处理含氮废水。用纳米铁粉处理水体中的 NO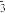 ,反应的离子方程式为
,反应的离子方程式为 研究发现,若 pH 偏低将会导致
研究发现,若 pH 偏低将会导致 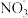 的去除率下降,其原因是
的去除率下降,其原因是___________ 。
③ 相同条件下,纳米铁粉去除不同水样中NO 的速率有较大差异(如下图),产生该差异的可能原因是
的速率有较大差异(如下图),产生该差异的可能原因是___________ 。

Ⅰ含50mg/L 的水样
的水样
Ⅱ含50mg/L +50mg/L Cu2+的水样
+50mg/L Cu2+的水样

(1)从实验装置上看,图中尚缺少的 种玻璃仪器是
(2)取50mL NaOH 溶液和50mL 盐酸溶液进行实验,实验数据如下表。
| 温度 实验次数 | 起始温度T₁/℃ | 终止温度T₂/℃ | ||
| HCl | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 29.1 |
| 2 | 25.9 | 25.9 | 25.9 | 29 |
| 3 | 27.0 | 27.4 | 27.2 | 31.7 |
| 4 | 26.4 | 26.2 | 26.3 | 29.5 |
②近似认为
 溶液和
溶液和  盐酸溶液的密度都是
盐酸溶液的密度都是  中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热
中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热 
 (取小数点后一位)。
(取小数点后一位)。(3)已知盐酸和氢氧化钠发生中和反应生成1mol H2O 时反应放出的热量为57.3kJ,本次实验产生偏差的原因可能是
a. 实验装置保温、隔热效果差
b. 分多次把 NaOH 溶液倒入盛有硫酸的小烧杯中
c. 用温度计测定 NaOH 溶液起始温度后直接测定
 溶液的温度
溶液的温度(4)我国要在 2030年前实现碳达峰、2060年前实现碳中和的目标, CO2的捕集与转化是研究的重要课题。一种电化学法将 CO2转化为乙烯的原理如图所示,电解所用电极材料均为惰性电极。

①阴极上的电极反应式为
②以铅蓄电池为电源,每生成0.2mol乙烯,理论上需消耗铅蓄电池中 硫酸的物质的量为
(5)工业上含氮化合物污染物处理。
①以 NO2、 O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电池的正极反应式为

② 纳米铁粉可用于处理含氮废水。用纳米铁粉处理水体中的 NO
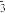 ,反应的离子方程式为
,反应的离子方程式为 研究发现,若 pH 偏低将会导致
研究发现,若 pH 偏低将会导致 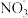 的去除率下降,其原因是
的去除率下降,其原因是③ 相同条件下,纳米铁粉去除不同水样中NO
 的速率有较大差异(如下图),产生该差异的可能原因是
的速率有较大差异(如下图),产生该差异的可能原因是
Ⅰ含50mg/L
 的水样
的水样Ⅱ含50mg/L
 +50mg/L Cu2+的水样
+50mg/L Cu2+的水样
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】 甲烷化是绿色低碳前沿技术研发的热点方向之一,在环境保护方面显示出较大潜力。涉及反应如下:
甲烷化是绿色低碳前沿技术研发的热点方向之一,在环境保护方面显示出较大潜力。涉及反应如下:
主反应:

副反应:
 ,
,
回答下列问题:
(1)向 密闭容器中充入
密闭容器中充入 反应合成
反应合成 ,平衡时混合气体中含碳物质的物质的量随温度的变化如图所示。
,平衡时混合气体中含碳物质的物质的量随温度的变化如图所示。
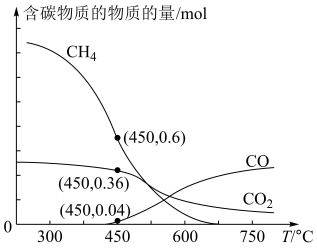
①工业上,常选用 作为合成温度,原因是
作为合成温度,原因是__________ 。
② 时,经过t分钟反应达平衡,t分钟内用
时,经过t分钟反应达平衡,t分钟内用 表示的反应速率为
表示的反应速率为______  ;该温度下
;该温度下 对甲烷的选择性=
对甲烷的选择性=________ 。(已知:选择性 )
)
(2)在体积相等的多个恒容密闭容器中,分别充入 和
和 发生上述主反应(忽略副反应),已知该反应的速率方程为
发生上述主反应(忽略副反应),已知该反应的速率方程为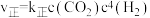 ,
, ,其中
,其中 为速率常数,只受温度影响。在不同温度下反应相同时间,测得
为速率常数,只受温度影响。在不同温度下反应相同时间,测得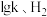 转化率与温度关系如图所示。
转化率与温度关系如图所示。
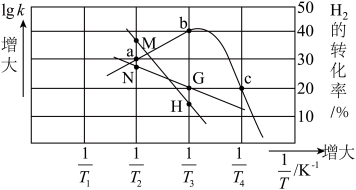
①c点______ (填“达平衡”或“未平衡”)。
②主反应活化能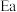 (正)
(正)___ 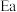 (逆)(填“>”或“<”),代表
(逆)(填“>”或“<”),代表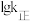 的曲线是
的曲线是______ (填“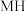 ”或“
”或“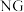 ”)。
”)。
③ 温度下达平衡时总压为p,该反应的
温度下达平衡时总压为p,该反应的
________ (列出计算式)。
(3)生物电化学系统可实现 合成甲烷。阴极功能微生物
合成甲烷。阴极功能微生物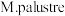 可以直接从阴极表面获得电子还原二氧化碳生产甲烷。酸性环境下该过程的电极反应式
可以直接从阴极表面获得电子还原二氧化碳生产甲烷。酸性环境下该过程的电极反应式________ 。
 甲烷化是绿色低碳前沿技术研发的热点方向之一,在环境保护方面显示出较大潜力。涉及反应如下:
甲烷化是绿色低碳前沿技术研发的热点方向之一,在环境保护方面显示出较大潜力。涉及反应如下:主反应:


副反应:

 ,
,回答下列问题:
(1)向
 密闭容器中充入
密闭容器中充入 反应合成
反应合成 ,平衡时混合气体中含碳物质的物质的量随温度的变化如图所示。
,平衡时混合气体中含碳物质的物质的量随温度的变化如图所示。
①工业上,常选用
 作为合成温度,原因是
作为合成温度,原因是②
 时,经过t分钟反应达平衡,t分钟内用
时,经过t分钟反应达平衡,t分钟内用 表示的反应速率为
表示的反应速率为 ;该温度下
;该温度下 对甲烷的选择性=
对甲烷的选择性= )
)(2)在体积相等的多个恒容密闭容器中,分别充入
 和
和 发生上述主反应(忽略副反应),已知该反应的速率方程为
发生上述主反应(忽略副反应),已知该反应的速率方程为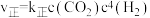 ,
, ,其中
,其中 为速率常数,只受温度影响。在不同温度下反应相同时间,测得
为速率常数,只受温度影响。在不同温度下反应相同时间,测得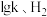 转化率与温度关系如图所示。
转化率与温度关系如图所示。
①c点
②主反应活化能
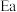 (正)
(正)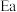 (逆)(填“>”或“<”),代表
(逆)(填“>”或“<”),代表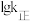 的曲线是
的曲线是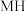 ”或“
”或“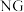 ”)。
”)。③
 温度下达平衡时总压为p,该反应的
温度下达平衡时总压为p,该反应的
(3)生物电化学系统可实现
 合成甲烷。阴极功能微生物
合成甲烷。阴极功能微生物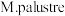 可以直接从阴极表面获得电子还原二氧化碳生产甲烷。酸性环境下该过程的电极反应式
可以直接从阴极表面获得电子还原二氧化碳生产甲烷。酸性环境下该过程的电极反应式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如图:
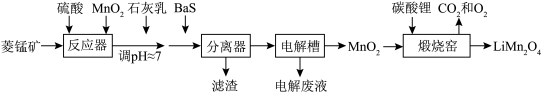
已知:①Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.0×10-32,Ksp[Ni(OH)2]=5.5×10-16。
②已知亚铁离子沉淀的pH范围是8~9之间
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为___________ ,硫酸不能太浓且反应温度不宜太高,原因是___________ 。
(2)加入少量二氧化锰的作用是把亚铁离子氧化成正三价铁离子,写出该反应的离子方程式___________ ,不用双氧水氧化亚铁离子的原因是___________ 。
(3)溶矿反应完成后,调pH≈7,可完全沉淀的离子是___________ ,通过列式计算说明理由___________ (离子浓度小于10-5mol/L即可认为完全沉淀)。
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有___________ 。
(5)煅烧窑中,生成LiMn2O4反应的化学方程式是___________ 。

已知:①Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.0×10-32,Ksp[Ni(OH)2]=5.5×10-16。
②已知亚铁离子沉淀的pH范围是8~9之间
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为
(2)加入少量二氧化锰的作用是把亚铁离子氧化成正三价铁离子,写出该反应的离子方程式
(3)溶矿反应完成后,调pH≈7,可完全沉淀的离子是
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有
(5)煅烧窑中,生成LiMn2O4反应的化学方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】氧化镁在医药建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索,以菱镁矿(主要成分为 ,另含少量杂质
,另含少量杂质 和
和 等为原料制备高纯氧化镁的实验流程如下:
等为原料制备高纯氧化镁的实验流程如下:

已知:滤渣2中除了过量的 外,还含有
外,还含有 。
。
(1)酸溶时, 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为__________ 。
(2)滤渣1的化学式为__________ 。
(3)“氧化”流程的目的把 氧化成
氧化成 ,再调节pH把
,再调节pH把 转化为
转化为 除去,写出酸性条件下“氧化”流程的离子方程式
除去,写出酸性条件下“氧化”流程的离子方程式__________ 。
(4)木炭是黑火药的主要成分之一,能发生反应:
①用单线桥表示反应电子得失的方向和数目:__________ 。
②反应中,被氧化是碳元素,被还原的是硫元素和__________ 元素,氧元素既没被氧化也没被还原;发生氧化反应的物质是__________ 。
 ,另含少量杂质
,另含少量杂质 和
和 等为原料制备高纯氧化镁的实验流程如下:
等为原料制备高纯氧化镁的实验流程如下:
已知:滤渣2中除了过量的
 外,还含有
外,还含有 。
。(1)酸溶时,
 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为(2)滤渣1的化学式为
(3)“氧化”流程的目的把
 氧化成
氧化成 ,再调节pH把
,再调节pH把 转化为
转化为 除去,写出酸性条件下“氧化”流程的离子方程式
除去,写出酸性条件下“氧化”流程的离子方程式(4)木炭是黑火药的主要成分之一,能发生反应:

①用单线桥表示反应电子得失的方向和数目:
②反应中,被氧化是碳元素,被还原的是硫元素和
您最近一年使用:0次
【推荐3】钼酸钠晶体(Na2MoO4·2H2O)常用于配制金属缓蚀剂。图为利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。回答下列问题:

(1)为了提高焙烧效率,除增大空气量外还可以采用的措施是_______ (写一条即可),写出焙烧时生成MoO3的化学方程式_______ 。
(2)“浸取”时产生的气体A是_______ 。
(3)若“过滤”前加入的沉淀剂为Na2S,则废渣的成分为_______ (填化学式)。
(4)“结晶”前需向滤液中加入Ba(OH)2固体以除去 。若滤液中c(
。若滤液中c( )=0.40mol/L,c(
)=0.40mol/L,c( )=0.20mol/L,要使钼元素无损失,
)=0.20mol/L,要使钼元素无损失, 的最大去除率是
的最大去除率是_______ [已知:Ksp(BaCO3)=1.0×10-9,Ksp(BaMoO4)=4.0×10-8]。
(5)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是_______ 。

(1)为了提高焙烧效率,除增大空气量外还可以采用的措施是
(2)“浸取”时产生的气体A是
(3)若“过滤”前加入的沉淀剂为Na2S,则废渣的成分为
(4)“结晶”前需向滤液中加入Ba(OH)2固体以除去
 。若滤液中c(
。若滤液中c( )=0.40mol/L,c(
)=0.40mol/L,c( )=0.20mol/L,要使钼元素无损失,
)=0.20mol/L,要使钼元素无损失, 的最大去除率是
的最大去除率是(5)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】硫酸钠-过氧化氢-氯化钠加合物( 4Na2SO4·2H2O2·NaCl)又称固体双氧水,具有漂白、杀菌、消毒等作用,其性质较稳定,因此具有广泛的应用前景。化学实验室中制备硫酸钠—过氧化氢—氯化钠加合物的流程如下:

已知:过氧化氢在碱性条件下不稳定。
4Na2SO4·2H2O2·NaCl的相对分子质量为694.5。
回答下列问题:
(1)控温反应中,反应的温度控制在10℃左右,不能太高的原因是____________ 。
(2)可用减压过滤得到产品。减压过滤装置中的陶瓷材料仪器名称是____________ 。
(3)上述工艺流程中,步骤B的操作是________ 。
(4)硫酸钠一过氧化氢一氯化钠加合物(4Na2SO4·2H2O2·NaCl)固体比过碳酸钠(2Na2CO3·3H2O2)固体更稳定的原因是___________ 。
(5)准确称取8.000 g固体双氧水样品,配制成250.00mL溶液,量取25.00mL溶液于锥形瓶中,加适量稀硫酸酸化后,用0.04000mol/L KMnO4标准溶液滴定至终点,消耗KMnO4溶液20.00mL。判断滴定终点时的现象________________ ;产品的纯度为___________ 。

已知:过氧化氢在碱性条件下不稳定。
4Na2SO4·2H2O2·NaCl的相对分子质量为694.5。
回答下列问题:
(1)控温反应中,反应的温度控制在10℃左右,不能太高的原因是
(2)可用减压过滤得到产品。减压过滤装置中的陶瓷材料仪器名称是
(3)上述工艺流程中,步骤B的操作是
(4)硫酸钠一过氧化氢一氯化钠加合物(4Na2SO4·2H2O2·NaCl)固体比过碳酸钠(2Na2CO3·3H2O2)固体更稳定的原因是
(5)准确称取8.000 g固体双氧水样品,配制成250.00mL溶液,量取25.00mL溶液于锥形瓶中,加适量稀硫酸酸化后,用0.04000mol/L KMnO4标准溶液滴定至终点,消耗KMnO4溶液20.00mL。判断滴定终点时的现象
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】保险粉(Na2S2O4)广泛应用于造纸、印染、环保、医药等行业。该物质具有强还原性,在空气中易被氧化,受热易分解,在碱性条件下比较稳定,易溶于水、不溶于乙醇。保险粉可以通过NaHSO3与NaBH4反应制取。请按要求回答下列问题:
Ⅰ.NaHSO3溶液的制备

(1)上图仪器a的名称___________ ;装置C中发生反应的化学方程式为___________ 。
(2)B装置被设计为安全瓶,但组装错误,B装置正确的连接方法是___________ 。
Ⅱ.保险粉的制备
打开下图(部分装置已省略)中活塞K1通入氮气,一段时间后,关闭K1,打开恒压滴液漏斗活塞向装置E中滴入碱性NaBH4溶液,在30~40℃下充分反应。向反应后的溶液中加入乙醇,经冷却结晶、过滤得到Na2S2O4·2H2O晶体,再用乙醇洗涤、真空烘干脱去晶体结晶水得到保险粉。

(3)反应产物中有NaBO2,无气体。写出E中发生反应的化学方程式___________ 。
(4)使用乙醇洗涤Na2S2O4·2H2O晶体的优点:___________ 。
(5)对装置E的加热方式最好采用___________ 。
Ⅲ.保险粉的纯度测定
(6)称取2.0g Na2S2O4样品溶于冷水配成200 mL溶液,取出25.00 mL该溶液于锥形瓶中,用0.10mol/L碱性K3[Fe(CN)6]标准溶液滴定,原理为:4[Fe(CN)6]3-+2S2O +8OH-=4[Fe(CN)6]4-+4SO
+8OH-=4[Fe(CN)6]4-+4SO +4H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00 mL,则样品中Na2S2O4的质量分数为
+4H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00 mL,则样品中Na2S2O4的质量分数为___________ (杂质不参与反应)(计算结果精确至0.1%)。
Ⅰ.NaHSO3溶液的制备

(1)上图仪器a的名称
(2)B装置被设计为安全瓶,但组装错误,B装置正确的连接方法是
Ⅱ.保险粉的制备
打开下图(部分装置已省略)中活塞K1通入氮气,一段时间后,关闭K1,打开恒压滴液漏斗活塞向装置E中滴入碱性NaBH4溶液,在30~40℃下充分反应。向反应后的溶液中加入乙醇,经冷却结晶、过滤得到Na2S2O4·2H2O晶体,再用乙醇洗涤、真空烘干脱去晶体结晶水得到保险粉。

(3)反应产物中有NaBO2,无气体。写出E中发生反应的化学方程式
(4)使用乙醇洗涤Na2S2O4·2H2O晶体的优点:
(5)对装置E的加热方式最好采用
Ⅲ.保险粉的纯度测定
(6)称取2.0g Na2S2O4样品溶于冷水配成200 mL溶液,取出25.00 mL该溶液于锥形瓶中,用0.10mol/L碱性K3[Fe(CN)6]标准溶液滴定,原理为:4[Fe(CN)6]3-+2S2O
 +8OH-=4[Fe(CN)6]4-+4SO
+8OH-=4[Fe(CN)6]4-+4SO +4H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00 mL,则样品中Na2S2O4的质量分数为
+4H2O,用亚甲基蓝为指示剂,达到滴定终点时消耗标准溶液24.00 mL,则样品中Na2S2O4的质量分数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。完成下列填空:
(1)写出上述制备小苏打的化学方程式__________
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤 ②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是___________ (选填编号)
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是________________ ;滤渣的主要成分是________________ 。
(4)称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。选甲基橙而不选酚酞作为指示剂的原因是_________ 。
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果__ 。(选填“偏高”、“偏低”或“无影响”)
(1)写出上述制备小苏打的化学方程式
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤 ②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是
(4)称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。选甲基橙而不选酚酞作为指示剂的原因是
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果
您最近一年使用:0次



