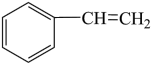
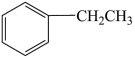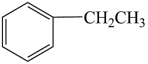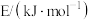一定条件下,苯乙烯能与氢气发生加成反应生成乙苯,反应的化学方程式为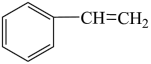 (g)+H2(g)
(g)+H2(g)
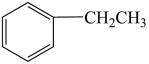 (g) △H<0。
(g) △H<0。
(1)上述反应达到平衡后,将容器的容积压缩到原来的一半,其他条件不变。下列说法正确的是_________ (填字母)。
A.v(H2)减小 B.正反应速率加快,逆反应速率减慢
C.反应物转化率增大 D.重新平衡后c(H2)/c(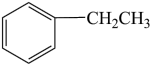 )减小
)减小
(2)若容器容积不变,提出一条能增大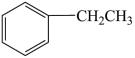 产率的措施:
产率的措施:_________________________ 。
(3)—定温度下,在三个容积均为1.0 L的恒容密闭容器中发生上述反应,相关信息如下表 所示:
①若容器Ⅰ中反应20 min达到平衡,则H2的平均反应速率为________ 。
②平衡时,容器Ⅱ中的反应平衡常数为________ 。
③平衡时,容器Ⅲ中乙苯的浓度________ (填“>”或“<”)0.05。
 (g)+H2(g)
(g)+H2(g)
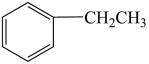 (g) △H<0。
(g) △H<0。(1)上述反应达到平衡后,将容器的容积压缩到原来的一半,其他条件不变。下列说法正确的是
A.v(H2)减小 B.正反应速率加快,逆反应速率减慢
C.反应物转化率增大 D.重新平衡后c(H2)/c(
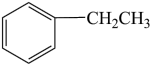 )减小
)减小 (2)若容器容积不变,提出一条能增大
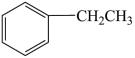 产率的措施:
产率的措施:(3)—定温度下,在三个容积均为1.0 L的恒容密闭容器中发生上述反应,相关信息如下表 所示:
容器 | 温度/K | 起始浓度/mol•L-1 | 平衡浓度/mol•L-1 | ||
H2 |
|
|
| ||
Ⅰ | 400 | 0.2 | 0.1 | 0 | 0.05 |
Ⅱ | 400 | 0.1 | 0.05 | 0 | |
Ⅲ | 500 | 0.2 | 0.1 | 0 | |
②平衡时,容器Ⅱ中的反应平衡常数为
③平衡时,容器Ⅲ中乙苯的浓度
更新时间:2017-11-03 12:32:24
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】苯乙烯(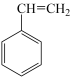 )是工业上合成各种塑料、离子交换树脂及合成橡胶的重要单体,工业上其制备原理是
)是工业上合成各种塑料、离子交换树脂及合成橡胶的重要单体,工业上其制备原理是 (g)
(g)
 (g)+H2(g)。请回答下列问题:
(g)+H2(g)。请回答下列问题:
(1)已知:
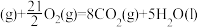
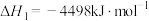 ;
;

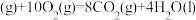
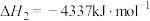 ;
;
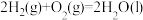
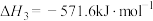 。
。
则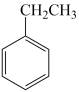 (g)
(g)
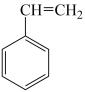 (g)+H2(g)
(g)+H2(g) 
_______ 。试推断该反应在_______ 下可自发进行(填“高温”、“低温”或“任何温度”)。
(2)在一定条件下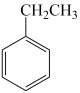 (g)
(g)
 (g)+H2(g)反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是_______。
(g)+H2(g)反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是_______。
(3)在不同反应温度下,乙苯的平衡转化率与催化剂作用下的苯乙烯的选择性(指除了 以外的产物中苯乙烯的物质的量分数)示意图如下,反应控制温度为600℃的理由是
以外的产物中苯乙烯的物质的量分数)示意图如下,反应控制温度为600℃的理由是_______ 。

(4)工业生产中常以高温水蒸气作为苯乙烯制备反应的稀释剂(水蒸气不参与反应)。下图为某温度下乙苯(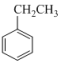 )的平衡转化率与水蒸气的用量、体系压强的关系图。
)的平衡转化率与水蒸气的用量、体系压强的关系图。

①图中压强
_______ 100kPa(填“>”、“<”或“=”)。在压强 下,c点转化率高于a的原因是
下,c点转化率高于a的原因是_______ 。
②若b点平衡转化率为50%,则该温度下,苯乙烯制备反应的分压平衡常数
_______ kPa(分压=总压×物质的量分数)。
 )是工业上合成各种塑料、离子交换树脂及合成橡胶的重要单体,工业上其制备原理是
)是工业上合成各种塑料、离子交换树脂及合成橡胶的重要单体,工业上其制备原理是 (g)
(g)
 (g)+H2(g)。请回答下列问题:
(g)+H2(g)。请回答下列问题:(1)已知:

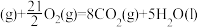
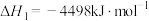 ;
;
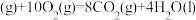
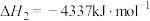 ;
;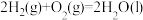
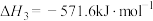 。
。则
 (g)
(g)
 (g)+H2(g)
(g)+H2(g) 
(2)在一定条件下
 (g)
(g)
 (g)+H2(g)反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是_______。
(g)+H2(g)反应达到平衡状态,当改变反应的某一条件后,下列变化能说明平衡一定向正反应方向移动的是_______。| A.正反应速率先增大后减小 | B.化学平衡常数K值增大 |
| C.反应物的体积百分数增大 | D.混合气体密度增大 |
 以外的产物中苯乙烯的物质的量分数)示意图如下,反应控制温度为600℃的理由是
以外的产物中苯乙烯的物质的量分数)示意图如下,反应控制温度为600℃的理由是
(4)工业生产中常以高温水蒸气作为苯乙烯制备反应的稀释剂(水蒸气不参与反应)。下图为某温度下乙苯(
 )的平衡转化率与水蒸气的用量、体系压强的关系图。
)的平衡转化率与水蒸气的用量、体系压强的关系图。
①图中压强

 下,c点转化率高于a的原因是
下,c点转化率高于a的原因是②若b点平衡转化率为50%,则该温度下,苯乙烯制备反应的分压平衡常数

您最近一年使用:0次
【推荐2】碳在冶金工业上具有重要用途。已知氧与碳的反应主要有:
Ⅰ.C(s)+O2(g)⇌CO2(g) △H1=-394kJ·mol-1
Ⅱ.2C(s)+O2(g)⇌2CO(g) △H2=-221kJ·mol-1
Ⅲ.2CO(g)+O2(g)⇌2CO2(g) △H3
上述反应的△G~T如图所示,且满足△G=△H-T△S。
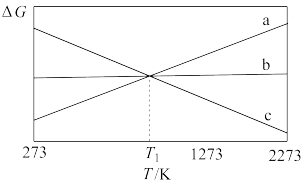
请回答:
(1)曲线a代表反应_________ (填“I”、“II”或“III”),理由是__________ 。
(2)研究发现,以CO2替代高温水蒸气作为煤气化反应(H2O与C反应)的气化剂,实现了CO2零排放的新工艺。写出反应IV的热化学方程式___________ (碳的计量数为1)。在1273K时,测得碳转化率[α(C)]与时间t变化如图所示。保持其它条件不变,请画出1773K时α(C)~t关系图______ 。

(3)当T=T1时,反应IV处于平衡状态,下列关于反应IV的说法正确的是_________ 。
A.因平衡时△G=0,若△H变化173.3kJ·mol-1,△S变化173.3J·K-1·mol-1,计算得T1=1000K
B.T<T1时,反应向逆反应方向移动
C.当碳的浓度不再变化时,一定处于平衡状态
D.因平衡常数K的值不再变化,反应达到了平衡
(4)当T=1273K时,仅存在CO、CO2两种气体,且维持总压为1 atm,此时反应IV的Kp=112,则CO气体所占的分压p(CO)为___________ atm。(列式即可)
Ⅰ.C(s)+O2(g)⇌CO2(g) △H1=-394kJ·mol-1
Ⅱ.2C(s)+O2(g)⇌2CO(g) △H2=-221kJ·mol-1
Ⅲ.2CO(g)+O2(g)⇌2CO2(g) △H3
上述反应的△G~T如图所示,且满足△G=△H-T△S。

请回答:
(1)曲线a代表反应
(2)研究发现,以CO2替代高温水蒸气作为煤气化反应(H2O与C反应)的气化剂,实现了CO2零排放的新工艺。写出反应IV的热化学方程式

(3)当T=T1时,反应IV处于平衡状态,下列关于反应IV的说法正确的是
A.因平衡时△G=0,若△H变化173.3kJ·mol-1,△S变化173.3J·K-1·mol-1,计算得T1=1000K
B.T<T1时,反应向逆反应方向移动
C.当碳的浓度不再变化时,一定处于平衡状态
D.因平衡常数K的值不再变化,反应达到了平衡
(4)当T=1273K时,仅存在CO、CO2两种气体,且维持总压为1 atm,此时反应IV的Kp=112,则CO气体所占的分压p(CO)为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】 是一种污染性气体,减少
是一种污染性气体,减少 在大气中的排放是环境保护的重要内容,回答下列问题:
在大气中的排放是环境保护的重要内容,回答下列问题:
(1) 分子的空间构型为
分子的空间构型为_______ , 中心原子的杂化方式为
中心原子的杂化方式为_______ ;
(2)下列为二氧化硫和氮的氧化物转化的部分环节:
I.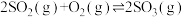
 kJ·mol-1
kJ·mol-1
II.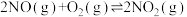
 kJ·mol-1
kJ·mol-1
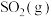 与
与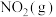 反应生成
反应生成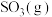 和
和 的热化学方程式为
的热化学方程式为_______ 。若将物质的量之比为2:1的 和
和 通入恒温、恒容反应器发生上述反应,不能判断达到平衡的是
通入恒温、恒容反应器发生上述反应,不能判断达到平衡的是_______ (填选项字母)
A.混合气体密度保持不变
B. 与
与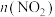 的比值保持不变
的比值保持不变
C.
D.在给定条件下,可逆反应完成程度达到最大
(3)利用反应: ,可减少
,可减少 在大气中的排放,800℃,在1.0L的恒容密闭容器中投入1.0mol
在大气中的排放,800℃,在1.0L的恒容密闭容器中投入1.0mol 和120gC,容器中压强为
和120gC,容器中压强为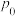 kPa,发生反应
kPa,发生反应 ,5min时容器中
,5min时容器中 的体积分数为20%,10min时达平衡,容器中压强为p kPa时。0~5min
的体积分数为20%,10min时达平衡,容器中压强为p kPa时。0~5min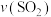
_______ k Pa·min-1,800℃的化学平衡常数Kc=_______ mol/L。
(4)实验室中常用氢氧化钠溶液吸收二氧化硫尾气。当溶液溶质为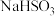 时,若往溶液中加入氨水至中性,则
时,若往溶液中加入氨水至中性,则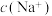
_______ 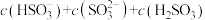 (填“>”、“<”或“=”)。当溶液溶质为
(填“>”、“<”或“=”)。当溶液溶质为 时,若往溶液种加入少量
时,若往溶液种加入少量 固体,完全溶解后(此时溶液是不饱和溶液),溶液中
固体,完全溶解后(此时溶液是不饱和溶液),溶液中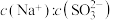 的比值
的比值_______ (填“变大”、“变小”或“保持不变”)。
 是一种污染性气体,减少
是一种污染性气体,减少 在大气中的排放是环境保护的重要内容,回答下列问题:
在大气中的排放是环境保护的重要内容,回答下列问题:(1)
 分子的空间构型为
分子的空间构型为 中心原子的杂化方式为
中心原子的杂化方式为(2)下列为二氧化硫和氮的氧化物转化的部分环节:
I.
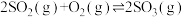
 kJ·mol-1
kJ·mol-1II.
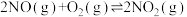
 kJ·mol-1
kJ·mol-1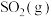 与
与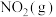 反应生成
反应生成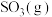 和
和 的热化学方程式为
的热化学方程式为 和
和 通入恒温、恒容反应器发生上述反应,不能判断达到平衡的是
通入恒温、恒容反应器发生上述反应,不能判断达到平衡的是A.混合气体密度保持不变
B.
 与
与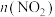 的比值保持不变
的比值保持不变C.

D.在给定条件下,可逆反应完成程度达到最大
(3)利用反应:
 ,可减少
,可减少 在大气中的排放,800℃,在1.0L的恒容密闭容器中投入1.0mol
在大气中的排放,800℃,在1.0L的恒容密闭容器中投入1.0mol 和120gC,容器中压强为
和120gC,容器中压强为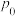 kPa,发生反应
kPa,发生反应 ,5min时容器中
,5min时容器中 的体积分数为20%,10min时达平衡,容器中压强为p kPa时。0~5min
的体积分数为20%,10min时达平衡,容器中压强为p kPa时。0~5min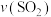
(4)实验室中常用氢氧化钠溶液吸收二氧化硫尾气。当溶液溶质为
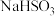 时,若往溶液中加入氨水至中性,则
时,若往溶液中加入氨水至中性,则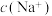
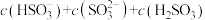 (填“>”、“<”或“=”)。当溶液溶质为
(填“>”、“<”或“=”)。当溶液溶质为 时,若往溶液种加入少量
时,若往溶液种加入少量 固体,完全溶解后(此时溶液是不饱和溶液),溶液中
固体,完全溶解后(此时溶液是不饱和溶液),溶液中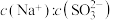 的比值
的比值
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】I.向2L的密闭恒温容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答下列问题。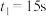 ,则
,则 阶段
阶段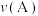 =
=______ 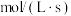 。
。
(2)写出反应的化学方程式:______ 。
(3)B的起始物质的量浓度是______ 。
Ⅱ. 甲烷化是一种实现
甲烷化是一种实现 资源化利用的有效途径,其反应的化学方程式为:
资源化利用的有效途径,其反应的化学方程式为:
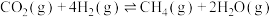 。
。
(4)已知此反应中相关化学键断裂时所需吸收的能量(或形成化学键时所释放的能量)数据如下表:
计算该反应每生成1mol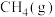 ,
,______ (填“吸收”或“放出”)热量______ KJ。
(5)该可逆反应达到平衡的标志为______(填标号)。
①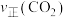 和
和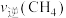 的比值为1:1
的比值为1:1
②相同时间内,断开C=O键的数目和断开O-H键的数目相等
③混合气体的平均相对分子质量不变
④恒容时单位体积内分子总数不变
⑤四种物质的分压之比等于计量系数之比
⑥恒温恒压时混合气体的总压强不变
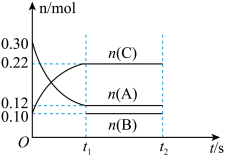
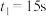 ,则
,则 阶段
阶段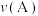 =
=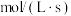 。
。(2)写出反应的化学方程式:
(3)B的起始物质的量浓度是
Ⅱ.
 甲烷化是一种实现
甲烷化是一种实现 资源化利用的有效途径,其反应的化学方程式为:
资源化利用的有效途径,其反应的化学方程式为: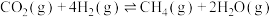 。
。(4)已知此反应中相关化学键断裂时所需吸收的能量(或形成化学键时所释放的能量)数据如下表:
化学键 | H-H | C=O | H-O | C-H |
| 436 | 803 | 463 | 413 |
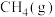 ,
,(5)该可逆反应达到平衡的标志为______(填标号)。
①
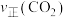 和
和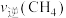 的比值为1:1
的比值为1:1②相同时间内,断开C=O键的数目和断开O-H键的数目相等
③混合气体的平均相对分子质量不变
④恒容时单位体积内分子总数不变
⑤四种物质的分压之比等于计量系数之比
⑥恒温恒压时混合气体的总压强不变
| A.①②④ | B.①③④ | C.①③⑥ | D.②⑤⑥ |
您最近一年使用:0次
【推荐2】研究CO和CO2的利用对促进低碳社会的构建具有重要意义。请回答下列问题:
(1)利用CO和H2在一定条件下可合成甲醇,发生反应: CO(g)+ 2H2(g) CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是
CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____ (填字母)。

A.上述反应的△H= -91 kJ·mol-1
B.该反应自发进行的条件为高温
C. b过程使用催化剂后降低了反应的活化能和∆H
D. b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(2)若反应CO(g)+2H2(g) CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
①下列各项能作为判断该反应达到平衡标志的是_______ (填字母)
A.2v正(H2)=v逆(CH3OH)
B. CO与CH3OH的物质的量之比保持不变
C.混合气的平均相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0kPa,反应速率若用单位时间内分压的变化表示,则10 min内H2的反应速率v(H2)=_____ kPa/min;该温度下反应的平衡常数Kp=______ 。(分压=总压×物质的量分数)。
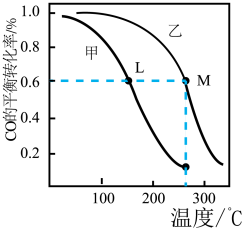
(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 molH2,测得不同温度下CO的平衡转化率如图所示,则L、M两点容器内平衡常数:K(M)_____ K(L); 压强:p(M)__ 2p(L)。(填“>”“<”或“=”)
(4)以纳米二氧化钛为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯( )。电解时,阴极的电极反应式是
)。电解时,阴极的电极反应式是_________ 。
(1)利用CO和H2在一定条件下可合成甲醇,发生反应: CO(g)+ 2H2(g)
 CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是
CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是
A.上述反应的△H= -91 kJ·mol-1
B.该反应自发进行的条件为高温
C. b过程使用催化剂后降低了反应的活化能和∆H
D. b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(2)若反应CO(g)+2H2(g)
 CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:| 时间/min | 0 | 5 | 10 | 15 |
| H2 | 4 | 2 | ||
| CO | 2 | 1 | ||
| CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是
A.2v正(H2)=v逆(CH3OH)
B. CO与CH3OH的物质的量之比保持不变
C.混合气的平均相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0kPa,反应速率若用单位时间内分压的变化表示,则10 min内H2的反应速率v(H2)=
(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 molH2,测得不同温度下CO的平衡转化率如图所示,则L、M两点容器内平衡常数:K(M)

(4)以纳米二氧化钛为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯(
 )。电解时,阴极的电极反应式是
)。电解时,阴极的电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】利用合成氨生产尿素[CO(NH2)2]是重要的化学工艺。在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:3H2(g)+N2(g) 2NH3(g)。保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g)。保持恒温、恒容,测得反应达到平衡时有关数据如下:
(1)下列各项能说明该反应已达到平衡状态的是____________ (填写序号字母).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)容器乙中反应从开始到达平衡的反应速率为v(H2)=_________
(3)在该温度下甲容器中反应的平衡常数K________ (用含c1的代数式表示).
(4)分析上表数据,下列关系正确的是_________ (填序号):
a.2c1>1.5mol/L b.2ρ1=ρ2 c.ω3=ω1 d.K甲=K乙=K丙
(5)氨和尿素溶液都可以吸收硝酸工业尾气中的NO、NO2,将其转化为N2.写出尿素与NO、NO2三者等物质的量反应的化学方程式__________________ .
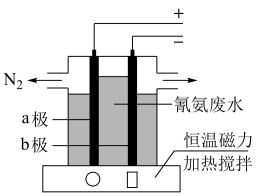
(6)氨氮废水(含NH3、NaOH和Na2SO4)超标排放会造成水体富营养化.如图通过直接电化学法能有效除去废水中的氨.其中阴离子的流动方向为__________ (填“a极”或“b极”),电解过程中,b极区的pH_____________ (填“增大”或“减小”或“不变”),阳极反应方程式为__________ .
 2NH3(g)。保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g)。保持恒温、恒容,测得反应达到平衡时有关数据如下:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol·L-1 | c1 | 1.5 | |
| NH3的体积分数 | ω1 | ω3 | |
| 混合气体密度/g·L-1 | ρ1 | ρ2 | |
| 平衡常数/L2·mol-2 | K甲 | K乙 | K丙 |
(1)下列各项能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)容器乙中反应从开始到达平衡的反应速率为v(H2)=
(3)在该温度下甲容器中反应的平衡常数K
(4)分析上表数据,下列关系正确的是
a.2c1>1.5mol/L b.2ρ1=ρ2 c.ω3=ω1 d.K甲=K乙=K丙
(5)氨和尿素溶液都可以吸收硝酸工业尾气中的NO、NO2,将其转化为N2.写出尿素与NO、NO2三者等物质的量反应的化学方程式
(6)氨氮废水(含NH3、NaOH和Na2SO4)超标排放会造成水体富营养化.如图通过直接电化学法能有效除去废水中的氨.其中阴离子的流动方向为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】含碳物质在日常生活极为常见,它们之间的相互转化在化学工业中有着广泛的应用。
I.一种熔融碳酸盐燃料电池原理示意如下图所示
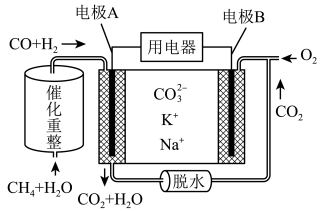
(1)写出电极A中发生的电极方程式:______ 、______ ;
II.二甲醚( )是重要的化工原料,可用CO和制得,总反应的热化学方程式如下:
)是重要的化工原料,可用CO和制得,总反应的热化学方程式如下:
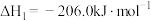
工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
i.甲醇合成反应:

ii.
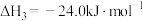
(2)起始时向容器中投入2.5molCO和4mol 测得某时刻上述总反应中放出的热量为154.5kJ,此时CO的转化率为
测得某时刻上述总反应中放出的热量为154.5kJ,此时CO的转化率为___________ ;
(3)计算甲醇合成反应的
___________  ;
;
(4)甲醇脱水反应 在某温度下的化学平衡常数为400。此温度下,在某体积为2L的恒容密闭容器中加入一定量的
在某温度下的化学平衡常数为400。此温度下,在某体积为2L的恒容密闭容器中加入一定量的 ,测得某时刻各组分物质的量如下表所示。此时反应
,测得某时刻各组分物质的量如下表所示。此时反应___________ (填“朝正向进行”、“处于平衡状态”或“朝逆向进行”)。
(5)生产二甲醚的过程中存在以下副反应,与甲醇脱水反应形成竞争:
iii.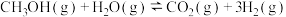
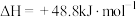
将反应物混合气按进料比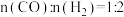 通入反应装置,选择合适的催化剂。在一定温度和压强下,测得二甲醚的选择性分别如图1、图2所示(不考虑催化剂失活)。
通入反应装置,选择合适的催化剂。在一定温度和压强下,测得二甲醚的选择性分别如图1、图2所示(不考虑催化剂失活)。
资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。
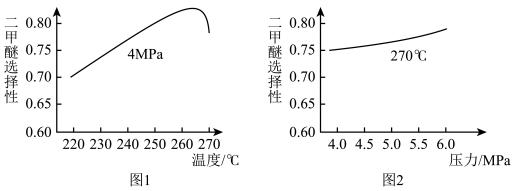
①图1中,温度高于265℃后,二甲醚选择性降低的原因是___________ 。
②图2中,温度一定,压强增大,二甲醚选择性增大的原因是___________ 。
I.一种熔融碳酸盐燃料电池原理示意如下图所示

(1)写出电极A中发生的电极方程式:
II.二甲醚(
 )是重要的化工原料,可用CO和制得,总反应的热化学方程式如下:
)是重要的化工原料,可用CO和制得,总反应的热化学方程式如下:
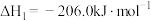
工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
i.甲醇合成反应:


ii.

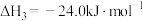
(2)起始时向容器中投入2.5molCO和4mol
 测得某时刻上述总反应中放出的热量为154.5kJ,此时CO的转化率为
测得某时刻上述总反应中放出的热量为154.5kJ,此时CO的转化率为(3)计算甲醇合成反应的

 ;
;(4)甲醇脱水反应
 在某温度下的化学平衡常数为400。此温度下,在某体积为2L的恒容密闭容器中加入一定量的
在某温度下的化学平衡常数为400。此温度下,在某体积为2L的恒容密闭容器中加入一定量的 ,测得某时刻各组分物质的量如下表所示。此时反应
,测得某时刻各组分物质的量如下表所示。此时反应| 物质 |  |  |  |
| 物质的量/(mol) | 0.02 | 0.4 | 0.4 |
iii.
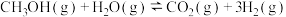
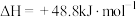
将反应物混合气按进料比
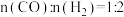 通入反应装置,选择合适的催化剂。在一定温度和压强下,测得二甲醚的选择性分别如图1、图2所示(不考虑催化剂失活)。
通入反应装置,选择合适的催化剂。在一定温度和压强下,测得二甲醚的选择性分别如图1、图2所示(不考虑催化剂失活)。资料:二甲醚的选择性是指转化为二甲醚的CO在全部CO反应物中所占的比例。

①图1中,温度高于265℃后,二甲醚选择性降低的原因是
②图2中,温度一定,压强增大,二甲醚选择性增大的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】甲醇是重要的化工原料,主要用于精细化工和制造塑料。利用二氧化碳生产甲醇实现 资源化,同时减少温室气体的排放。
资源化,同时减少温室气体的排放。
已知:一定条件下, 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:
反应i:
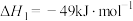

反应ii: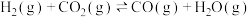


(1)反应体系中存在反应iii: 则
则
_______  ;相同条件下,反应iii的平衡常数
;相同条件下,反应iii的平衡常数
_______ (用平衡常数 、
、 表示)。
表示)。
(2)采用真空封管法制备磷化硼纳米颗粒,成功的实现了高选择性电催化还原 制备甲醇,该反应历程如图所示。
制备甲醇,该反应历程如图所示。

①该过程容易产生副产物_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的能量变化。
A. B.
B.
C. D.
D.
(3)保持压强为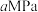 ,将二氧化碳和氢气按照
,将二氧化碳和氢气按照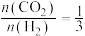 投入密闭容器中,同时发生反应i和ii,一段时间后,体系中
投入密闭容器中,同时发生反应i和ii,一段时间后,体系中 平衡转化率及甲醇产率随温度变化关系如下图所示。
平衡转化率及甲醇产率随温度变化关系如下图所示。
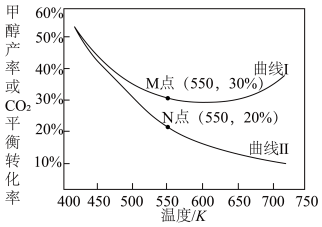
①上图中曲线Ⅰ表示_______ (填“ 平衡转化率”或“甲醇产率”)随温度变化的曲线,请简述理由:
平衡转化率”或“甲醇产率”)随温度变化的曲线,请简述理由:_______ 。
②550K时,该平衡体系中CO的物质的量为_______ mol,反应i的平衡常数
_______  (列出计算式)。
(列出计算式)。
 资源化,同时减少温室气体的排放。
资源化,同时减少温室气体的排放。已知:一定条件下,
 催化加氢生产甲醇,发生如下反应:
催化加氢生产甲醇,发生如下反应:反应i:

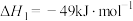

反应ii:
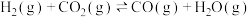


(1)反应体系中存在反应iii:
 则
则
 ;相同条件下,反应iii的平衡常数
;相同条件下,反应iii的平衡常数
 、
、 表示)。
表示)。(2)采用真空封管法制备磷化硼纳米颗粒,成功的实现了高选择性电催化还原
 制备甲醇,该反应历程如图所示。
制备甲醇,该反应历程如图所示。
①该过程容易产生副产物
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.
 B.
B.
C.
 D.
D.
(3)保持压强为
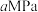 ,将二氧化碳和氢气按照
,将二氧化碳和氢气按照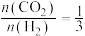 投入密闭容器中,同时发生反应i和ii,一段时间后,体系中
投入密闭容器中,同时发生反应i和ii,一段时间后,体系中 平衡转化率及甲醇产率随温度变化关系如下图所示。
平衡转化率及甲醇产率随温度变化关系如下图所示。
①上图中曲线Ⅰ表示
 平衡转化率”或“甲醇产率”)随温度变化的曲线,请简述理由:
平衡转化率”或“甲醇产率”)随温度变化的曲线,请简述理由:②550K时,该平衡体系中CO的物质的量为

 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】2020年9月22日,国家主席习近平在第七十五届联合国大会一般性辩论上发表重要讲话时指出,中国将采取有力的政策和措施,力争于2030年前二氧化碳排放达到峰值,努力争取2060年前实现碳中和。为此,科学家们正在努力探索 资源化技术。
资源化技术。
方法1:近年我国大力加强温室气体 催化氢化合成甲醇技术的工业化研究,实现可持续发展。涉及反应如下:
催化氢化合成甲醇技术的工业化研究,实现可持续发展。涉及反应如下:

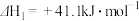

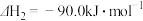
(1)写出利用 和
和 合成甲醇的热化学方程式
合成甲醇的热化学方程式___________ ;判断上述反应能自发进行的条件是___________ 。
(2)在一定温度下,向2L密闭容器中加入2mol 、6mol
、6mol  ,在适当的催化剂作用下,发生反应:
,在适当的催化剂作用下,发生反应: ,下列叙述能说明此反应一定达到平衡状态的是
,下列叙述能说明此反应一定达到平衡状态的是___________
A.混合气体的平均相对分子质量保持不变B. 和
和 的转化率相等
的转化率相等
C.混合气体的密度保持不变D.有3mol H-O键生成的同时有3mol H-H键生成
(3)250℃时,在恒容密闭容器中由 (g)催化氢化合成
(g)催化氢化合成 ,不同投料比
,不同投料比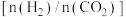 时某反应物X的平衡转化率变化曲线如图所示。反应物X是
时某反应物X的平衡转化率变化曲线如图所示。反应物X是___________ (填“ ”或“
”或“ ”),判断依据是
”),判断依据是___________ 。
(4)催化剂和反应条件与反应物转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如下表所示:
根据上表所给数据,用 生产甲醇的最优选项为
生产甲醇的最优选项为___________ (填字母)。
方法2:用二氧化碳催化加氢还可用来合成低碳烯烃。
反应开始时,在体积为0.1L的密闭容器中,初始充入 的物质的量为0.3mol,
的物质的量为0.3mol, 的物质的量为0.1mol,发生反应:
的物质的量为0.1mol,发生反应: ,不同温度下平衡时的四种气态物质的物质的量百分数如图所示:
,不同温度下平衡时的四种气态物质的物质的量百分数如图所示:

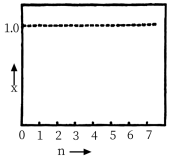
(5)在120℃达到平衡时,此温度下的平衡常数为___________ (用分数表示)。若氢气和二氧化碳的物质的量之比为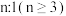 进行投料,温度控制为120℃,相应平衡体系中乙烯的产率为x,在上图中绘制x随n(
进行投料,温度控制为120℃,相应平衡体系中乙烯的产率为x,在上图中绘制x随n( )变化的示意图(标出曲线的起点坐标)
)变化的示意图(标出曲线的起点坐标)___________ 。
 资源化技术。
资源化技术。方法1:近年我国大力加强温室气体
 催化氢化合成甲醇技术的工业化研究,实现可持续发展。涉及反应如下:
催化氢化合成甲醇技术的工业化研究,实现可持续发展。涉及反应如下:
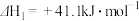

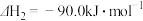
(1)写出利用
 和
和 合成甲醇的热化学方程式
合成甲醇的热化学方程式(2)在一定温度下,向2L密闭容器中加入2mol
 、6mol
、6mol  ,在适当的催化剂作用下,发生反应:
,在适当的催化剂作用下,发生反应: ,下列叙述能说明此反应一定达到平衡状态的是
,下列叙述能说明此反应一定达到平衡状态的是A.混合气体的平均相对分子质量保持不变B.
 和
和 的转化率相等
的转化率相等C.混合气体的密度保持不变D.有3mol H-O键生成的同时有3mol H-H键生成
(3)250℃时,在恒容密闭容器中由
 (g)催化氢化合成
(g)催化氢化合成 ,不同投料比
,不同投料比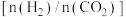 时某反应物X的平衡转化率变化曲线如图所示。反应物X是
时某反应物X的平衡转化率变化曲线如图所示。反应物X是 ”或“
”或“ ”),判断依据是
”),判断依据是(4)催化剂和反应条件与反应物转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,四组实验数据如下表所示:
| 实验编号 | 温度(K) | 催化剂 |  转化率(%) 转化率(%) | 甲醇选择性(%) |
| A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
| B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
| C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
| D | 553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用
 生产甲醇的最优选项为
生产甲醇的最优选项为方法2:用二氧化碳催化加氢还可用来合成低碳烯烃。
反应开始时,在体积为0.1L的密闭容器中,初始充入
 的物质的量为0.3mol,
的物质的量为0.3mol, 的物质的量为0.1mol,发生反应:
的物质的量为0.1mol,发生反应: ,不同温度下平衡时的四种气态物质的物质的量百分数如图所示:
,不同温度下平衡时的四种气态物质的物质的量百分数如图所示:

(5)在120℃达到平衡时,此温度下的平衡常数为
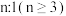 进行投料,温度控制为120℃,相应平衡体系中乙烯的产率为x,在上图中绘制x随n(
进行投料,温度控制为120℃,相应平衡体系中乙烯的产率为x,在上图中绘制x随n( )变化的示意图(标出曲线的起点坐标)
)变化的示意图(标出曲线的起点坐标)
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
【推荐1】盐酸利多卡因是局麻药及抗心律失常药,以芳香族化合物A和有机物D为主要原料,其合成路线如下:
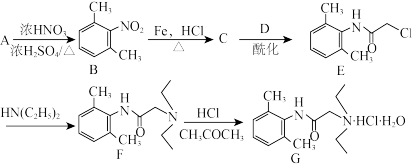
已知酰化反应: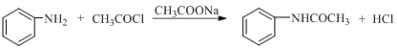
请回答下列问题:
(1)A的名称为_______ 。
(2)C的结构简式为_______ ,D的结构简式为_______ 。
(3)E→F的反应类型为_______ 。
(4)H为A的一种同分异构体,且不能使溴水因反应褪色,其核磁共振氢谱有两组峰,峰面积之比为3:2,则H可能的结构为_______ (写出一种即可)。
(5)已知:①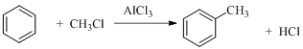
②苯环上的甲基活化邻位和对位上的H,硝基钝化邻位和对位上的H。参照上述合成路线和信息,完善以 、CH3Cl和CH3COCl为原料
、CH3Cl和CH3COCl为原料 无机试剂任选
无机试剂任选 ,制备对甲基乙酰苯胺
,制备对甲基乙酰苯胺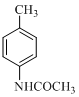 的合成路线a
的合成路线a____ 、b____ 、c____ 、d____ 、。


已知酰化反应:

请回答下列问题:
(1)A的名称为
(2)C的结构简式为
(3)E→F的反应类型为
(4)H为A的一种同分异构体,且不能使溴水因反应褪色,其核磁共振氢谱有两组峰,峰面积之比为3:2,则H可能的结构为
(5)已知:①

②苯环上的甲基活化邻位和对位上的H,硝基钝化邻位和对位上的H。参照上述合成路线和信息,完善以
 、CH3Cl和CH3COCl为原料
、CH3Cl和CH3COCl为原料 无机试剂任选
无机试剂任选 ,制备对甲基乙酰苯胺
,制备对甲基乙酰苯胺 的合成路线a
的合成路线a
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
【推荐2】磷酸氯喹(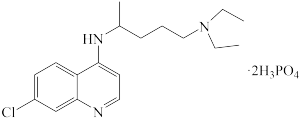 )治疗新冠肺炎具有一定疗效,以苯为原料合成磷酸氯喹路线如图所示:
)治疗新冠肺炎具有一定疗效,以苯为原料合成磷酸氯喹路线如图所示:
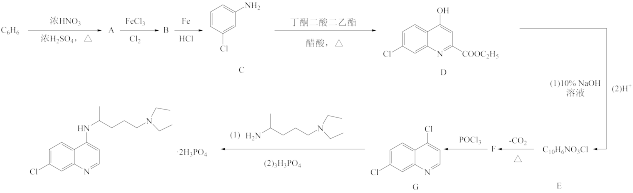
已知:① 和苯酚性质相似;
和苯酚性质相似;
②通常情况下,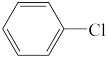 与NaOH溶液不反应。
与NaOH溶液不反应。
请回答下列问题:
(1)A的名称为______ ,B→C的反应类型为_______
(2)D中含氧官能团的名称为_______ ,F的结构简式为_______ 。
(3)D和10%的NaOH溶液反应的化学方程式为_______ 。
(4)C9H12是苯的一种同系物,其结构有______ 种,其中核磁共振氢谱显示峰面积之比为6:3:2:1的结构简式为_______ 。
(5)参照上述合成路线,设计以苯为原料合成 的一种合理的路线。
的一种合理的路线。_______ 。
 )治疗新冠肺炎具有一定疗效,以苯为原料合成磷酸氯喹路线如图所示:
)治疗新冠肺炎具有一定疗效,以苯为原料合成磷酸氯喹路线如图所示:
已知:①
 和苯酚性质相似;
和苯酚性质相似;②通常情况下,
 与NaOH溶液不反应。
与NaOH溶液不反应。请回答下列问题:
(1)A的名称为
(2)D中含氧官能团的名称为
(3)D和10%的NaOH溶液反应的化学方程式为
(4)C9H12是苯的一种同系物,其结构有
(5)参照上述合成路线,设计以苯为原料合成
 的一种合理的路线。
的一种合理的路线。
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
【推荐3】吲哚布芬适用于动脉硬化性缺血性心血管病变。其合成路线如图。
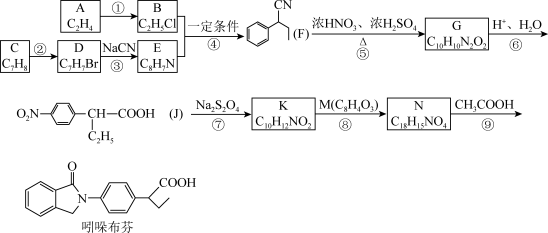
已知:R—X R—CN
R—CN R—COOH+NH
R—COOH+NH
(1)吲哚布芬的分子式为____ 。J中含氧官能团的名称是___ 。
(2)反应①的反应类型是___ ,反应②所用的试剂和条件分别是____ 。
(3)反应⑥的离子方程式是___ 。
(4)反应⑦中Na2S2O4的作用是___ 。
(5)已知M的核磁共振氢谱有两组峰,N的结构简式是____ 。
(6)符合下列条件的J的同分异构体共有___ 种。
①含有苯环;②与J含有相同官能团;③官能团直接与苯环相连且处于对位
(7)仿照上述合成路线设计由丙醇(CH3CH2CH2OH)合成2—甲基丙酸( )的合成路线
)的合成路线___ 。(其他试剂任选)

已知:R—X
 R—CN
R—CN R—COOH+NH
R—COOH+NH
(1)吲哚布芬的分子式为
(2)反应①的反应类型是
(3)反应⑥的离子方程式是
(4)反应⑦中Na2S2O4的作用是
(5)已知M的核磁共振氢谱有两组峰,N的结构简式是
(6)符合下列条件的J的同分异构体共有
①含有苯环;②与J含有相同官能团;③官能团直接与苯环相连且处于对位
(7)仿照上述合成路线设计由丙醇(CH3CH2CH2OH)合成2—甲基丙酸(
 )的合成路线
)的合成路线
您最近一年使用:0次