现有常温下体积均为10 mL、 pH=3的两种溶液:① HCl溶液,② CH3COOH溶液。下列说法中,正确的是
| A.溶液中溶质的物质的量浓度:① > ② |
| B.溶液中酸根的物质的量浓度:① = ② |
| C.加水稀释至1 L,溶液的pH:① < ② |
| D.分别加入等浓度NaOH溶液至中性,消耗NaOH的量:① = ② |
18-19高三上·北京海淀·期末 查看更多[8]
北京市海淀区2018届高三上学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理——溶液稀释、混合时的pH值变化规律(已下线)第21讲 电离平衡(练) — 2022年高考化学一轮复习讲练测(新教材新高考)北京市首都师范大学附属中学2021-2022学年高二上学期期中考试化学试题河北省保定市唐县第一中学2021-2022学年高二(普通部)上学期期中考试化学试题北京首都师范大学附属中学2023-2024学年高二上学期10月月考化学试题黑龙江省哈尔滨市第一中学校2022-2023学年高三上学期12月月考化学试题北京市中关村中学2023-2024学年高三上学期12月月考化学试题
更新时间:2018-01-20 20:40:18
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列事实不能说明 HNO2是弱酸的是
| A.NaNO2溶液呈碱性 |
| B.常温下,0.1 mol/L HNO2溶液的 pH=2.1 |
| C.0.1 mol/L NaOH溶液与0.1 mol/L HNO2溶液等体积混合,恰好完全反应 |
| D.常温下,将pH=1的HNO2溶液稀释至原体积的100倍,溶液的pH约为2.8 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法正确的是
| A.强电解质溶液一定比弱电解质溶液导电能力强 |
| B.BaSO4是弱电解质 |
| C.蔗糖、CO2是非电解质 |
| D.盐酸能导电,所以盐酸是电解质 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】常温下 的两种酸溶液A和B,分别加水稀释1000倍,其pH与所加水的体积变化如图所示。下列结论正确的是
的两种酸溶液A和B,分别加水稀释1000倍,其pH与所加水的体积变化如图所示。下列结论正确的是

 的两种酸溶液A和B,分别加水稀释1000倍,其pH与所加水的体积变化如图所示。下列结论正确的是
的两种酸溶液A和B,分别加水稀释1000倍,其pH与所加水的体积变化如图所示。下列结论正确的是
| A.A为弱酸,B为强酸 |
| B.稀释至相同的pH酸A加的水比酸B多 |
| C.稀释至相同的pH后取等体积两溶液,中和氢氧化钠的量酸A比酸B多 |
| D.B酸比A酸的酸性弱 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】25℃时,用0.1000 mol/L NaOH溶液分别滴定20.00mL浓度均为0.1000mol/L的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH溶液体积的变化如图。下列说法正确的是
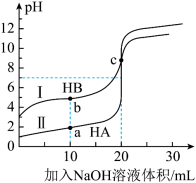

| A.用NaOH溶液滴定HB溶液时适宜用酚酞作指示剂 |
| B.中和等体积、等浓度的HB和HA,所需NaOH:HA>HB |
| C.曲线Ⅰ上的c点溶液中:c(B-) > c(Na+) >c(OH-)>c(H+) |
| D.水的电离程度:b > c |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐3】MOH和ROH两种一元碱,常温下向其水溶液中加水稀释,pH变化如图。下列说法正确的是


| A.在X点时,由H2O电离出的c(H+)相等,c(M+)=c(R+) |
| B.稀释前,c(ROH)=10c(MOH) |
C.稀释ROH溶液过程中 减小 减小 |
| D.稀释ROH溶液过程中,溶液中所有微粒浓度均减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列溶液中粒子的物质的量浓度关系不正确的是
A.0.1mol·L−1Na2SO3溶液中:c(SO )>c(OH-)>c(HSO )>c(OH-)>c(HSO ) ) |
| B.NH4Cl溶液中加入等体积稀盐酸,NH4Cl溶液酸性可能减弱 |
| C.室温下,将pH=3的醋酸溶液加水稀释100倍,所得溶液的pH>5 |
D.室温下,pH=3的盐酸与pH=11的氨水等体积混合:c(NH )+c(OH-)>c(Cl-)+c(H+) )+c(OH-)>c(Cl-)+c(H+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】关于室温下的下列判断正确的是
| A.pH=5的HNO3溶液,稀释100倍后,pH=7 |
| B.pH=5的H2S溶液中,c(H+)=c(HS﹣)=10﹣5mol•L﹣1 |
| C.将pH=2的盐酸与pH=12的氨水等体积混合,溶液显酸性 |
D.在0.1mol•L﹣1Na2CO3溶液中:c(Na+)>c(CO )>c(OH﹣)>c(HCO )>c(OH﹣)>c(HCO ) ) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】已知 ,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是
,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是
 ,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是
,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡常数 | K=1.75×10-5 | K=2.98×10-8 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
A. ,酸性从强到弱的顺序是 ,酸性从强到弱的顺序是 、 、 、 、 、 、 |
B.将 的醋酸不断加水稀释,所有离子浓度均减小 的醋酸不断加水稀释,所有离子浓度均减小 |
C.少量 通入 通入 溶液中反应的离子方程式为 溶液中反应的离子方程式为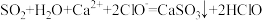 |
D.少量 通入 通入 溶液中反应的离子方程式为 溶液中反应的离子方程式为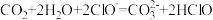 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】化学反应的方向和化学反应速率的研究可以指导化工生产。下列观点正确的是
A.2H2O 2H2↑+O2↑与2H2+O2 2H2↑+O2↑与2H2+O2 2H2O互为可逆反应 2H2O互为可逆反应 |
| B.向新制氯水中加入少量石灰石固体可提高其漂白能力 |
| C.向稀氨水中加入少量水,溶液的导电能力增强 |
D.恒容密闭容器中发生反应4NH3+5O2 4NO+6H2O,充入少量N2可加快反应速率 4NO+6H2O,充入少量N2可加快反应速率 |
您最近一年使用:0次

 溶液分别滴定
溶液分别滴定 溶液和
溶液和 溶液的滴定曲线。下列示意图中,能正确表示用
溶液的滴定曲线。下列示意图中,能正确表示用

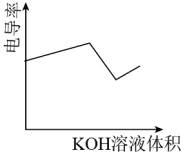
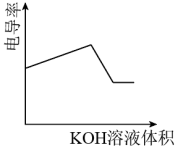

 计测定溶液
计测定溶液 是否为弱电解质。下列说法正确的是
是否为弱电解质。下列说法正确的是 时,若测得
时,若测得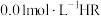 溶液
溶液 ,则
,则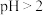 且
且 ,则
,则 ,取该溶液
,取该溶液 ,加蒸馏水稀释至
,加蒸馏水稀释至 ,测得
,测得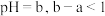 ,则
,则 ,测得
,测得 ,若
,若


