(I)多项选择题
下列关于水处理的说法正确的是_______ 。
A.FeSO4·7H2O是常用的混凝剂,它除去悬浮固体颗粒的过程只是物理过程
B.用纯碱和生石灰处理硬水,既可以除去暂时硬度,也可以除去永久硬度
C.永久硬度的水可以采用离子交换法进行软化,其主要就是利用了离子交换膜技术
D.污水处理中的三级处理是采用化学方法,对污水进行深度处理和净化
E.电渗析法是一种常用的海水淡化的方法,使用到的离子交换膜只有阳离子交换膜
(II)
下列是工业合成氨的简要流程示意图:
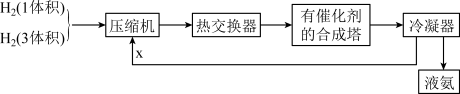
请回答下列问题:
(1)H2通常用碳氢化合物与水反应,写出有关的反应方程式_______ ,从冷凝器回流到压缩机中的X是_______ 。
(2)比较工业上合成氨和SO2的催化氧化反应,其生产条件有哪些异同,并解释原因_______ 。
(3)将N2、H2按体积比1∶3进入合成塔,从合成塔出来的混合气中,氨的体积分数为15%,则H2的体积分数为_______ 。
(4)NH3的用途之一是制造化肥,但在化肥的使用过程中要注意铵态氮肥不可以和草木灰混用,解释其原因_______ 。
(5)NH3是一种重要的化工原料,除了制造化肥之外,再列举出两种NH3的用途_______ 。
下列关于水处理的说法正确的是
A.FeSO4·7H2O是常用的混凝剂,它除去悬浮固体颗粒的过程只是物理过程
B.用纯碱和生石灰处理硬水,既可以除去暂时硬度,也可以除去永久硬度
C.永久硬度的水可以采用离子交换法进行软化,其主要就是利用了离子交换膜技术
D.污水处理中的三级处理是采用化学方法,对污水进行深度处理和净化
E.电渗析法是一种常用的海水淡化的方法,使用到的离子交换膜只有阳离子交换膜
(II)
下列是工业合成氨的简要流程示意图:

请回答下列问题:
(1)H2通常用碳氢化合物与水反应,写出有关的反应方程式
(2)比较工业上合成氨和SO2的催化氧化反应,其生产条件有哪些异同,并解释原因
(3)将N2、H2按体积比1∶3进入合成塔,从合成塔出来的混合气中,氨的体积分数为15%,则H2的体积分数为
(4)NH3的用途之一是制造化肥,但在化肥的使用过程中要注意铵态氮肥不可以和草木灰混用,解释其原因
(5)NH3是一种重要的化工原料,除了制造化肥之外,再列举出两种NH3的用途
2011·海南海口·一模 查看更多[1]
(已下线)2011届海南省海口市高三高考调研测试地化学试卷
更新时间:2016-12-09 01:49:08
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内煅烧黄铁矿生成二氧化硫;在接触室内有催化剂存在下二氧化硫进一步与氧气结合,生成三氧化硫;三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。
图中的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
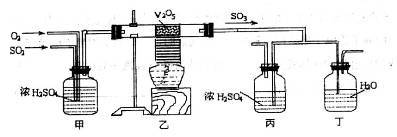
请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的反应方程式:_______ ;
(2)上图中的乙、丙分别相当于工业上制取硫酸装置中的:_______ 、_______ ;
(3)丙中的现象为_______ 、丁中的现象为_______ 。
(4)表中是压强对SO2平衡转化率的影响
对SO2转化为SO3的反应,增大压强可使转化率_______ ,只所以通常采用常压操作是因为:_______ 。
图中的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。

请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的反应方程式:
(2)上图中的乙、丙分别相当于工业上制取硫酸装置中的:
(3)丙中的现象为
(4)表中是压强对SO2平衡转化率的影响
 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 800 | 73.7 | 85.8 | 89.5 | 96.4 |
您最近一年使用:0次
【推荐2】甲醇是一种基本的有机化工原料,用途十分广泛。
已知:CH3OH(g) ⇌HCHO(g)+H2(g) ΔH=+84kJ·mol-1
2H2(g)+O2(g) ⇌2H2O(g) ΔH=-484kJ·mol-1
(1)①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:_______ 。
②若在恒温恒容的容器内进行反应CO(g)+2H2(g) ⇌CH3OH(g),下列表示该反应达到平衡状态的标志有_______ (填字母序号)。
A.容器中混合气体的密度不变化
B.有2个H—H键断裂的同时有3个C—H键生成
C.容器中混合气体的压强不变化
D.CH3OH(g)百分含量保持不变
(2)工业上以CO、CO2、H2为原料制备甲醇,其原理如下:
主反应:①CO+2H2⇌CH3OH ②CO2+3H2⇌CH3OH+H2O
副反应:2CO⇌CO2+C 2CO+2H2⇌CH4+CO2
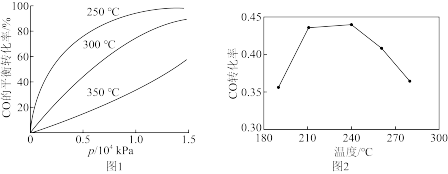
CO在不同温度下的平衡转化率与压强的关系如图1所示。该反应ΔH_____ (填“>”或“<”)0,实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是_____ 。由图2知,当温度高于240℃时,CO转化率下降的原因为_____ 。
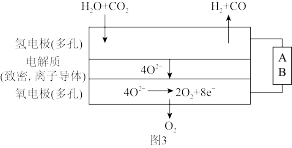
(3)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2,由图3可知A为直流电源的_____ (填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:_____ 。
已知:CH3OH(g) ⇌HCHO(g)+H2(g) ΔH=+84kJ·mol-1
2H2(g)+O2(g) ⇌2H2O(g) ΔH=-484kJ·mol-1
(1)①工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:
②若在恒温恒容的容器内进行反应CO(g)+2H2(g) ⇌CH3OH(g),下列表示该反应达到平衡状态的标志有
A.容器中混合气体的密度不变化
B.有2个H—H键断裂的同时有3个C—H键生成
C.容器中混合气体的压强不变化
D.CH3OH(g)百分含量保持不变
(2)工业上以CO、CO2、H2为原料制备甲醇,其原理如下:
主反应:①CO+2H2⇌CH3OH ②CO2+3H2⇌CH3OH+H2O
副反应:2CO⇌CO2+C 2CO+2H2⇌CH4+CO2
CO在不同温度下的平衡转化率与压强的关系如图1所示。该反应ΔH

(3)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2-,O2-穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2,由图3可知A为直流电源的

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】一种带有多孔结构的镍铝合金对H2具有较强的吸附性,其高催化活性和热稳定性使得该镍铝合金被用于很多工业过程中和有机合成反应中。下图是以镍黄铁矿(主要成分为NiS、FeS等)为原料制备该镍铝合金的工艺流程图:

回答下列问题:
(1)Ni(CO)4中C、O化合价与CO中的C、O化合价相同,则Ni化合价为_______ 价。
(2)在空气中“煅烧”生成Ni2O3和Fe2O3,写出Fe2O3的化学方程式________________ 。
(3)操作“镍 Ni(CO)4
Ni(CO)4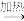 镍”的目的是
镍”的目的是__________ 。
(4)Ni、Al高温熔融时,气体X的作用是__________ 。对“高温熔融”物冷却后,需要进行粉碎处理,粉碎处理的目的是__________ 。
(5)“碱浸”可以使镍产生多孔结构,从而增强对H2的吸附性,“浸出液”中的主要离子是__________ ;“浸出液”中的铝元素可循环利用,写出回收“浸出液”中的铝元素,并制备“高温熔融”时的原料Al的流程:__________ (示例:CuO Cu2+
Cu2+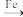 Cu)。
Cu)。

回答下列问题:
(1)Ni(CO)4中C、O化合价与CO中的C、O化合价相同,则Ni化合价为
(2)在空气中“煅烧”生成Ni2O3和Fe2O3,写出Fe2O3的化学方程式
(3)操作“镍
 Ni(CO)4
Ni(CO)4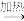 镍”的目的是
镍”的目的是(4)Ni、Al高温熔融时,气体X的作用是
(5)“碱浸”可以使镍产生多孔结构,从而增强对H2的吸附性,“浸出液”中的主要离子是
 Cu2+
Cu2+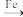 Cu)。
Cu)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)用pH计测得某FeCl3溶液的pH=0.70,加入下列试剂,能使该FeCl3溶液pH升高的是_______ 。
a.水 b. FeCl3固体 c.浓盐酸 d. NaHCO3固体
蒸发FeCl3溶液并灼烧最终得到的固体产物是_______ 。
(2)利用上述FeCl3溶液探究其与镁粉的反应原理。实验操作及现象如下表:
①用离子方程式解释现象b:_______ 。
②取少量反应后的溶液,滴入2滴_______ (写化学式)溶液,出现蓝色沉淀即可证明有Fe2+生成。写出生成Fe2+的离子方程式:_______ 。
(3)镁和FeCl3溶液反应后溶液中 浓度的测定
浓度的测定
i.将反应瓶中的溶液过滤并调节溶液的pH在6.5~10.5;
ii.取20.00mL滤液加水稀释至100ml
iii.另取稀释后滤液20.00ml,加入K2CrO4溶液作指示剂,用c AgNO3标准溶液滴定滤液中的
AgNO3标准溶液滴定滤液中的 至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与
至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与 生成砖红色沉淀指示滴定终点。
生成砖红色沉淀指示滴定终点。
①滴定时,盛装AgNO3标准溶液的滴定管应选用_______ (填玻璃仪器名称)。
②计算原滤液中 浓度为
浓度为_______ (用代数式表示)。
(4)探究FeCl3溶液与Na2SO3溶液发生氧化还原反应
查阅资料可知,Na2SO3具有还原性,FeCl3具有氧化性,可以设计成原电池。用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转,电极a附近溶液颜色变浅
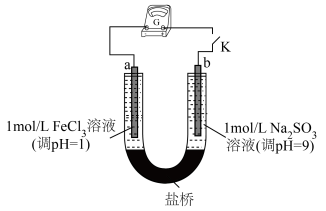
写出正极的电极反应式_______ 。一段时间后负极区pH_______ 9(填“<”、“=”、“>”)。
(1)用pH计测得某FeCl3溶液的pH=0.70,加入下列试剂,能使该FeCl3溶液pH升高的是
a.水 b. FeCl3固体 c.浓盐酸 d. NaHCO3固体
蒸发FeCl3溶液并灼烧最终得到的固体产物是
(2)利用上述FeCl3溶液探究其与镁粉的反应原理。实验操作及现象如下表:
| 操作 | 现象 |
| 先向反应瓶中注入50mL上述FeCl3溶液,再加入镁粉,搅拌。 | a.出现红褐色沉淀 b.有大量气泡 c.镁粉逐渐溶解、溶液变为浅绿色 |
②取少量反应后的溶液,滴入2滴
(3)镁和FeCl3溶液反应后溶液中
 浓度的测定
浓度的测定i.将反应瓶中的溶液过滤并调节溶液的pH在6.5~10.5;
ii.取20.00mL滤液加水稀释至100ml
iii.另取稀释后滤液20.00ml,加入K2CrO4溶液作指示剂,用c
 AgNO3标准溶液滴定滤液中的
AgNO3标准溶液滴定滤液中的 至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与
至终点,重复操作3次,平均消耗AgNO3溶液VmL。已知Ag+与 生成砖红色沉淀指示滴定终点。
生成砖红色沉淀指示滴定终点。①滴定时,盛装AgNO3标准溶液的滴定管应选用
②计算原滤液中
 浓度为
浓度为(4)探究FeCl3溶液与Na2SO3溶液发生氧化还原反应
查阅资料可知,Na2SO3具有还原性,FeCl3具有氧化性,可以设计成原电池。用下图装置(a、b均为石墨电极)进行实验。闭合开关后灵敏电流计指针偏转,电极a附近溶液颜色变浅

写出正极的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】(1)配平湿法制备高铁酸钾反应的离子方程式:
____ Fe(OH)3+____ ClO-+____ OH-=____ FeO +
+____ Cl-+____ H2O
(2)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
①NH4Al(SO4)2可作净水剂,其理由是_____ (用离子方程式说明)。
②相同条件下,0.1mol•L-1NH4Al(SO4)2中c(NH )
)_____ (填“=”“>”或“<”)0.1mol•L-1NH4HSO4中c(NH )。
)。
③如图所示是0.1mol•L-1电解质溶液的pH随温度变化的图像,其中符合0.1mol•L-1NH4Al(SO4)2的pH随温度变化的曲线是_____ (填写序号)。
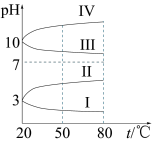
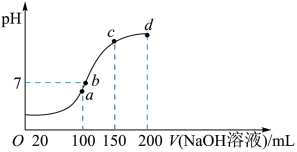
④室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大是______ 点;在d点离子反应方程式_____ 。在b点离子浓度的大小关系______ 。
 +
+(2)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:
①NH4Al(SO4)2可作净水剂,其理由是
②相同条件下,0.1mol•L-1NH4Al(SO4)2中c(NH
 )
) )。
)。③如图所示是0.1mol•L-1电解质溶液的pH随温度变化的图像,其中符合0.1mol•L-1NH4Al(SO4)2的pH随温度变化的曲线是

④室温时,向100mL 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】绿矾(FeSO4·7H2O)是一种重要的食品和饲料添加剂。某化学兴趣小组用废铁屑为原科与稀硫酸反应制备绿矾。
(1)将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,除去废铁屑上的油污,过滤,然后将废铁屑用水洗涤2~3遍,其中加热的作用是_______ 。
(2)向洗涤过的废铁屑中加入适量稀硫酸,控制温度在50~80℃之间至反应完全(铁屑有剩余),发生反应的离子方程式为_______ 。如果加入过量的稀硫酸是否可以,说出你的理由_______ 。
(3)趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶,待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,干燥,得到绿矾。请分析用少量冰水洗涤晶体的目的_______ 。
(4)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,质量为m1。将样品装入石英玻璃管中,再次将装置A称重,质量为m2.按下图连接好装置进行实验。
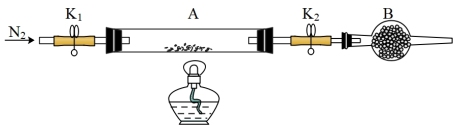
操作步骤如下:
a.打开K1和K2,缓缓通入N2;
b.点燃酒精灯,加热:
c.熄灭酒精灯;
d.冷却到室温;
e.关闭K1和K2;
f.称量A。
重复上述操作步骤,直至A恒重(固体为FeSO4),质量为m3。
①仪器B的名称是_____ 。整个过程中持续通入N2的目的是______ 。
②根据实验记录,计算绿矾化学式中结晶水数目x=_____ (列式表示)。若实验时按b、a次序操作,则x_____ (填“偏大”、“偏小”或“无影响”)。
(1)将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,除去废铁屑上的油污,过滤,然后将废铁屑用水洗涤2~3遍,其中加热的作用是
(2)向洗涤过的废铁屑中加入适量稀硫酸,控制温度在50~80℃之间至反应完全(铁屑有剩余),发生反应的离子方程式为
(3)趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶,待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,干燥,得到绿矾。请分析用少量冰水洗涤晶体的目的
(4)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,质量为m1。将样品装入石英玻璃管中,再次将装置A称重,质量为m2.按下图连接好装置进行实验。

操作步骤如下:
a.打开K1和K2,缓缓通入N2;
b.点燃酒精灯,加热:
c.熄灭酒精灯;
d.冷却到室温;
e.关闭K1和K2;
f.称量A。
重复上述操作步骤,直至A恒重(固体为FeSO4),质量为m3。
①仪器B的名称是
②根据实验记录,计算绿矾化学式中结晶水数目x=
您最近一年使用:0次




