Q、R、X、Y为前20号元素中的三种,Y22+、Q的低价氧化物都与X单质分子均为等电子体,R与Q同族。
⑴Q的最高价氧化物,其固体属于____________ 晶体,比较Q、X、Y 第一电离能由大到小的顺序______________ 。
⑵ R的氢化物属于__________ 分子(填“极性”或“非极性”)。
⑶X的常见氢化物的VSEPR模型是___________ ;
⑷已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为_______ 。
⑴Q的最高价氧化物,其固体属于
⑵ R的氢化物属于
⑶X的常见氢化物的VSEPR模型是
⑷已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。则绿色晶体配合物的化学式为
10-11高二下·辽宁沈阳·阶段练习 查看更多[1]
(已下线)2010-2011学年辽宁省沈阳二中高二6月月考化学试题
更新时间:2016-12-09 01:54:38
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】硒(Se)被国内外医药界和营养学界尊称为“生命的火种”,享有“长寿元素”“抗癌之王”“心脏守护神”“天然解毒剂”等美誉。硒在电子工业中可用作光电管、太阳能电池,硒元素形成的多种化合物也有重要作用。
(1)硒和硫同为 A族元素,基态硒原子的价层电子排布式为
A族元素,基态硒原子的价层电子排布式为___________ 。
(2)单质硒的熔点为221℃,其晶体类型为___________ 。
(3)与硒元素相邻的同周期元素是砷和溴,则这三种元素的第一电离能由小到大的顺序为___________ (用元素符号表示)。
(4) 分子中Se原子的杂化轨道类型为
分子中Se原子的杂化轨道类型为___________ ; 的立体构型是
的立体构型是___________ ,写出一种与 互为等电子体的分子
互为等电子体的分子___________ (写化学式)。
(5) 分子中含有的共价键是
分子中含有的共价键是___________ (选填“极性键”或“非极性键”); 水溶液比
水溶液比 水溶液的酸性强,原因是
水溶液的酸性强,原因是___________ 。
(6) -AgI可用作固体离子导体,能通过加热
-AgI可用作固体离子导体,能通过加热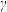 -Ag制得。上述两种晶体的晶胞示意图如图1所示(为了简化,只画出了碘离子在晶胞中的位置)。
-Ag制得。上述两种晶体的晶胞示意图如图1所示(为了简化,只画出了碘离子在晶胞中的位置)。___________ (填字母)。
A.质谱仪 B.红外光谱仪 C.核磁共振仪 D.X射线衍射仪
②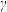 -AgI与
-AgI与 -AgI晶胞的体积之比为
-AgI晶胞的体积之比为___________ 。
③测定 -AgI中导电离子类型的实验装置如图2所示,实验测得支管a中AgI质量不变,可判定导电离子是
-AgI中导电离子类型的实验装置如图2所示,实验测得支管a中AgI质量不变,可判定导电离子是 而不是
而不是 ,依据是
,依据是___________ 。
(1)硒和硫同为
 A族元素,基态硒原子的价层电子排布式为
A族元素,基态硒原子的价层电子排布式为(2)单质硒的熔点为221℃,其晶体类型为
(3)与硒元素相邻的同周期元素是砷和溴,则这三种元素的第一电离能由小到大的顺序为
(4)
 分子中Se原子的杂化轨道类型为
分子中Se原子的杂化轨道类型为 的立体构型是
的立体构型是 互为等电子体的分子
互为等电子体的分子(5)
 分子中含有的共价键是
分子中含有的共价键是 水溶液比
水溶液比 水溶液的酸性强,原因是
水溶液的酸性强,原因是(6)
 -AgI可用作固体离子导体,能通过加热
-AgI可用作固体离子导体,能通过加热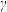 -Ag制得。上述两种晶体的晶胞示意图如图1所示(为了简化,只画出了碘离子在晶胞中的位置)。
-Ag制得。上述两种晶体的晶胞示意图如图1所示(为了简化,只画出了碘离子在晶胞中的位置)。
A.质谱仪 B.红外光谱仪 C.核磁共振仪 D.X射线衍射仪
②
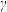 -AgI与
-AgI与 -AgI晶胞的体积之比为
-AgI晶胞的体积之比为③测定
 -AgI中导电离子类型的实验装置如图2所示,实验测得支管a中AgI质量不变,可判定导电离子是
-AgI中导电离子类型的实验装置如图2所示,实验测得支管a中AgI质量不变,可判定导电离子是 而不是
而不是 ,依据是
,依据是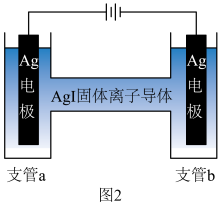
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
【推荐2】有 A 、 B 、 C 、 D 、 E 、 F 六种元素,已知:
① 它们位于三个不同的短周期,核电荷数依次增大。
②E元素的电离能数据见下表(KJ/mol):
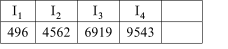
③B与F同主族。
④A、E 都能与 D 按原子个数比 1:1 和 2:1 形成化合物。
⑤B、C 都能与 D 按原子个数比 1:1 和 1:2 形成化合物。
(1)写出只含有 A、B、D、E 四种元素的两种无水盐的化学式:_______________________________
(2)B2A2 分子中存在______________ 个 键,
键,_____________ 个 键。
键。
(3)人们通常把拆开 1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H)化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
试计算1molF单质完全燃烧时的反应热△H=________ (已知1molF单质中含2mol F—F键,1molFO2中含有4mol键F—O)。
① 它们位于三个不同的短周期,核电荷数依次增大。
②E元素的电离能数据见下表(KJ/mol):

③B与F同主族。
④A、E 都能与 D 按原子个数比 1:1 和 2:1 形成化合物。
⑤B、C 都能与 D 按原子个数比 1:1 和 1:2 形成化合物。
(1)写出只含有 A、B、D、E 四种元素的两种无水盐的化学式:
(2)B2A2 分子中存在
 键,
键, 键。
键。(3)人们通常把拆开 1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H)化学反应的反应热等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 | F—D | F—F | B—B | F—B | B=D | D=D |
| 键能(KJ/mol) | 460 | 176 | 347.7 | 347 | 745 | 497.3 |
试计算1molF单质完全燃烧时的反应热△H=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】钛被誉为“21世纪的金属”,可呈现多种化合价。其中以+4价的Ti最为稳定。回答下列问题: 。
(1)基态Ti原子的价电子轨道表示式为___________ 。
(2)已知电离能: I2(Ti) = 1310kJ/mol, I2(K) = 3051kJ/mol。 I2(Ti) < I2(K),其原因为___________ 。
(3)钛某配合物可用于催化环烯烃聚合,其结如图所示:
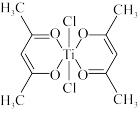
①钛的配位数为___________ ,碳原子的杂化类型 ___________ 。
②该配合物中存在的化学键有___________ (填字母标号)。
a离子键 b.配位键 c金属键 d.共价键 e.氢键
(4)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为___________ 。

(1)基态Ti原子的价电子轨道表示式为
(2)已知电离能: I2(Ti) = 1310kJ/mol, I2(K) = 3051kJ/mol。 I2(Ti) < I2(K),其原因为
(3)钛某配合物可用于催化环烯烃聚合,其结如图所示:

①钛的配位数为
②该配合物中存在的化学键有
a离子键 b.配位键 c金属键 d.共价键 e.氢键
(4)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】Co元素的某些化合物在电池、光电材料、催化剂等方面有广泛应用。回答下列问题:
(1)一种具有光催化作用的配合物A结构简式如图所示:
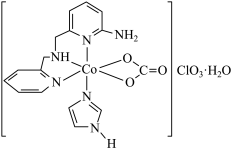
①基态Co原子价电子排布图为___________ 。
②外界 的空间构型为
的空间构型为___________ ,钴元素价态为___________ 。
③配合物A配位数为___________ ,中心离子的杂化方式为___________ (填标号)。
A.sp3 B.dsp2 C.d2sp3 D.sp3d
④咪唑( )具有类似苯环的结构,①号N比②号N更易与钴形成配位键的原因是
)具有类似苯环的结构,①号N比②号N更易与钴形成配位键的原因是_________ 。
(2)Co的一种化合物为六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数体标。

已知晶胞含对称中心,其中1号氧原子的分数坐标为(0.6667,0.6667,0.6077),则2号氧原子的分数坐标为___________ ;NA为阿伏加德罗常数的值,该晶体的密度为___________ g/cm3(用计算式表示)。
(1)一种具有光催化作用的配合物A结构简式如图所示:

①基态Co原子价电子排布图为
②外界
 的空间构型为
的空间构型为③配合物A配位数为
A.sp3 B.dsp2 C.d2sp3 D.sp3d
④咪唑(
 )具有类似苯环的结构,①号N比②号N更易与钴形成配位键的原因是
)具有类似苯环的结构,①号N比②号N更易与钴形成配位键的原因是(2)Co的一种化合物为六方晶系晶体,晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数体标。

已知晶胞含对称中心,其中1号氧原子的分数坐标为(0.6667,0.6667,0.6077),则2号氧原子的分数坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】元素的性质与其在周期表中的位置密切相关,回答下列问题:
(1)焰色实验是检测金属元素常用的方法,下列元素不能用焰色实验检测的是____ 。
(2)如表是Fe和Cu的部分数据,I2(Cu)____ I2(Fe)(填“>”或“<”)。
(3)磷酸亚铁锂电池的新能源汽车对减少二氧化碳排放和大气污染具有重要意义。工业上用FeCl3、NH4H2PO4、LiCl及苯胺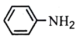 为原料制磷酸亚铁锂电池材料。NH
为原料制磷酸亚铁锂电池材料。NH 的空间构型为
的空间构型为____ ;PO 中P的杂化轨道类型是
中P的杂化轨道类型是____ ;O、P、Cl原子的半径最大的是____ 。(填元素符号)
(4)如图是CuSO4•5H2O结构式,CuSO4•5H2O中Cu2+的配位数是____ 。
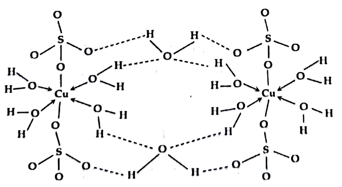
(5)如图是CuSO4•5H2O晶胞的结构图,一个晶胞中有____ 个CuSO4•5H2O。
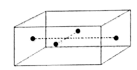
(6)用硫酸铜晶体(CuSO4•5H2O相对分子质量为250)配制0.10mol/L的硫酸铜溶液1000mL时,应称取晶体____ g。
(1)焰色实验是检测金属元素常用的方法,下列元素不能用焰色实验检测的是
| A.Fe | B.Cu | C.Ba | D.Ca |
| 元素 | 核外电子排布式 | 第一电离能I1(kJ·mol-1) | 第二电离能I2(kJ·mol-1) |
| Fe | [Ar]3d64s2 | 762 | |
| Cu | [Ar]3d104s1 | 746 |
 为原料制磷酸亚铁锂电池材料。NH
为原料制磷酸亚铁锂电池材料。NH 的空间构型为
的空间构型为 中P的杂化轨道类型是
中P的杂化轨道类型是(4)如图是CuSO4•5H2O结构式,CuSO4•5H2O中Cu2+的配位数是

(5)如图是CuSO4•5H2O晶胞的结构图,一个晶胞中有

(6)用硫酸铜晶体(CuSO4•5H2O相对分子质量为250)配制0.10mol/L的硫酸铜溶液1000mL时,应称取晶体
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】(1)基态Co原子的电子排布式为_______ 。
(2)BF3与一定量的水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R:
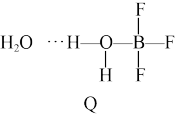
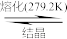
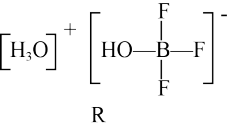
晶体Q中各种微粒间的作用力不涉及_______ (填序号)。
a.离子键 b.共价键 c. 配位键 d.金属键
(3)NaF和NaCl属于同一主族的钠盐,但NaF的硬度比NaCl大,原因是_______ 。
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为_______ 。
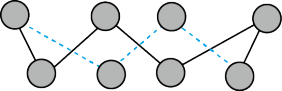
(5)第一电离能介于B、N之间的第二周期元素有_______ 种。S单质的常见形式为S8,其环状结构如图所示,该分子中S原子采用的轨道杂化方式是_______ 。
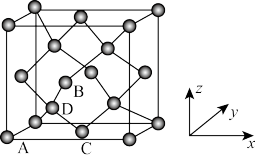
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,图为金刚石的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子坐标参数为
,0)。则D原子坐标参数为_______ 。②晶胞参数,描述晶胞的大小和形状,已知金刚石的晶胞参数a=356.89pm,其密度为_______ g•cm-3。(列出计算式即可,不必计算出结果)
(2)BF3与一定量的水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R:

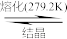

晶体Q中各种微粒间的作用力不涉及
a.离子键 b.共价键 c. 配位键 d.金属键
(3)NaF和NaCl属于同一主族的钠盐,但NaF的硬度比NaCl大,原因是
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为
(5)第一电离能介于B、N之间的第二周期元素有

(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,图为金刚石的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子坐标参数为
,0)。则D原子坐标参数为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】回答下列问题:
(1)砷在元素周期表中的位置_______ 。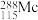 的中子数为
的中子数为_______ 。已知:P(s,白磷)=P(s,黑磷)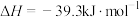 ;P(s,白磷)=P(s,红磷)
;P(s,白磷)=P(s,红磷)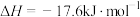 ;由此推知,其中最稳定的磷单质是
;由此推知,其中最稳定的磷单质是_______ 。
(2)氮和磷氢化物性质的比较:热稳定性:
_______  (填“>”或“<”)。沸点:
(填“>”或“<”)。沸点:
_______ 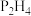 (填“>”或“<”),判断依据是
(填“>”或“<”),判断依据是_______ 。
(3) 和
和 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对 与HI反应产物的推断正确的是
与HI反应产物的推断正确的是_______ (填序号)。
a.不能与NaOH反应 b.含离子键、共价键 c.能与水反应
(4) 能发生较强烈的水解,生成难溶的SbOCl,写出该反应的化学方程式
能发生较强烈的水解,生成难溶的SbOCl,写出该反应的化学方程式_______ ,因此,配制 溶液应注意
溶液应注意_______ 。
(5)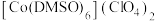 是一种紫色晶体,
是一种紫色晶体,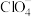 的空间构型为
的空间构型为_______ ,DMSO是二甲基亚砜,化学式为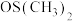 ,其中S原子杂化方式是
,其中S原子杂化方式是_______ 。晶体中所含非金属元素的电负性由大到小的顺序为_______ 。
(6)下表为 、
、 不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,
不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知, 比较稳定的配离子配位数是
比较稳定的配离子配位数是_______ (填“4”或“6”), 性质活泼,易被还原,但
性质活泼,易被还原,但 很稳定,可能的原因是
很稳定,可能的原因是_______ 。
(1)砷在元素周期表中的位置
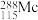 的中子数为
的中子数为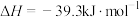 ;P(s,白磷)=P(s,红磷)
;P(s,白磷)=P(s,红磷)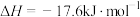 ;由此推知,其中最稳定的磷单质是
;由此推知,其中最稳定的磷单质是(2)氮和磷氢化物性质的比较:热稳定性:

 (填“>”或“<”)。沸点:
(填“>”或“<”)。沸点:
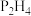 (填“>”或“<”),判断依据是
(填“>”或“<”),判断依据是(3)
 和
和 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对 与HI反应产物的推断正确的是
与HI反应产物的推断正确的是a.不能与NaOH反应 b.含离子键、共价键 c.能与水反应
(4)
 能发生较强烈的水解,生成难溶的SbOCl,写出该反应的化学方程式
能发生较强烈的水解,生成难溶的SbOCl,写出该反应的化学方程式 溶液应注意
溶液应注意(5)
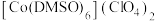 是一种紫色晶体,
是一种紫色晶体,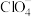 的空间构型为
的空间构型为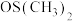 ,其中S原子杂化方式是
,其中S原子杂化方式是(6)下表为
 、
、 不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,
不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知, 比较稳定的配离子配位数是
比较稳定的配离子配位数是 性质活泼,易被还原,但
性质活泼,易被还原,但 很稳定,可能的原因是
很稳定,可能的原因是| 离子 | 配位数 | 晶体场稳定化能(Dq) |
 | 6 | -8Dq+2p |
| 4 | -5.34Dq+2p | |
 | 6 | -12Dq+3p |
| 4 | -3.56Dq+3p |
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】硼原子有3个价电子,但有4个价轨道,这种价电子数少于价轨道数的原子称作缺电子原子。因此,硼的一些化合物表现出缺电子特征。回答下列问题:
(1)BF3与NH3可通过___________ 键形成氨合三氟化硼(BF3·NH3),在该键中由___________ 原子提供空轨道。
(2)硼酸分子结构简式可写为B(OH)3,其晶体为层型片状结构,容易在层与层之间裂解,这是因为在平面层内硼酸分子之间通过___________ 结合,而层与层之间通过___________ 结合。
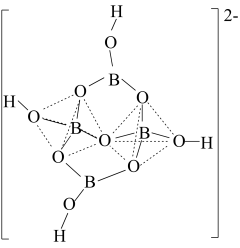
(3)硼砂是硼含氧酸的重要钠盐,其阴离子的结构如图所示,其中B原子的杂化方式为___________ 。硼砂晶体中结晶水与硼的物质的量比为2:1,硼砂的化学式为___________ 。
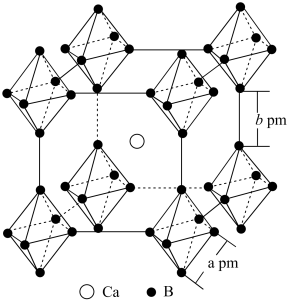
(4)固态硼化物可用作耐火材料、火箭外壳和涡轮机的叶片等,在超导领域也有重要应用潜质。如图为一种金属钙硼化物的立方晶胞,该化合物的化学式为___________ ,钙原子的配位数为___________ 。若由硼原子组成的正八面体棱长为apm,连接两个八面体的B—B键长为bpm,该物质的密度为___________ g·cm-3(列表达式)。
(1)BF3与NH3可通过
(2)硼酸分子结构简式可写为B(OH)3,其晶体为层型片状结构,容易在层与层之间裂解,这是因为在平面层内硼酸分子之间通过
(3)硼砂是硼含氧酸的重要钠盐,其阴离子的结构如图所示,其中B原子的杂化方式为

(4)固态硼化物可用作耐火材料、火箭外壳和涡轮机的叶片等,在超导领域也有重要应用潜质。如图为一种金属钙硼化物的立方晶胞,该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】铜及其化合物在生产生活中有着广泛的应用。请回答下列问题:
(1)铜元素位于元素周期表中第四周期________ 族,属于元素周期表中________ 区元素,基态Cu原子有___________ 种不同能级的电子。
(2)元素铜与镍的第二电离能分别为:ICu=1958 kJ·mol-1、INi=1753 kJ·mol-1, ICu>INi的原因是________________________________________________________ 。
(3)硫化亚铜和氧化亚铜均为离子晶体,二者比较,熔点较高的是氧化亚铜,原因为_________________________________________ 。
(4)某含铜化合物的离子结构如图1所示。

①该离子中存在的作用力有______________ (填标号)。
A.离子键 B.共价键 C.配位键 D.氢键 E.范德华力
②该离子中碳原子的杂化类型有____________ 。
(5)CuCl2和CuCl是铜的两种氯化物。
①图2中表示的是________ (填“CuCl2”或“CuCl”)的晶胞。
②原子坐标参数可用来表示晶胞内部各原子的相对位置。图2中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为____________ 。
③已知图2所示晶胞中C、D两原子核间距为298pm,阿伏加 德罗常数的值为NA,则该晶体密度为___________________ g·cm-3(列出计算式即可)。
(1)铜元素位于元素周期表中第四周期
(2)元素铜与镍的第二电离能分别为:ICu=1958 kJ·mol-1、INi=1753 kJ·mol-1, ICu>INi的原因是
(3)硫化亚铜和氧化亚铜均为离子晶体,二者比较,熔点较高的是氧化亚铜,原因为
(4)某含铜化合物的离子结构如图1所示。

①该离子中存在的作用力有
A.离子键 B.共价键 C.配位键 D.氢键 E.范德华力
②该离子中碳原子的杂化类型有
(5)CuCl2和CuCl是铜的两种氯化物。
①图2中表示的是
②原子坐标参数可用来表示晶胞内部各原子的相对位置。图2中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为
③已知图2所示晶胞中C、D两原子核间距为298pm,阿伏加 德罗常数的值为NA,则该晶体密度为
您最近一年使用:0次



