第四周期的 Cr、Fe、Co、Ni、Cu、Zn 等许多金属能形成配合物。
(1)NH3 是一种很好的配体,氨气分子是_____ (填“极性”或“非极性”)分子,NH3 的沸 点_____ (填“高于”“等于”或“低于”)AsH3。
(2)科学家通过 X 射线测得胆矾的结构示意图可简单表示如下:
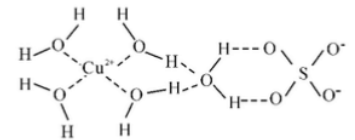
图中虚线表示的作用力为_________________________ 。
(3)胆矾溶液与氨水在一定条件下可以生成 Cu(NH3)4SO4•H2O 晶体。在 Cu(NH3)4SO4·H2O 晶体中,含 有的原子团或分子有:[Cu(NH3)4]2+、NH3、 SO42 、H2O,[Cu(NH3)4]2+为平面正方形结构,则 VSEPR 模型为四面体结构的原子团或分子是_____________ ,其中心原子的杂化轨道类型是________________ 。
(4)金属镍粉在 CO 气流中轻微加热,生成无色挥发性液态 Ni(CO)4,呈正四面体构型。Ni(CO)4 易溶于_____________________ (填编号)。
a . 水 b. 四氯化碳 c. 苯 d. 硫酸镍溶液
(1)NH3 是一种很好的配体,氨气分子是
(2)科学家通过 X 射线测得胆矾的结构示意图可简单表示如下:

图中虚线表示的作用力为
(3)胆矾溶液与氨水在一定条件下可以生成 Cu(NH3)4SO4•H2O 晶体。在 Cu(NH3)4SO4·H2O 晶体中,含 有的原子团或分子有:[Cu(NH3)4]2+、NH3、 SO42 、H2O,[Cu(NH3)4]2+为平面正方形结构,则 VSEPR 模型为四面体结构的原子团或分子是
(4)金属镍粉在 CO 气流中轻微加热,生成无色挥发性液态 Ni(CO)4,呈正四面体构型。Ni(CO)4 易溶于
a . 水 b. 四氯化碳 c. 苯 d. 硫酸镍溶液
更新时间:2018-04-20 09:33:24
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】铁在人类物质文明的发展进程中起到重要的作用。回答下列问题:
(1)人体血液中含有铁元素,其存在形式的基态电子排布式为_______ 。
(2)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在,其中Fe采取的杂化类型为_______ ,固态FeCl3的晶体类型为_______ 。
(3)Fe能与CO形成配合物Fe(CO)5。该配合物分子中有_______ 个σ键和_______ 个π键,所含三种元素原子的第一电离能从大到小的顺序为:_______ ,CH4的键角比H2O大的原因是:_______ 。
(4)Fe3+离子和K4[Fe(CN)6]反应生成蓝色沉淀,被称为普鲁士蓝,普鲁士蓝颜色很深,原因是_______ ,其晶体部分结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),Fe3+在晶体中的配位数是_______ ,已知图示立方体边长为a pm,则该晶体密度为_______ g·cm-3(写出表达式,用NA表示阿伏加德罗常数的值)。
(1)人体血液中含有铁元素,其存在形式的基态电子排布式为
(2)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在,其中Fe采取的杂化类型为
(3)Fe能与CO形成配合物Fe(CO)5。该配合物分子中有
(4)Fe3+离子和K4[Fe(CN)6]反应生成蓝色沉淀,被称为普鲁士蓝,普鲁士蓝颜色很深,原因是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】I.CO2的循环利用是“碳达峰、碳中和”主要措施。
(1)据VSEPR理论可知CO2中心原子价层电子对数为_______
(2)CO2与环氧丙烷 ( )一定条件下反应生成可降解塑料(
)一定条件下反应生成可降解塑料( ),写出反应的化学方程式
),写出反应的化学方程式_______
II.工业上用Cu-ZnO作催化剂通过反应①来生产甲醇,同时也会有副反应②发生。
① CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g) CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
(3)已知298K时,相关物质的能量如图所示,则ΔH1=_______ kJ/mol,(保留三位有效数字),反应①低温_______ 自发进行(填“能”、“不能”)。

(4)在恒温恒容的容器中,充入0.5mol CO2(g)和1.0mol H2(g),起始压强为p kPa,一段时间后达到平衡测得容器中生成0.3mol H2O(g),压强为 p kPa,反应②的平衡常数Kp=
p kPa,反应②的平衡常数Kp=_______ (列出计算式即可)。(分压=物质的量分数×总压,用平衡分压代替平衡浓度计算的平衡常数即为Kp)。
(5)下列说法中不正确的是_______
III.催化加氢合成乙烯是CO2综合利用研究的热点领域,其反应为:2CO2(g)+6H2(g) C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
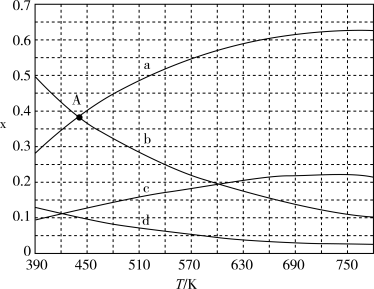
(6)理论计算表明,原料初始组成 ,在体系压强为0.1MPa条件下反应,反应达到平衡时,四种组分的物质的量分数x与温度T的变化关系如图所示,则图中表示C2H4变化的曲线是
,在体系压强为0.1MPa条件下反应,反应达到平衡时,四种组分的物质的量分数x与温度T的变化关系如图所示,则图中表示C2H4变化的曲线是_______ ,该反应△H _______ 0(填“>”、“<”或“=”)
(1)据VSEPR理论可知CO2中心原子价层电子对数为
(2)CO2与环氧丙烷 (
 )一定条件下反应生成可降解塑料(
)一定条件下反应生成可降解塑料(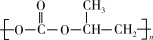 ),写出反应的化学方程式
),写出反应的化学方程式II.工业上用Cu-ZnO作催化剂通过反应①来生产甲醇,同时也会有副反应②发生。
① CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1②CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2(3)已知298K时,相关物质的能量如图所示,则ΔH1=

(4)在恒温恒容的容器中,充入0.5mol CO2(g)和1.0mol H2(g),起始压强为p kPa,一段时间后达到平衡测得容器中生成0.3mol H2O(g),压强为
 p kPa,反应②的平衡常数Kp=
p kPa,反应②的平衡常数Kp=(5)下列说法中不正确的是_______
| A.向容器中充入He,使体系压强增大,可增大反应速率 |
| B.向容器中再充入H2可提高CO2转化率 |
C.当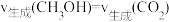 时,说明反应达到了平衡状态 时,说明反应达到了平衡状态 |
| D.选择合适的催化剂,不但可以加快反应速率,还可提高甲醇的平衡产率 |
III.催化加氢合成乙烯是CO2综合利用研究的热点领域,其反应为:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)(6)理论计算表明,原料初始组成
 ,在体系压强为0.1MPa条件下反应,反应达到平衡时,四种组分的物质的量分数x与温度T的变化关系如图所示,则图中表示C2H4变化的曲线是
,在体系压强为0.1MPa条件下反应,反应达到平衡时,四种组分的物质的量分数x与温度T的变化关系如图所示,则图中表示C2H4变化的曲线是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分中,中心原子价层电子对数不同于其他分子的是___________ 。气态三氧化硫以单分子形式存在,其分子的空间结构为___________ 形;固体三氧化硫中存在如图所示的三聚分子,该分子中S原子的杂化轨道类型为___________ 。

(2)分子中的大π键可用符号 表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为
),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为___________ 。SO2分子中键角∠OSO___________  中键角∠ONO(填“>”、“<”、“=”)。
中键角∠ONO(填“>”、“<”、“=”)。
(3)乙烯酮在室温下可聚合成二聚乙烯酮(结构简式为 ),二聚乙烯酮分子中含有的π键与σ键的数目之比为
),二聚乙烯酮分子中含有的π键与σ键的数目之比为___________ 。下图中表示的碳原子能量最高的是___________ (填字母)。
A. B.
B.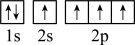
C. D.
D.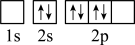
(4)三甲胺 和乙二胺
和乙二胺 均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
均属于胺,但三甲胺比乙二胺的沸点低得多,原因是___________ 。C60的熔点比金刚石、石墨熔点低的原因是___________ 。
(5)在冰晶体中除氢键外,还存在范德华力 。已知冰的升华热是
。已知冰的升华热是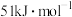 ,请估算冰中氢键的作用能为多少
,请估算冰中氢键的作用能为多少___________  。
。
(1)根据价层电子对互斥理论,H2S、SO2、SO3的气态分中,中心原子价层电子对数不同于其他分子的是

(2)分子中的大π键可用符号
 表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为 ),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为
),已知SO2分子中含有5对孤电子对,则SO2中的大π键应表示为 中键角∠ONO(填“>”、“<”、“=”)。
中键角∠ONO(填“>”、“<”、“=”)。(3)乙烯酮在室温下可聚合成二聚乙烯酮(结构简式为
 ),二聚乙烯酮分子中含有的π键与σ键的数目之比为
),二聚乙烯酮分子中含有的π键与σ键的数目之比为A.
 B.
B.
C.
 D.
D.
(4)三甲胺
 和乙二胺
和乙二胺 均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
均属于胺,但三甲胺比乙二胺的沸点低得多,原因是(5)在冰晶体中除氢键外,还存在范德华力
 。已知冰的升华热是
。已知冰的升华热是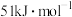 ,请估算冰中氢键的作用能为多少
,请估算冰中氢键的作用能为多少 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】铜具有多种化合物,在工业生产中有重要作用。如醋酸二氨合铜溶液用来吸收合成氨工业中的CO,防止催化剂中毒,该反应是:[Cu(NH3)2]Ac+CO+NH3⇌[Cu(NH3)3CO]Ac(Ac-代表CH3COO-)。回答下列问题:
(1)基态铜原子的核外电子排布式为_______ 。
(2)C、N、O三种元素的电负性由大到小的顺序为_______ 。
(3)NH3的VSEPR构型为_______ ,CO的电子式为_______ 。
(4)配合物[Cu(NH3)3CO]Ac中铜元素的化合价为_______ ,中心原子的配位数为_______ ,CH3COO-中碳原子的杂化方式为_______ ,该化合物存在的化学键类型为_______ 。
(5)从电子排布的角度解释一价铜比二价铜稳定的原因_______ 。
(6)铜的另一种化合物CuCl可用作有机合成的催化剂,其晶胞结构如图所示,则晶胞中Cu的配位数为_______ ,已知晶胞中Cu与Cl的最短距离为apm,则晶体密度ρ=_______ g/cm3(用NA表示阿伏加德罗常数)。
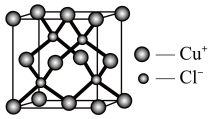
(1)基态铜原子的核外电子排布式为
(2)C、N、O三种元素的电负性由大到小的顺序为
(3)NH3的VSEPR构型为
(4)配合物[Cu(NH3)3CO]Ac中铜元素的化合价为
(5)从电子排布的角度解释一价铜比二价铜稳定的原因
(6)铜的另一种化合物CuCl可用作有机合成的催化剂,其晶胞结构如图所示,则晶胞中Cu的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】过渡元素铁可形成多种配合物,如黄血盐[K4Fe(CN)6]、普鲁士蓝、血红素等
(1)已知:3K4Fe(CN)6]=2KCN + Fe3C + 3C + (CN)2↑ +2N2↑
①(CN)2分子中σ键和π键的数目比为n(σ)﹕n(π)=____ 。
②(CN)2在一定条件下氢化可以得到乙二胺(H2NCH2CH2NH2),乙二胺易溶于水,除因为是极性分子外,还可能的原因是____ 。
(2)普鲁士蓝的化学式为Fe4[Fe(CN)6]3,写出外界离子基态核外电子排布式____ 。
(3)血红素(如图)是血红蛋白的合成原料之一,血红色中的N原子的杂化类型为____ ,请用“→”在图中标出Fe2+的配位键_________ 。
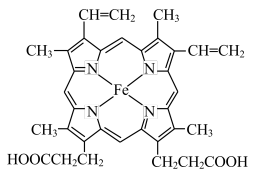
(1)已知:3K4Fe(CN)6]=2KCN + Fe3C + 3C + (CN)2↑ +2N2↑
①(CN)2分子中σ键和π键的数目比为n(σ)﹕n(π)=
②(CN)2在一定条件下氢化可以得到乙二胺(H2NCH2CH2NH2),乙二胺易溶于水,除因为是极性分子外,还可能的原因是
(2)普鲁士蓝的化学式为Fe4[Fe(CN)6]3,写出外界离子基态核外电子排布式
(3)血红素(如图)是血红蛋白的合成原料之一,血红色中的N原子的杂化类型为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p 轨道上有4个电子。元素Z 的原子最外层电子数是其内层的3倍。
(1)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是__________ 。
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是________________ 。
(3)Y 与Z 可形成YZ42-
①YZ42-的空间构型为________ (用文字描述)。
②写出一种与YZ42-互为等电子体的分子的化学式:______________ 。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为________________ 。
(1)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是
(3)Y 与Z 可形成YZ42-
①YZ42-的空间构型为
②写出一种与YZ42-互为等电子体的分子的化学式:
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】均由两种短周期元素组成的A、B、C、D四种化合物分子都含有18个电子,四种化合物分子中所含原子的数目依次为2、3、4、6。A和C分子中各元素原子的个数比均为1:1,B和D分子中各元素原子的个数比均为1:2。D可作为火箭推进剂的燃料。请回答下列问题。
(1)A与HF相比,其沸点较低,原因是____ 。
(2)B分子的立体构型为____ 形,该分子属于____ (填“极性”或“非极性”)分子。
(3)A、B两种化合物分子的非氢元素原子的最高价氧化物对应的水化物的酸性强弱顺序为____ (用化学式表示),设A分子的非氢元素原子为X,B分子的中心原子为Y,比较下列物质的酸性强弱:HXO_____ HXO3____ HXO4(填“>”“<”或“=”,下同);H2YO3____ H2YO4。
(4)D分子中心原子的杂化方式是____ ,由该原子组成的单质分子中包含____ 个π键,与该单质分子互为等电子体的常见分子的分子式为___ 。
(1)A与HF相比,其沸点较低,原因是
(2)B分子的立体构型为
(3)A、B两种化合物分子的非氢元素原子的最高价氧化物对应的水化物的酸性强弱顺序为
(4)D分子中心原子的杂化方式是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】以下物质①HF②H2③H2O④N2⑤C2H4⑥H2O2⑦NaCl(填序号)
(1)只含有极性键的是____________________________________________ ;
(2)既含有极性键又含有非极性键的是______________________________ ;
(3)属于极性分子的是____________________________________________ ;
(4)既有σ键又有π键的是_______________________________________ ;
(5)含有s—sσ键的是____________________________________________ ;
(6)以上物质为固体时,属于离子晶体的是____________________________ 。
(1)只含有极性键的是
(2)既含有极性键又含有非极性键的是
(3)属于极性分子的是
(4)既有σ键又有π键的是
(5)含有s—sσ键的是
(6)以上物质为固体时,属于离子晶体的是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Fe的基态原子价电子排布式为___________ 。
②Ti的基态原子共有________ 种不同能级的电子。
(2)制备 的反应为
的反应为 。
。
①上述化学方程式中 是
是___________ (“极性”或“非极性”)分子。
② 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中
分子中 键和
键和 键的个数比为
键的个数比为___________ ,该分子的空间结构为___________ 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中 和
和 的离子半径分别为
的离子半径分别为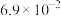 nm和
nm和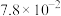 nm。则熔点:NiO
nm。则熔点:NiO___________ FeO(填“>”“<”或“=”)。
(4)镧镍合金( )具有很强的储氢能力,其晶胞结构如图,其中x=
)具有很强的储氢能力,其晶胞结构如图,其中x=___________ 。已知晶胞体积为V ,若储氢后形成
,若储氢后形成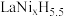 (氢进入晶胞空隙,晶胞体积不变),
(氢进入晶胞空隙,晶胞体积不变), 为阿伏加德罗常数的值,则氢在合金中的密度为
为阿伏加德罗常数的值,则氢在合金中的密度为___________  。(用含V、
。(用含V、 的代数式表示)。
的代数式表示)。 。
。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Fe的基态原子价电子排布式为
②Ti的基态原子共有
(2)制备
 的反应为
的反应为 。
。①上述化学方程式中
 是
是②
 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中
分子中 键和
键和 键的个数比为
键的个数比为(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中
 和
和 的离子半径分别为
的离子半径分别为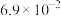 nm和
nm和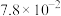 nm。则熔点:NiO
nm。则熔点:NiO(4)镧镍合金(
 )具有很强的储氢能力,其晶胞结构如图,其中x=
)具有很强的储氢能力,其晶胞结构如图,其中x= ,若储氢后形成
,若储氢后形成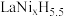 (氢进入晶胞空隙,晶胞体积不变),
(氢进入晶胞空隙,晶胞体积不变), 为阿伏加德罗常数的值,则氢在合金中的密度为
为阿伏加德罗常数的值,则氢在合金中的密度为 。(用含V、
。(用含V、 的代数式表示)。
的代数式表示)。 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】利用铜萃取剂M,通过如下反应实现铜离子的富集:
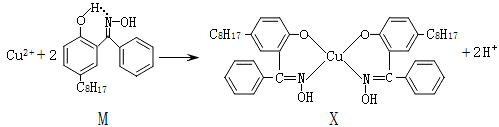
(1)X难溶于水、易溶于有机溶剂,其晶体类型为________ 。
(2)M所含元素的电负性由大到小顺序为_______ ,N原子以_____ 轨道与O原子形成σ键。
(3)上述反应中断裂和生成的化学键有______ (填序号)。
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
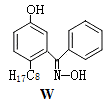
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_____ 。
(5)基态Cu2+的外围电子排布式为________ ,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是___________ 。

(1)X难溶于水、易溶于有机溶剂,其晶体类型为
(2)M所含元素的电负性由大到小顺序为
(3)上述反应中断裂和生成的化学键有
a.离子键
b.配位键
c.金属键
d.范德华力
e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是

(5)基态Cu2+的外围电子排布式为
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
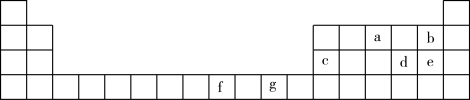
试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为_____ ,中心原子的杂化形式为______ ;d的最高价氧化物的分子构型为______ ,中心原子的杂化形式为______ ,该分子是______ (填“极性”或“非极性”)分子。
(2)b、d、e三种元素的氢化物中的沸点最高的是_____ ,原因是______ 。
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式______ (必须将配位键表示出来)。
(4)f(NH3)5BrSO4可形成两种配合物 ,已知f3+的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为________ ,该配合物的配体是_______ 、_______ ;
(5)c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。

若已知c的原子半径为r,NA代表阿伏加 德罗常数,c的相对原子质量为M。该晶体的密度为______ (用字母表示)。

试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为
(2)b、d、e三种元素的氢化物中的沸点最高的是
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式
(4)f(NH3)5BrSO4可形成两种配合物 ,已知f3+的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为
(5)c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。

若已知c的原子半径为r,NA代表阿伏加 德罗常数,c的相对原子质量为M。该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】【化学-物物质结构与性质】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期.自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子.D的基态原子的最外能层只有一个电子.其他能层均己充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素.其基态原子的价电子排布图为_________ .第一电离能最小的元素是______ (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是_________ (填化学式),呈现如此递变规律的原因是___________________ 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为______ 、另一种的晶胞如图二所示,若此晶胞中的棱长为356.6pm,则此晶胞的密度为______ g•cm-3(保留两位有效数字).( )
)
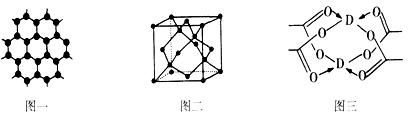
(4)D元素形成的单质,其晶体的堆积模型为_________ ,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是_______ (填选项序号).
①极性键②非极性键③配位键④金属键
(1)这四种元素中电负性最大的元素.其基态原子的价电子排布图为
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为
 )
)
(4)D元素形成的单质,其晶体的堆积模型为
①极性键②非极性键③配位键④金属键
您最近一年使用:0次



