(1)科学家提出可通过铁的氧化物由CO2制取C,其太阳能工艺如图所示。
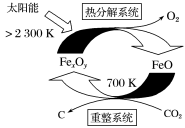
①“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为________ 。
②“热分解系统”中每分解1molFexOy,转移电子的物质的量为________ 。
(2)工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1
则以CO2和H2反应合成甲醚的热化学方程式为_________________ 。
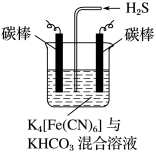
(3)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。通电电解,然后通入H2S时发生反应的离子方程式为2[Fe(CN)6]3-+2CO32-+H2S===2[Fe(CN)6]4-+2HCO3-+S↓。电解时,阳极的电极反应式为_______________ ;电解过程中阴极区溶液的pH________ (填“变大”、“变小”或“不变”)。

①“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为
②“热分解系统”中每分解1molFexOy,转移电子的物质的量为
(2)工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1
则以CO2和H2反应合成甲醚的热化学方程式为
(3)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。通电电解,然后通入H2S时发生反应的离子方程式为2[Fe(CN)6]3-+2CO32-+H2S===2[Fe(CN)6]4-+2HCO3-+S↓。电解时,阳极的电极反应式为

更新时间:2018-12-14 05:25:21
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】氧化还原滴定是常用的定量分析方法。
(1)实验室里欲用KMnO4固体来配制240mL 0.1 mol·L-1的KMnO4酸性溶液。
①需用的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、________ 。
②整个配制溶液过程中,玻璃棒所起的作用有________________ 、________________ 。
③下列操作会导致所配溶液浓度偏小的是________ (填字母序号)
a.加水定容时俯视刻度线 b.容量瓶内壁附有水珠而未干燥处理
c.未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶
d.颠倒摇匀后发现凹液面低于刻度线又加水补上
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的含量。
①写出该反应的离子方程式________________________________ 。
②若消耗3.16g KMnO4,则该反应转移的电子数目为________________ 。
(3)高锰酸钾溶液会与盐酸反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,用单线桥标出反应中电子转移的方向和数目。___________ 。
(4)测定某葡萄洒中Na2S2O5残留量时,用碘标准液进行滴定。滴定反应的离子方程式为_______________ 。
(1)实验室里欲用KMnO4固体来配制240mL 0.1 mol·L-1的KMnO4酸性溶液。
①需用的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、
②整个配制溶液过程中,玻璃棒所起的作用有
③下列操作会导致所配溶液浓度偏小的是
a.加水定容时俯视刻度线 b.容量瓶内壁附有水珠而未干燥处理
c.未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶
d.颠倒摇匀后发现凹液面低于刻度线又加水补上
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的含量。
①写出该反应的离子方程式
②若消耗3.16g KMnO4,则该反应转移的电子数目为
(3)高锰酸钾溶液会与盐酸反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,用单线桥标出反应中电子转移的方向和数目。
(4)测定某葡萄洒中Na2S2O5残留量时,用碘标准液进行滴定。滴定反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
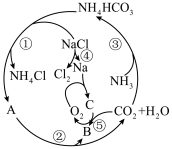
【推荐2】某些化合物具有如图所示的转化关系,其中A、B、C均为含有钠元素的化合物,部分转化的条件省略。 极易溶于水。
极易溶于水。
回答下列问题:
(1)A为___________ (填化学式,下同),B为___________ ,C为___________
(2) 的摩尔质量为
的摩尔质量为___________ ;要获得高浓度的 溶液,需向水中先通入
溶液,需向水中先通入___________ (填“ ”或“
”或“ ”)。
”)。
(3)反应④中氧化产物和还原产物的质量之比为___________ (填最简整数比);反应⑤中转移 电子时,生成
电子时,生成___________  (换算成标准状况下)
(换算成标准状况下) 。
。
(4)现有 由A、B形成的混合物,加入
由A、B形成的混合物,加入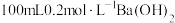 溶液(过量),充分反应后,过滤、洗涤、干燥,称量所得固体质量为
溶液(过量),充分反应后,过滤、洗涤、干燥,称量所得固体质量为 。
。
①配制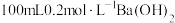 溶液需要的玻璃仪器有烧杯、量筒、玻璃棒、
溶液需要的玻璃仪器有烧杯、量筒、玻璃棒、___________ ;配制过程中,下列情况会导致配制结果偏低的是___________ 。(填标号)。
a.称量的 中含有少量
中含有少量
b.定容时未冷却至室温
c.定容时溶液超过刻度线,迅速用胶头滴管吸出多余液体
d.将配制好的溶液倒入试剂瓶中时有少量液体溅到试剂瓶外
② 原混合物中,A与B的物质的量之比
原混合物中,A与B的物质的量之比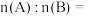
___________ (填最简整数比)。
 极易溶于水。
极易溶于水。回答下列问题:
(1)A为
(2)
 的摩尔质量为
的摩尔质量为 溶液,需向水中先通入
溶液,需向水中先通入 ”或“
”或“ ”)。
”)。(3)反应④中氧化产物和还原产物的质量之比为
 电子时,生成
电子时,生成 (换算成标准状况下)
(换算成标准状况下) 。
。(4)现有
 由A、B形成的混合物,加入
由A、B形成的混合物,加入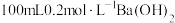 溶液(过量),充分反应后,过滤、洗涤、干燥,称量所得固体质量为
溶液(过量),充分反应后,过滤、洗涤、干燥,称量所得固体质量为 。
。①配制
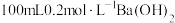 溶液需要的玻璃仪器有烧杯、量筒、玻璃棒、
溶液需要的玻璃仪器有烧杯、量筒、玻璃棒、a.称量的
 中含有少量
中含有少量
b.定容时未冷却至室温
c.定容时溶液超过刻度线,迅速用胶头滴管吸出多余液体
d.将配制好的溶液倒入试剂瓶中时有少量液体溅到试剂瓶外
②
 原混合物中,A与B的物质的量之比
原混合物中,A与B的物质的量之比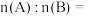
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】工业上有多种脱硫、脱硝的方法,具体如下:
Ⅰ、二氧化氯(ClO2)是黄绿色、易溶于水的气体,具有强氧化性,可用于烟气中SO2和NO的脱除。研究表明:ClO2氧化SO2和NO的反应历程与下列反应有关。
已知基元反应:aA(g)+bB(g)=cC(g)+dD(g),其速率方程表达式为v=k·ca(A)·cb(B)
实验测得:ClO2分别对纯SO2、纯NO以及同时氧化的氧化率随时间(t)的变化情况如图所示。据此分析:
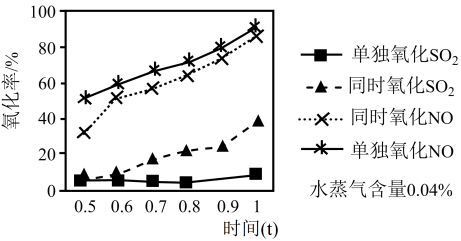
(1)其它因素都相同,判断ClO2氧化SO2的活化能___________ (填“>”或“<”)ClO2氧化NO的活化能;
(2)NO的存在___________ (填“会”或“不会”)影响ClO2氧化SO2的速率。请结合①、③、④的速率常数分析原因___________ 。
Ⅱ、NaClO溶液在不同温度下也可对硫、硝脱除,一定时间内,其脱除率如图所示。
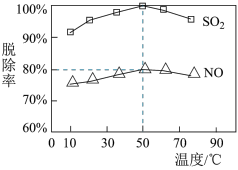
(3)SO2脱除率高于NO,可能的原因是___________ (写两点)。
(4)烟气中SO2和NO体积比为4:1,烟气与50℃时的吸收液转化生成的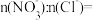
___________ 。
Ⅲ、CO也可以与NO反应生成无污染物:2CO(g)+2NO(g) N2(g)+2CO2(g)。设为相对压力平衡常数,其计算表达式写法为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为KPa)除以P0(P0=100KPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100KPa的恒容容器中进行上述反应。
N2(g)+2CO2(g)。设为相对压力平衡常数,其计算表达式写法为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为KPa)除以P0(P0=100KPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100KPa的恒容容器中进行上述反应。
(5)以下物理量不再发生变化时,能说明反应达平衡的是___________ 。
a.CO与NO转化率之比 b.混合气体的密度
c.混合气体的平均相对分子质量 d.v(CO):v(N2)=2:1
(6)体系达到平衡时N2的分压为20KPa,则该反应的相对压力平衡常数
___________ 。
Ⅰ、二氧化氯(ClO2)是黄绿色、易溶于水的气体,具有强氧化性,可用于烟气中SO2和NO的脱除。研究表明:ClO2氧化SO2和NO的反应历程与下列反应有关。
| 序号 | 反应机理(基元反应) | 反应热 | 速率常数 | |
| 脱硝 | ① | NO(g)+ClO2(g)=NO2(g)+ClO(g) | ΔH1 | k1=1.7×1011mL·mol-1·s-1 |
| ② | NO(g)+ClO(g)=NO2(g)+Cl(g) | ΔH2 | k2=8.8×1012mL·mol-1·s-1 | |
| 脱硫 | ③ | SO2(g)+ClO2(g)=SO3(g)+ClO(g) | ΔH3 | k3=2.1×10-4mL·mol-1·s-1 |
| ④ | SO2(g)+ClO(g)=SO3(g)+Cl(g) | ΔH4 | k4=6.9×1011mL·mol-1·s-1 |
已知基元反应:aA(g)+bB(g)=cC(g)+dD(g),其速率方程表达式为v=k·ca(A)·cb(B)
实验测得:ClO2分别对纯SO2、纯NO以及同时氧化的氧化率随时间(t)的变化情况如图所示。据此分析:

(1)其它因素都相同,判断ClO2氧化SO2的活化能
(2)NO的存在
Ⅱ、NaClO溶液在不同温度下也可对硫、硝脱除,一定时间内,其脱除率如图所示。

(3)SO2脱除率高于NO,可能的原因是
(4)烟气中SO2和NO体积比为4:1,烟气与50℃时的吸收液转化生成的
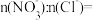
Ⅲ、CO也可以与NO反应生成无污染物:2CO(g)+2NO(g)
 N2(g)+2CO2(g)。设为相对压力平衡常数,其计算表达式写法为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为KPa)除以P0(P0=100KPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100KPa的恒容容器中进行上述反应。
N2(g)+2CO2(g)。设为相对压力平衡常数,其计算表达式写法为:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为KPa)除以P0(P0=100KPa)。在某温度下,原料组成n(CO):n(NO)=1:1,初始总压为100KPa的恒容容器中进行上述反应。(5)以下物理量不再发生变化时,能说明反应达平衡的是
a.CO与NO转化率之比 b.混合气体的密度
c.混合气体的平均相对分子质量 d.v(CO):v(N2)=2:1
(6)体系达到平衡时N2的分压为20KPa,则该反应的相对压力平衡常数

您最近一年使用:0次
【推荐1】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________ 。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示:
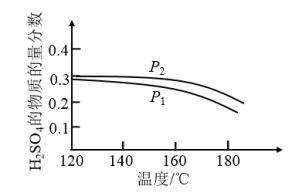
p2_______ p 1(填“>”或“<”)。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+_________ =_________ +_______ +2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到 2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=__________ 。
②比较A、B、C,可得出的结论是______________________ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________ 。
(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示。则b电极上的电极反应式为__________________ 。


(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示:

p2
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到 2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| 序号 | A | B | C | D |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示。则b电极上的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】利用太阳能光解水,制备的H2用于还原CO2合成甲醇,可实现资源的再利用。
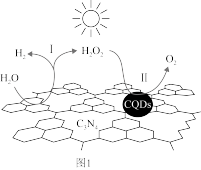
(1)中国科学家研究的复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光高效分解水,其原理如图1所示。反应Ⅰ的化学方程式为___ 。
(2)H2和CO、CO2在催化剂的作用下合成甲醇的主要反应如下:
第一步:CO2(g)+H2(g) CO(g)+H2O(g)ΔH1=+41kJ·mol-1
CO(g)+H2O(g)ΔH1=+41kJ·mol-1
第二步:CO(g)+2H2(g) CH3OH(g)ΔH2=-99kJ·mol-1
CH3OH(g)ΔH2=-99kJ·mol-1
①CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH=
CH3OH(g)+H2O(g)ΔH=___ 。
②第二步反应中的相关的化学键键能(E)数据如表,试计算x=___ 。
(3)在水溶液中电解CO2生成甲醇的原理如图2所示。
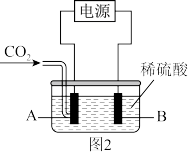
①写出A电极生成甲醇的电极反应式:___ 。
②A极生成1mol甲醇时,B极生成气体在标准状况下的体积是___ 。
(4)如图3所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失)。请回答下列问题:

①分别指出F电极、②电极的名称___ 、___ 。
②图中④电极的反应式:___ 。E电极的反应式:___ 。图中①电极上产生的实验现象是___ 。
③若A池中原混合液的体积为500mL,CuSO4、K2SO4浓度均为0.1mol/L,电解过程中A池中共收集到标准状况下的气体___ L。A池中pH的变化___ (填“增大”,“减小”或“不变”)
(1)中国科学家研究的复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光高效分解水,其原理如图1所示。反应Ⅰ的化学方程式为

(2)H2和CO、CO2在催化剂的作用下合成甲醇的主要反应如下:
第一步:CO2(g)+H2(g)
 CO(g)+H2O(g)ΔH1=+41kJ·mol-1
CO(g)+H2O(g)ΔH1=+41kJ·mol-1第二步:CO(g)+2H2(g)
 CH3OH(g)ΔH2=-99kJ·mol-1
CH3OH(g)ΔH2=-99kJ·mol-1①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)ΔH=
CH3OH(g)+H2O(g)ΔH=②第二步反应中的相关的化学键键能(E)数据如表,试计算x=
| 化学键 | H-H | C-O | C≡O(CO) | H-O | C-H |
| E/kJ·mol-1 | 436 | x | 1076 | 465 | 413 |

①写出A电极生成甲醇的电极反应式:
②A极生成1mol甲醇时,B极生成气体在标准状况下的体积是
(4)如图3所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失)。请回答下列问题:

①分别指出F电极、②电极的名称
②图中④电极的反应式:
③若A池中原混合液的体积为500mL,CuSO4、K2SO4浓度均为0.1mol/L,电解过程中A池中共收集到标准状况下的气体
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】请在标有序号的空白处填空:
(1)利用催化剂可使NO和CO发生反应:2NO(g)+2CO(g)⇌2CO2(g)+N2(g)ΔH<0.已知增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面表中。
①请填全表中的各空格;
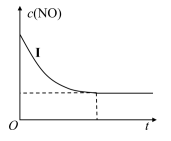
②实验Ⅰ中,NO的物质的量浓度(c)随时间(t)的变化如图所示。
请在给出的坐标图中画出实验Ⅱ、Ⅲ中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号_____ 。
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=64.39kJ∙mol-1
2H2O2(l)=2H2O(l)+O2(g) ΔH=196.46kJ∙mol-1
H2(g)+ O2(g)=H2O(l) ΔH=-285.84kJ∙mol-1
O2(g)=H2O(l) ΔH=-285.84kJ∙mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为_____ .
(3)25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
①CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为_____ .
②体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数_____ (填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是_____ .

(4)①求常温下pH=2的H2SO4溶液中由H2O电离的c(H+)和c(OH-).
c(H+)=_____ ,c(OH-)=_____ 。
②在某温度时,测得0.01mol∙L-1的NaOH溶液pH=11,在此温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合,若所得混合液为中性,且a+b=12,则Va:Vb=_____ 。
(1)利用催化剂可使NO和CO发生反应:2NO(g)+2CO(g)⇌2CO2(g)+N2(g)ΔH<0.已知增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面表中。
①请填全表中的各空格;
| 实验 编号 | T(℃) | NO初始浓度 (mol∙L-1) | CO初始浓度 (mol∙L-1) | 催化剂的比表 面积(m2∙g-1) |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 1.2×10-3 | 124 | ||
| Ⅲ | 350 | 82 |
②实验Ⅰ中,NO的物质的量浓度(c)随时间(t)的变化如图所示。
请在给出的坐标图中画出实验Ⅱ、Ⅲ中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号

(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=64.39kJ∙mol-1
2H2O2(l)=2H2O(l)+O2(g) ΔH=196.46kJ∙mol-1
H2(g)+
 O2(g)=H2O(l) ΔH=-285.84kJ∙mol-1
O2(g)=H2O(l) ΔH=-285.84kJ∙mol-1在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为
(3)25℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
①CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为
②体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数

(4)①求常温下pH=2的H2SO4溶液中由H2O电离的c(H+)和c(OH-).
c(H+)=
②在某温度时,测得0.01mol∙L-1的NaOH溶液pH=11,在此温度下,将pH=a的NaOH溶液VaL与pH=b的硫酸VbL混合,若所得混合液为中性,且a+b=12,则Va:Vb=
您最近一年使用:0次
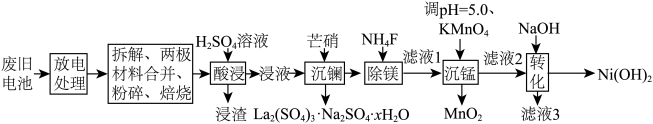
【推荐1】氢镍电池适合大电流放电,常用作动力电池,其负极材料M为Ni、石墨粉和少量La、Mg、MnO2,放电时电池反应为NiOOH+MH=Ni(OH)2+M。实验室对废旧氢镍电池进行综合处理,回收部分金属资源的工艺流程如图:
已知:Ni2+可形成[Ni(NH3)6]2+配离子;Ksp(MgF2)=5.2×10-11;H2SO4第一步完全电离,Ka(HSO )=1.1×10-2。回答下列问题:
)=1.1×10-2。回答下列问题:
(1)氢镍电池充电时,阴极反应式为______ ;“放电处理”的目的为______ 。
(2)“酸浸”所得浸渣中几乎不含MnO2的原因为______ 。
(3)“沉镧”工序中,溶液的pH与沉镧率的变化关系如图所示。pH<2.0时,沉镧率降低的原因为______ 。

(4)“除镁”所得滤液1中c(F-)=1.0×10-2mol•L-1,则c(Mg2+)=_____ ;该工序不能使用玻璃仪器的原因为______ 。
(5)“沉锰”反应的离子方程式为______ 。
(6)“转化”所用试剂不宜选用氨水的原因为______ ;滤液3中可提取出的循环利用的物质为______ (填化学式)。

已知:Ni2+可形成[Ni(NH3)6]2+配离子;Ksp(MgF2)=5.2×10-11;H2SO4第一步完全电离,Ka(HSO
 )=1.1×10-2。回答下列问题:
)=1.1×10-2。回答下列问题:(1)氢镍电池充电时,阴极反应式为
(2)“酸浸”所得浸渣中几乎不含MnO2的原因为
(3)“沉镧”工序中,溶液的pH与沉镧率的变化关系如图所示。pH<2.0时,沉镧率降低的原因为

(4)“除镁”所得滤液1中c(F-)=1.0×10-2mol•L-1,则c(Mg2+)=
(5)“沉锰”反应的离子方程式为
(6)“转化”所用试剂不宜选用氨水的原因为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】已知A、B、C、E的焰色反应均为黄色,其中B常作食品的膨化剂,A与C按任意比例混合,溶于足量的水中,得到的溶质也只含有一种,并有无色、无味的气体D放出。X为一种黑色固体单质,X也有多种同素异形体,其氧化物之一参与大气循环,为温室气体,G为冶炼铁的原料,G溶于盐酸中得到两种盐。A~H之间有如下的转化关系(部分物质未写出):
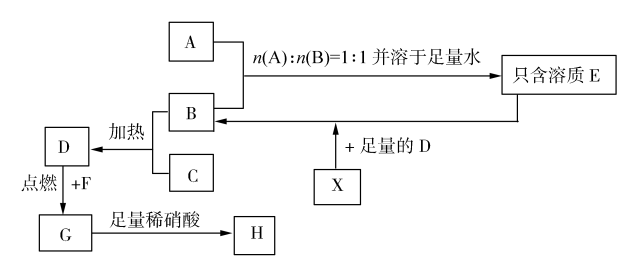
(1)写出物质的化学式:A______________ ;F______________ 。
(2)物质C的电子式为______________ 。
(3)写出G与稀硝酸反应的离子方程式:____________________________ 。
(4)已知D→G转化过程中,转移4 mol电子时释放出a kJ热量,写出该反应的热化学方程式:____________________________ 。
(5)科学家用物质X的一种同素异形体为电极,在酸性介质中用N2、H2为原料,采用电解原理制得NH3,写出电解池阴极的电极反应方程式:____________________ 。

(1)写出物质的化学式:A
(2)物质C的电子式为
(3)写出G与稀硝酸反应的离子方程式:
(4)已知D→G转化过程中,转移4 mol电子时释放出a kJ热量,写出该反应的热化学方程式:
(5)科学家用物质X的一种同素异形体为电极,在酸性介质中用N2、H2为原料,采用电解原理制得NH3,写出电解池阴极的电极反应方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
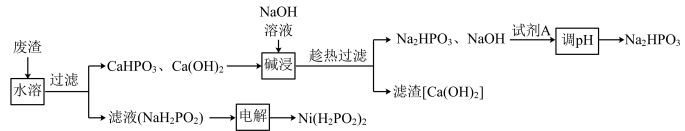
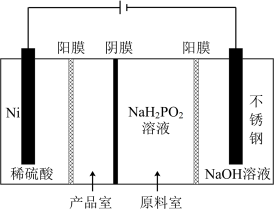
【推荐3】次磷酸钠(NaH2PO2)广泛应用于电镀、材料等行业,在生产 NaH2PO2 的过程中会产生大量废渣[主要含 NaH2PO2和 CaHPO3,还含有少量 Ca(OH)2], 一种回收 NaH2PO2实现废渣资源化利用的工艺流程如图:
已知:CaHPO3和 Ca(OH)2的 Ksp 分别为 1 ×10-4和 6 ×10-6,H3PO3为二元中强酸。
回答下列问题:
(1)“碱浸”发生反应的化学方程式为__________ 。
(2)“试剂 A”的化学式为_________ 。
(3)电解 NaH2PO2溶液可制得 Ni(H2PO2)2,后者广泛用于化学镀镍,电解 NaH2PO2 溶液装置如图所示。阴极的电极反应式为__________ ,产品室能得到Ni(H2PO2)2的原理是_________ 。
(4)化学镀镍的方法是:将镀件置于一定浓度的Ni(H2PO2)2溶液中,加入NaOH溶液至碱性,产生的Ni可均匀地沉积在镀件上(同时生成 ),发生反应的离子方程式为
),发生反应的离子方程式为________ 。

已知:CaHPO3和 Ca(OH)2的 Ksp 分别为 1 ×10-4和 6 ×10-6,H3PO3为二元中强酸。
回答下列问题:
(1)“碱浸”发生反应的化学方程式为
(2)“试剂 A”的化学式为
(3)电解 NaH2PO2溶液可制得 Ni(H2PO2)2,后者广泛用于化学镀镍,电解 NaH2PO2 溶液装置如图所示。阴极的电极反应式为

(4)化学镀镍的方法是:将镀件置于一定浓度的Ni(H2PO2)2溶液中,加入NaOH溶液至碱性,产生的Ni可均匀地沉积在镀件上(同时生成
 ),发生反应的离子方程式为
),发生反应的离子方程式为
您最近一年使用:0次



