元素周期表前四周期A、B、C、D、E五种元素,A元素的原子最外层电子排布式为ms1;B元素的原子价电子排布式为ns2np2;C元素位于第二周期且原子中p能级与s能级电子总数相等;D元素原子的M能层的p能级中有3个未成对电子;E元素原子有五个未成对电子。
(1)E元素原子的价电子排布式是______ ,在元素周期表中位置是_____ ,其最高价氧化物的化学式是__________ 。
(2)C基态原子的电子排布图为_____ ,若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于_____ 键(填“σ”或“π”)。
(3)当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是_______ 。
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的电负性由大到小的顺序是_____ (用元素符号表示)。
(1)E元素原子的价电子排布式是
(2)C基态原子的电子排布图为
(3)当n=3时,B与C形成的化合物与氢氧化钠溶液反应的离子方程式是
(4)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的电负性由大到小的顺序是
更新时间:2019-05-27 09:23:49
|
相似题推荐
【推荐1】利用配合物诱导免疫原性细胞死亡是一种很有前途的癌症免疫治疗策略。近日,中山大学科研团队报道了一例基于铱(Ⅲ)配合物的非小细胞肺癌ICD诱导剂(Ir1),可诱发癌细胞的死亡。回答下列问题:
(1)铱(Ir)在周期表中的位置为第六周期第九列,化合物中常见价态有+3和+4价,其中+4价更稳定,原因是_______ 。IrCl4为有机合成中常用的催化剂,该物质熔点350℃,在熔化时难以发生电离,其固体的晶体类型是_______ ;K3IrBr6是高强度曝光的增敏剂,用于激光照相材料,其阴离子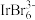 中Ir的价层电子对数为6,该离子的空间结构为
中Ir的价层电子对数为6,该离子的空间结构为_______ 。
(2)非小细胞肺癌ICD诱导剂(Ir1)为带有一个单位电荷的阳离子,其结构如图所示。该离子中N的杂化方式有_______ 种;1 mol该离子中N原子形成的配位键有_______ mol。


(3)原子分数坐标可用于表示晶胞内部各原子的相对位置。化合物IrO2的四方晶格结构如图所示:

晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如表所示:
一个晶胞中有_______ 个O,其他Ir原子分数坐标为_______ ,晶体中与单个O键合的Ir有_______ 个。已知IrO2的晶胞参数为a pm、a pm、c pm,晶体密度为ρ g/cm3,设NA为阿伏加德罗常数的值,则IrO2的摩尔质量为_______ g/mol(用代数式表示)。
(1)铱(Ir)在周期表中的位置为第六周期第九列,化合物中常见价态有+3和+4价,其中+4价更稳定,原因是
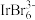 中Ir的价层电子对数为6,该离子的空间结构为
中Ir的价层电子对数为6,该离子的空间结构为(2)非小细胞肺癌ICD诱导剂(Ir1)为带有一个单位电荷的阳离子,其结构如图所示。该离子中N的杂化方式有


(3)原子分数坐标可用于表示晶胞内部各原子的相对位置。化合物IrO2的四方晶格结构如图所示:

晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如表所示:
| 坐标 原子 | x | y | z |
| Ir | 0 | 0 | 0 |
| O | 0.25 | 0.25 | 0 |
一个晶胞中有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
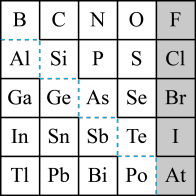
(1)元素Ga在元素周期表中的位置为:__________ (写明周期和族)。
(2)Sn的最高正价为______ ,Cl的最高价氧化物对应水化物的化学式为_____ ,As的气态氢化物为_____ 。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是_____ (填化学式)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4_____ H2SeO4(填“>”、“<”或“=”)。
③氢化物的还原性:H2O_____ H2S(填“>”、“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找_____ (填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)①Se2Cl2常用作分析试剂,其电子式为_________ 。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。 下列说法正确的是_____ (填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(6)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。

(1)元素Ga在元素周期表中的位置为:
(2)Sn的最高正价为
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是
②H3AsO4、H2SeO4的酸性强弱:H3AsO4
③氢化物的还原性:H2O
(4)可在图中分界线(虚线部分)附近寻找
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)①Se2Cl2常用作分析试剂,其电子式为
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。 下列说法正确的是
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(6)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
| 实验步骤 | 实验现象与结论 |
| 在试管中加入 | 现象: 结论:非金属性C>Si |
您最近一年使用:0次
【推荐3】周期表前四周期的元素a、b、c、d、e原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)e的价层电子排布式为__________ 。b、c、d三种元素中第一电离能最大的是_____ (填元素名称);
(2)a和其他四种元素形成的二元共价化合物分子中既含有极性共价键、又含有非极性共价键的化合物是__________ (填化学式,写出两种);
(3)这五种元素的原子中有的能形成含氧酸,三角锥结构的酸是__________ (填化学式);酸根是___________
(4)写出由这五种元素中的某些原子构成的,与3个c原子构成的分子互为等电子体的微粒_____ (填化学式,写出两种)。
(1)e的价层电子排布式为
(2)a和其他四种元素形成的二元共价化合物分子中既含有极性共价键、又含有非极性共价键的化合物是
(3)这五种元素的原子中有的能形成含氧酸,三角锥结构的酸是
(4)写出由这五种元素中的某些原子构成的,与3个c原子构成的分子互为等电子体的微粒
您最近一年使用:0次
【推荐1】氮(N)、磷(P)、砷(As)等都是ⅤA 族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)N、P、As的第一电离能由大到小的顺序为_______ ;As原子价层电子的电子排布式为_______ 。
(2)NH3的沸点比PH3_______ (填“高”或“低”),原因是_______ 。
(3)Na3AsO4 中含有的化学键类型包括_______ (填字母)。AsO 的空间构型为
的空间构型为_______ ;As4O6的分子结构如图所示,则在该化合物中As的杂化方式是_______ 。
A.离子键 B.共价键 C.配位键 D.金属键

(1)N、P、As的第一电离能由大到小的顺序为
(2)NH3的沸点比PH3
(3)Na3AsO4 中含有的化学键类型包括
 的空间构型为
的空间构型为A.离子键 B.共价键 C.配位键 D.金属键

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】纳米磷化钻常用于制作特种钻玻璃,制备磷化钻的常用流程如图:
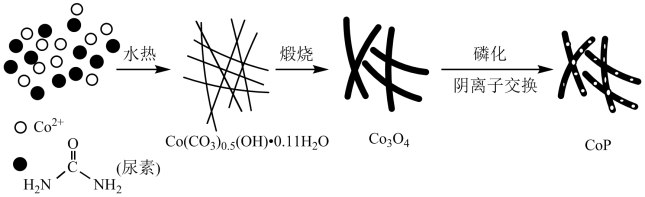
(1)基态P原子的电子排布式为___ 。P在元素周期表中位于___ 区。
(2) 中碳原子的杂化类型是
中碳原子的杂化类型是___ C、N、O三种元素的第一电离能由大到小的顺序是___ (用元素符号表示),电负性由大到小的顺序为___ 。
(3)CO32-中C的价层电子对数为___ ,其空间构型为___ 。
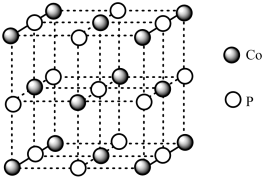
(4)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm。设NA为阿伏加 德罗常数的值, 则其晶胞密度为___ g.cm-3(列出计算式即可)。

(1)基态P原子的电子排布式为
(2)
 中碳原子的杂化类型是
中碳原子的杂化类型是(3)CO32-中C的价层电子对数为
(4)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm。设NA为阿伏加 德罗常数的值, 则其晶胞密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期。
(1) F原子基态的外围核外电子排布式为_________;
(2)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为_________;
(3)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为_________;
(4)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、CH2=CHCHO、HCOOH. CH3COONO2(PAN)等二次污染物。
①下列说法正确的是_________
A. N2O为直线型分子
B. C、N、O的第一电离能依次增大
C. CH2=CHCHO分子中碳原子均采用sp2杂化
D.相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配体为_________ (填微粒符号)。
(5) 白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).已知晶胞的边长为a cm,阿伏加德罗常数为NAmol-l,则该晶胞中含有的P原子的个数为_________,该晶体的密度为_________ g•cm-3(用含NA、a的式子表示)

(1) F原子基态的外围核外电子排布式为_________;
(2)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为_________;
(3)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为_________;
(4)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、CH2=CHCHO、HCOOH. CH3COONO2(PAN)等二次污染物。
①下列说法正确的是_________
A. N2O为直线型分子
B. C、N、O的第一电离能依次增大
C. CH2=CHCHO分子中碳原子均采用sp2杂化
D.相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配体为_________ (填微粒符号)。
(5) 白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子).已知晶胞的边长为a cm,阿伏加德罗常数为NAmol-l,则该晶胞中含有的P原子的个数为_________,该晶体的密度为_________ g•cm-3(用含NA、a的式子表示)

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】稀土有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为_______ 。
(2)铌的混合配体离子[Nd(H2O)6Cl2]+中,配体是_______ (填“微粒符号”)。
(3)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+CH2I-CH2I→SmI2+CH2=CH2↑。CH2I-CH2I中碳原子杂化轨道类型为_______ ,1molCH2=CH2中含有的σ键数目为_______ 。常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是_______ 。
(4)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173℃,100℃以上升华,二茂铁属于_______ 晶体。
(5)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行_______ 实验,其中阴离子的空间构型是_______ ,并写出其等电子体的分子是_______ (填化学式),该化合物加热时首先失去的组分是H2O,原因是_______ 。
(6)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。

与Mg紧邻的Ni有_______ 个。该晶体的化学式为_______ 。
(1)钒广泛用于催化及钢铁工业,基态钒原子的价层电子排布图为
(2)铌的混合配体离子[Nd(H2O)6Cl2]+中,配体是
(3)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+CH2I-CH2I→SmI2+CH2=CH2↑。CH2I-CH2I中碳原子杂化轨道类型为
(4)二茂铁又叫双环戊二烯基铁[Fe(C5H5)2],熔点是172.5~173℃,100℃以上升华,二茂铁属于
(5)铜可以形成一种离子化合物[Cu(NH3)4(H2O)2]SO4,若要确定[Cu(NH3)4(H2O)2]SO4是晶体还是非晶体,最科学的方法是对其进行
(6)最近发现,只含镁、镍和碳三种元素的晶体也具有超导性,该物质形成的晶体的立方晶胞结构如图所示。

与Mg紧邻的Ni有
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】一种Ru络合物与g-C3N4复合光催化剂将CO,还原为HCOOH的原理图如图所示。

(1)基态碳原子的价电子排布图为_____________ 。
(2)1molHCOOH中含有的σ键数目为_____________ ,HCOOH的沸点比CO2高的原因为_____________ 。
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为_____________
(4)Ru络合物中与Ru配位的原子有N、_____________ 。
(5)Ru络合物含有的片段 和
和 中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是
中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是_____________ (填“前者”或“后者”)。
(6)一种类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。

①g-C3N4中氮原子的杂化类型是_____________ 。
②根据图2,在图1中用平行四边形画出一个最小重复单元。_____________
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加 德罗常数的值为NA,则g-C3N4的密度为____ g.cm-3。

(1)基态碳原子的价电子排布图为
(2)1molHCOOH中含有的σ键数目为
(3)Ru络合物中第二周期元素的第一电离能由大到小的顺序为
(4)Ru络合物中与Ru配位的原子有N、
(5)Ru络合物含有的片段
 和
和 中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是
中氮原子均采用sp2杂化,都存在大π键,氮原子配位能力更强的是(6)一种类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。

①g-C3N4中氮原子的杂化类型是
②根据图2,在图1中用平行四边形画出一个最小重复单元。
③已知该晶胞的体积为Vcm3,中间层原子均在晶胞内部。设阿伏加 德罗常数的值为NA,则g-C3N4的密度为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】现有七种元素A、B、C、D、E、F、G,其中A、B、C为三个不同周期的短周期元素,E、F、G为第四周期元素。请根据下列相关信息,回答问题。
(1)C基态原子中能量最高的电子,其电子云在空间有____ 个方向,原子轨道呈____ 形,C简单离子核外有___ 种运动状态不同的电子。
(2)①一般情况下,同种物质为固态时密度大于其液态,但固态A2B的密度比其液态时小,原因是___ ;
②A2B2难溶于CS2,简要说明理由:________ 。
(3)G位于____ 族___ 区,它的一种氧化物常用于工业生产硫酸的催化剂,已知G在该氧化物中的化合价等于其价电子数,则该氧化物的化学式为____ ;
(4)ED3分子的VSEPR模型名称为____ ,其中E原子的杂化轨道类型为____ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数与s电子数相等 |
| C基态原子的价电子排布为nsn-1npn+1 |
| D的能层数与C相同,且电负性比C大 |
| E元素的主族序数与周期数的差为1,且第一电离能比同周期相邻两种元素都大 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第五列 |
(2)①一般情况下,同种物质为固态时密度大于其液态,但固态A2B的密度比其液态时小,原因是
②A2B2难溶于CS2,简要说明理由:
(3)G位于
(4)ED3分子的VSEPR模型名称为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】前四周期元素X、Y、Z、W、Q的原子序数依次增大,基态X原子核外电子占据4个原子轨道,非金属元素Z的基态原子在不同形状的原子轨道中运动的电子数相等,基态W原子是前四周期中未成对电子数最多的元素,Q与W的原子序数相差3。回答下列问题:
(1)基态W原子价层电子的轨道表示式为_______ ,其核外电子的空间运动状态有_______ 种。
(2)基态Q原子核外电子占据能量最高的能级符号为_______ ,Q元素在周期表中的位置为_______ 。
(3)元素X、Y、Z的电负性由小到大的顺序是_______ (用化学式表示,下同),元素X、Y、Z的第一电离能由小到大的顺序是_______ 。
(4)元素X、Y、Z的最简单氢化物属于非极性分子的是_______ (用化学式表示)。
(5)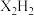 分子中
分子中 键和
键和 键的数目之比为
键的数目之比为_______ ,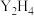 分子中Y原子的杂化方式
分子中Y原子的杂化方式_______ 。
(6)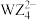 离子的空间构型为
离子的空间构型为_______ 。
(1)基态W原子价层电子的轨道表示式为
(2)基态Q原子核外电子占据能量最高的能级符号为
(3)元素X、Y、Z的电负性由小到大的顺序是
(4)元素X、Y、Z的最简单氢化物属于非极性分子的是
(5)
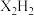 分子中
分子中 键和
键和 键的数目之比为
键的数目之比为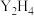 分子中Y原子的杂化方式
分子中Y原子的杂化方式(6)
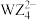 离子的空间构型为
离子的空间构型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图所示

(1)基态Zn2+核外价电子排布图为_____ ;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的排列顺序为_____ 。
(2)甘氨酸(H2N-CH2-COOH)的羧基中C原子的杂化轨道类型为_____ ;甘氨酸易溶于水,试从结构角度解释:_____ 。
(3)以氧化锌矿物为原料,提取锌的过程中涉及反应:Zn+2NH3+ 2NH4+= [Zn(NH3)4]2++H2O。与NH4+互为等电子体的阴离子为_____ (写出1种即可);[Zn(NH3)4]2+离子结构示意图:____________ 。
(4) [Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为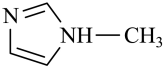 ,则1mol IMI中含有
,则1mol IMI中含有_____ 个σ键;常温下IMI的某种衍生物与甘氨酸形成的离子化合物 为液态而非固态,其原因是
为液态而非固态,其原因是_____ 。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_____ ;六棱柱底边边长为a cm,高为c cm,阿伏加 德罗常数的值为NA,则Zn的密度为_____ g•cm-3(列出算式即可)。


(1)基态Zn2+核外价电子排布图为
(2)甘氨酸(H2N-CH2-COOH)的羧基中C原子的杂化轨道类型为
(3)以氧化锌矿物为原料,提取锌的过程中涉及反应:Zn+2NH3+ 2NH4+= [Zn(NH3)4]2++H2O。与NH4+互为等电子体的阴离子为
(4) [Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为
 ,则1mol IMI中含有
,则1mol IMI中含有 为液态而非固态,其原因是
为液态而非固态,其原因是(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铜及其化合物在很多领域有重要的用途,如氧化亚铜(Cu2O)可做半导体材料,胆矾(CuSO4·5H2O)用于杀菌剂,磷酸氧铜[Cu4O(PO4)2]能充当电极的活性物质。请回答下列相关问题。
(1)写出基态Cu+离子的核外电子排布式____________________ ,与Cu同周期且与Cu原子最外层电子数相等的元素有______________________ (填元素符号)。
(2)胆矾和磷酸氧铜中含有的非金属元素,其电负性由大到小的顺序为______________________ 。
(3)PO43-的VSEPR模型为______________________ ,中心原子P的杂化类型为___________ ,与其互为等电子体的离子有______________________ (写出两种)。
(4)胆矾(CuSO4• 5H2O)的结构示意图如下图,请结合示意图完成下列问题。
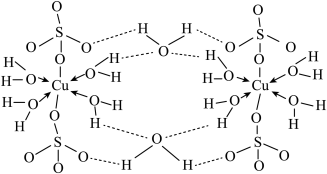

①将胆矾的化学式写成配合物的形式为______________________ 。
②胆矾中含有的微粒间作用力有______________________ (填序号)。
a.离子键b.极性键c.金属键d.配位键e.氢键f.非极性键
(5)胆矾在高温条件下会失水、分解生成CuO,加热CuO还会继续分解为Cu2O。
①Cu2O的熔点比Cu2S的__________ (填“高”或“低”),原因是____________________ 。
②CuO的晶胞结构如上图所示,O2-的配位数是__________ 。
(1)写出基态Cu+离子的核外电子排布式
(2)胆矾和磷酸氧铜中含有的非金属元素,其电负性由大到小的顺序为
(3)PO43-的VSEPR模型为
(4)胆矾(CuSO4• 5H2O)的结构示意图如下图,请结合示意图完成下列问题。


①将胆矾的化学式写成配合物的形式为
②胆矾中含有的微粒间作用力有
a.离子键b.极性键c.金属键d.配位键e.氢键f.非极性键
(5)胆矾在高温条件下会失水、分解生成CuO,加热CuO还会继续分解为Cu2O。
①Cu2O的熔点比Cu2S的
②CuO的晶胞结构如上图所示,O2-的配位数是
您最近一年使用:0次



