100mL浓度为2mol•L-1的硫酸与过量锌粒反应,为加快反应速率,又不影响生成氢气的总量,可采取的方法是________ 。
A.加入适量的6mol•L-1的硫酸
B.将锌粒改为锌粉
C.加入适量的KCl溶液
D.升高溶液温度
E.加入适量硫酸铜
A.加入适量的6mol•L-1的硫酸
B.将锌粒改为锌粉
C.加入适量的KCl溶液
D.升高溶液温度
E.加入适量硫酸铜
11-12高二上·山东济南·期中 查看更多[1]
(已下线)2011-2012学年山东省济南外国语学校高二上学期期中考试化学(理)试卷
更新时间:2011-12-10 16:12:21
|
相似题推荐
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】结合实验过程,回答相应问题。
(1)使用0.1mol/L硫代硫酸钠溶液、0.1mol/L 溶液与蒸馏水探究反应物浓度对反应速率的影响,实验过程中记录的
溶液与蒸馏水探究反应物浓度对反应速率的影响,实验过程中记录的_______ 可以表征反应速率的大小,写出实验中反应的离子方程式_______ 。
(2)写出酸性重铬酸钾溶液中存在的可逆反应_______ (忽略水的微弱电离),向2mL 0.1mol/L酸性重铬酸钾溶液中加入10滴6mol/L NaOH溶液,观察到溶液颜色由_______ 色变为_______ 色。
(1)使用0.1mol/L硫代硫酸钠溶液、0.1mol/L
 溶液与蒸馏水探究反应物浓度对反应速率的影响,实验过程中记录的
溶液与蒸馏水探究反应物浓度对反应速率的影响,实验过程中记录的(2)写出酸性重铬酸钾溶液中存在的可逆反应
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】在下列事实中,各是什么因素影响了化学反应速率?
(1)集气瓶中氢气和氯气的混合气体,在瓶外点燃镁条时,混合气体爆炸。________________
(2)熔化的KClO3放出气泡速率很慢,撒入少量MnO2很快产生气体。___________
(3)同浓度同体积的盐酸放入同样大小的镁条和铝条,产生气体有快有慢。___________________
(4)夏天食品易变质,而冬天不易发生该现象。___________________
(5)同样大小的石灰石分别在1mol•L-1盐酸和0.1mol•L-1盐酸中反应快慢不同。________________
(1)集气瓶中氢气和氯气的混合气体,在瓶外点燃镁条时,混合气体爆炸。
(2)熔化的KClO3放出气泡速率很慢,撒入少量MnO2很快产生气体。
(3)同浓度同体积的盐酸放入同样大小的镁条和铝条,产生气体有快有慢。
(4)夏天食品易变质,而冬天不易发生该现象。
(5)同样大小的石灰石分别在1mol•L-1盐酸和0.1mol•L-1盐酸中反应快慢不同。
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】某学习小组,用稀HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00mol·L﹣1、2.00mol·L﹣1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.00mL、大理石用量为10.00g。
实验设计如表:
将相应的实验目的填入下列空格中:
(1)实验①和②探究_______ 对该反应速率的影响;
(2)实验①和③探究_______ 对该反应速率的影响;
(3)实验①和④探究_____________ 对该反应速率的影响。
实验设计如表:
| 编号 | T/K | 大理石规格 | HNO3浓度 |
| ① | 298 | 粗颗粒 | 2.00 mol·L﹣1 |
| ② | 298 | 粗颗粒 | 1.00 mol·L﹣1 |
| ③ | 308 | 粗颗粒 | 2.00 mol·L﹣1 |
| ④ | 298 | 细颗粒 | 2.00 mol·L﹣1 |
将相应的实验目的填入下列空格中:
(1)实验①和②探究
(2)实验①和③探究
(3)实验①和④探究
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐1】某化学科研小组研究在其他条件不变时,改变某一条件对某类反应[aA(g)+bB(g)⇌cC(g)]的化学平衡的影响,得到如下图像(图中p表示压强,T表示温度,n表示物质的量,α表示转化率)。
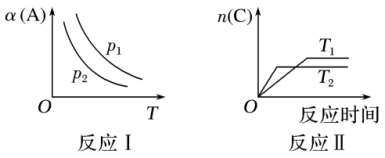
分析图像,回答下列问题:
(1)在反应I中,若p1>p2,则该反应的正反应为_______ (填“放热”或“吸热”)反应,且为气体分子数_______ (填“减小”或“增大”)的反应;若此反应能自发进行,则必须满足的条件是_______ 温(填“高”或“低”)。
(2)在反应II中,T1_______ (填“>”“<”或“=”)T2,该反应的正反应为_______ (填“放热”或“吸热”)反应。

分析图像,回答下列问题:
(1)在反应I中,若p1>p2,则该反应的正反应为
(2)在反应II中,T1
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L﹣1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
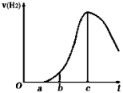
(1)曲线由O→a段不产生氢气的原因是_____________________ ;有关反应的离子方程式为________________________ ;
(2)曲线a→c段,产生氢气的速率增加较快的主要原因________________________________________ ;

(1)曲线由O→a段不产生氢气的原因是
(2)曲线a→c段,产生氢气的速率增加较快的主要原因
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】某探究性学习小组拟通过锌与盐酸的反应研究影响反应速率的因素。该探究性学习小组用相同质量的锌和相同浓度的足量的稀盐酸反应得到的实验数据如表所示:
(1)该实验的目的是探究_______ 、_______ 对锌和稀盐酸反应速率的影响。
(2)实验Ⅰ和Ⅱ表明:_______ ,化学反应速率越快。
(3)能表明固体的表面积对反应速率有影响的实验编号是_______ 和_______ ,实验结论是_______ 。
| 实验编号 | 锌的状态 | 反应温度/℃ | 收集100mL(标准状况)氢气所需时间/s |
| Ⅰ | 薄片 | 15 | 200 |
| Ⅱ | 薄片 | 25 | 90 |
| Ⅲ | 粉末 | 25 | 10 |
(1)该实验的目的是探究
(2)实验Ⅰ和Ⅱ表明:
(3)能表明固体的表面积对反应速率有影响的实验编号是
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
(1)t1=______ s
(2)总结并得出的关于温度影响反应速率的结论是______
(3)t1______ t4(填“>”或“<”),原因是______ 。t2______ t3(填“>”或“<”),原因是______
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为______
| 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于溶液的时间/s | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 细小颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(1)t1=
(2)总结并得出的关于温度影响反应速率的结论是
(3)t1
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】关于化学反应的理论是一个经过简化的概念模型,合理简化的概念模型是研究化学反应原理的基础。反应速率的碰撞理论提出:能引发化学反应的碰撞称为有效碰撞。
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是________ (填“a”“b”或“c”)。


(2)过渡态理论是在碰撞理论的基础上提出的:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。根据图Ⅱ写出相应的热化学方程式:_____________________________________________ 。
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了活化能从而改变了反应的途径。请在图Ⅱ中画出 该反应在其他条件不变,仅使用催化剂而使反应速率加快的能量变化示意图。________
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是


(2)过渡态理论是在碰撞理论的基础上提出的:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。根据图Ⅱ写出相应的热化学方程式:
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了活化能从而改变了反应的途径。请在图Ⅱ中
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:Na2SO3+KIO3+H2SO4→Na2SO4+K2SO4+I2+H2O,
(1)其中氧化剂是__________ ,若反应中有5mol电子转移,则生成碘是_______ mol。该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢) ②IO2-+ SO32-→IO-+SO42-(快)
③5I-+6H++ IO3-→3I2+3H2O(快) ④I2+ SO32-+ H2O→2I-+ SO42-+2H2(快)
(2)根据上述条件推测,此反应的总的反应速率由________ 步反应决定。
(3)若预先加入淀粉溶液,由题述看必在________ 离子消耗完时,才会溶液变蓝的现象产生。
(1)其中氧化剂是
①IO3-+SO32-→IO2-+SO42-(慢) ②IO2-+ SO32-→IO-+SO42-(快)
③5I-+6H++ IO3-→3I2+3H2O(快) ④I2+ SO32-+ H2O→2I-+ SO42-+2H2(快)
(2)根据上述条件推测,此反应的总的反应速率由
(3)若预先加入淀粉溶液,由题述看必在
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】Ⅰ.对于 分解反应,
分解反应, 也有一定的催化作用。为比较
也有一定的催化作用。为比较 和
和 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性分析:如图甲可通过观察___________ ,定性比较得出结论。有同学提出将 改为
改为 更为合理,其理由是
更为合理,其理由是___________ 。
(2)定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是___________ 。
Ⅱ.“碘钟”实验中, 的反应速率可以用
的反应速率可以用 与加入的淀粉溶液显蓝色的时间t来度量,t越小反应速率越大。某探究性学习小组在20℃时进行实验,得到的数据如下表:
与加入的淀粉溶液显蓝色的时间t来度量,t越小反应速率越大。某探究性学习小组在20℃时进行实验,得到的数据如下表:
回答下列问题:
(3)表中
___________ 。
(4)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间 的范围为___________(填字母)。
的范围为___________(填字母)。
(5)通过分析比较上表数据,得到的结论是___________ 。
 分解反应,
分解反应, 也有一定的催化作用。为比较
也有一定的催化作用。为比较 和
和 对
对 分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察
 改为
改为 更为合理,其理由是
更为合理,其理由是(2)定量分析:用图乙所示装置做对照实验,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是
Ⅱ.“碘钟”实验中,
 的反应速率可以用
的反应速率可以用 与加入的淀粉溶液显蓝色的时间t来度量,t越小反应速率越大。某探究性学习小组在20℃时进行实验,得到的数据如下表:
与加入的淀粉溶液显蓝色的时间t来度量,t越小反应速率越大。某探究性学习小组在20℃时进行实验,得到的数据如下表:| 实验编号 | ① | ② | ③ | ④ | ⑤ |
 /(mol·L /(mol·L ) ) | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
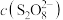 /(mol·L /(mol·L ) ) | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 |  |
(3)表中

(4)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间
 的范围为___________(填字母)。
的范围为___________(填字母)。A.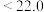 s s | B.22.0~44.0s | C.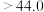 s s | D.数据不足,无法判断 |
(5)通过分析比较上表数据,得到的结论是
您最近一年使用:0次

 Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,试回答:
Fe3O4(s)+4H2(g),在一密闭容器中进行达平衡后,试回答:

