元素铬(Cr)在自然界主要以+3价和+6价存在。回答下列问题:
(1)+6价的Cr能引起细胞变异而对人体不利,可用Na2SO3将Cr2O72-还原为Cr3+,反应的离子方程式为____________________ 。
(2)利用铬铁矿(FeO·Cr2O3)冶炼制取金属铬的工艺流程如图所示:
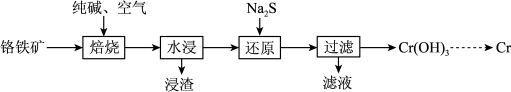
①为加快焙烧速率和提高原料的利用率,可采取的措施是_________ (写一条)。
②“水浸”后,要获得浸出液的操作是_______ 。浸出液的主要成分为Na2CrO4,向“滤液”中加入酸化的氯化钡溶液有白色沉淀生成,则“还原”操作中发生反应的离子方程式为______ 。
③加热Cr(OH)3可得到Cr2O3。从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是_________ 。
(1)+6价的Cr能引起细胞变异而对人体不利,可用Na2SO3将Cr2O72-还原为Cr3+,反应的离子方程式为
(2)利用铬铁矿(FeO·Cr2O3)冶炼制取金属铬的工艺流程如图所示:

①为加快焙烧速率和提高原料的利用率,可采取的措施是
②“水浸”后,要获得浸出液的操作是
③加热Cr(OH)3可得到Cr2O3。从工业成本角度考虑,用Cr2O3制取金属Cr的冶炼方法是
更新时间:2019-10-12 10:56:58
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO)制备草酸镍晶体(NiC2O4·2H2O)的流程如图:

(1)NiC2O4·2H2O中C的化合价是___ 。既能加快“酸浸”反应速率又能提高“酸浸”原料利用率的操作措施为___ 。
(2)“滤渣Ⅰ”的主要成分是___ 。若控制温度为80℃、pH=2时,“除铁”产生的“滤渣Ⅱ”的主要成分为黄钠铁矾[Na2Fe6(SO4)4(OH)12],写出生成黄钠铁矾沉淀的离子方程式:___ 。
(3)已知“滤渣Ⅲ”的主要成分为CaF2,则“萃取”操作中加入有机萃取剂的作用是____ 。
(4)高能锂离子电池的总反应为2Li+FeS=Fe+Li2S。用该电池作电源电解含镍酸性废水回收Ni的装置如图(图中X、Y为电极,LiPF6·SO(CH3)2为电解质)。

①电极Y的反应材料是___ (填化学式);中间隔室b可以得到的主要物质Z是___ (填化学式)。
②电解总反应的离子方程式为___ 。已知F=96500C/mol,若电池工作tmin,维持电流强度为IA,理论回收Ni___ g(写出计算表达式即可)。

(1)NiC2O4·2H2O中C的化合价是
(2)“滤渣Ⅰ”的主要成分是
(3)已知“滤渣Ⅲ”的主要成分为CaF2,则“萃取”操作中加入有机萃取剂的作用是
(4)高能锂离子电池的总反应为2Li+FeS=Fe+Li2S。用该电池作电源电解含镍酸性废水回收Ni的装置如图(图中X、Y为电极,LiPF6·SO(CH3)2为电解质)。

①电极Y的反应材料是
②电解总反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】三氯化六氨合钻[Co(NH3)6]Cl3是一种重要的化工原料。利用含钴废料(含少量Fe、Al等杂质)制取[Co(NH3)6]Cl3的工艺流程如图所示:

已知:①“酸浸”过滤后的滤液中含有Co2+、Fe2+、Fe3+、Al3+等。
②Ksp[Co(OH)2]=1×10-14.2、Ksp[Co(OH)3]=1×10-43.7、Ksp[Fe(OH)3]=1×10-37.4、Ksp[Al(OH)3]=1×10-32.9。溶液中金属离子物质的量浓度低于1.0×10-5 mol/L时,可认为沉淀完全。
③Co2+还原性较弱,但[Co(NH3)6]2+具有较强还原性。
回答下列问题:
(1)Co位于元素周期表_______ ,基态Co2+价层电子的电子排布图为_______ 。
(2)写出除杂过程中NaClO3参与反应的化学方程式_______ 。
(3)“除杂”过程中加Na2CO3调节pH后会生成两种沉淀,同时得到含c(Co2+)=0.1 mol/L的滤液,调节pH的范围为_______ 。
(4)下列说法错误的是_______。
(5)含量测定。通过碘量法可测定产品中的钻元素的含量。称取0.10 g产品加入稍过量的NaOH溶液并加热,将Co完全转化为难溶的Co(OH)3,过滤洗涤后将滤渣完全溶于硫酸中,向所得的溶液中加入过量的KI和2~3滴淀粉溶液,再用0.010 mol/L的Na2S2O3溶液滴定(反应原理:Co3++I-→Co2++I2、I2+ →I-+
→I-+ ),达到滴定终点时消耗Na2S2O3溶液24.00 mL,以下说法正确的是
),达到滴定终点时消耗Na2S2O3溶液24.00 mL,以下说法正确的是_______ 。
A.装有Na2S2O3溶液的酸式滴定管装液前要先检漏、蒸馏水洗、标准液润洗
B.滴定时要适当控制滴定速度,边滴边摇动锥形瓶(接近终点时改为滴加半滴Na2S2O3溶液),直到溶液颜色从无色变为蓝色,达到滴定终点
C.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
(6)计算产品中钴元素的含量为_______ 。(答案保留三位有效数字)

已知:①“酸浸”过滤后的滤液中含有Co2+、Fe2+、Fe3+、Al3+等。
②Ksp[Co(OH)2]=1×10-14.2、Ksp[Co(OH)3]=1×10-43.7、Ksp[Fe(OH)3]=1×10-37.4、Ksp[Al(OH)3]=1×10-32.9。溶液中金属离子物质的量浓度低于1.0×10-5 mol/L时,可认为沉淀完全。
③Co2+还原性较弱,但[Co(NH3)6]2+具有较强还原性。
回答下列问题:
(1)Co位于元素周期表
(2)写出除杂过程中NaClO3参与反应的化学方程式
(3)“除杂”过程中加Na2CO3调节pH后会生成两种沉淀,同时得到含c(Co2+)=0.1 mol/L的滤液,调节pH的范围为
(4)下列说法错误的是_______。
A.制备[Co(NH3)6]3+时,“混合”过程中加入NH4C1的作用是抑制NH3·H2O的电离,防止生成Co(OH)2沉淀,同时参与反应提供 |
| B.稳定常数是指中心原子(或离子)与配体发生反应形成配合物的平衡常数,用K稳表示,K稳值越大,表示生成的配合物越稳定。[Co(NH3)6]2+的K稳值比[Co(NH3)6]3+小 |
| C.“氧化”过程后分离提纯时,将反应后的混合物趁热过滤,待滤液冷却后加入适量浓盐酸的目的是:增大c(Cl-),降低[Co(NH3)6]Cl3在水中的溶解度,有利于其结晶析出 |
| D.为了得到较大颗粒的[Co(NH3)6]Cl3晶体,可采取的措施是将滤液快速冷却 |
 →I-+
→I-+ ),达到滴定终点时消耗Na2S2O3溶液24.00 mL,以下说法正确的是
),达到滴定终点时消耗Na2S2O3溶液24.00 mL,以下说法正确的是A.装有Na2S2O3溶液的酸式滴定管装液前要先检漏、蒸馏水洗、标准液润洗
B.滴定时要适当控制滴定速度,边滴边摇动锥形瓶(接近终点时改为滴加半滴Na2S2O3溶液),直到溶液颜色从无色变为蓝色,达到滴定终点
C.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
(6)计算产品中钴元素的含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】煤中硫的存在形态分为有机硫和无机硫(CaSO4、硫化物及微量单质硫等)。库仑滴定法是常用的快捷检测煤中全硫含量的方法。其主要过程如下图所示。
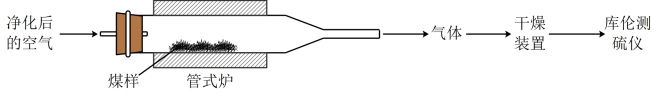
已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含O2、CO2、H2O、N2、SO2。
(1)煤样需研磨成细小粉末,其目的是___________ 。
(2)高温下,煤中CaSO4完全转化为SO2,该反应的化学方程式为___________ 。
(3)通过干燥装置后,待测气体进入库仑测硫仪进行测定。
已知:库仑测硫仪中电解原理示意图如下。检测前,电解质溶液中 保持定值时,电解池不工作。待测气体进入电解池后,SO2溶解并将
保持定值时,电解池不工作。待测气体进入电解池后,SO2溶解并将 还原,测硫仪便立即自动进行电解到
还原,测硫仪便立即自动进行电解到 又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
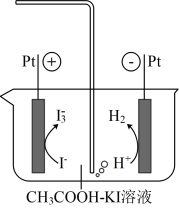
①SO2在电解池中发生反应的离子方程式为___________ 。
②测硫仪工作时电解池的阳极反应式为___________ 。
(4)煤样为ag,电解消耗的电量为x库仑,煤样中硫的质量分数为___________ 。已知:电解中转移1mol电子所消耗的电量为96500库仑。

已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含O2、CO2、H2O、N2、SO2。
(1)煤样需研磨成细小粉末,其目的是
(2)高温下,煤中CaSO4完全转化为SO2,该反应的化学方程式为
(3)通过干燥装置后,待测气体进入库仑测硫仪进行测定。
已知:库仑测硫仪中电解原理示意图如下。检测前,电解质溶液中
 保持定值时,电解池不工作。待测气体进入电解池后,SO2溶解并将
保持定值时,电解池不工作。待测气体进入电解池后,SO2溶解并将 还原,测硫仪便立即自动进行电解到
还原,测硫仪便立即自动进行电解到 又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
①SO2在电解池中发生反应的离子方程式为
②测硫仪工作时电解池的阳极反应式为
(4)煤样为ag,电解消耗的电量为x库仑,煤样中硫的质量分数为
您最近一年使用:0次
【推荐1】工业上利用含锌的物料(含FeO、CuO、FeS、SiO2等杂质)制取活性ZnO并回收Cu的流程如下:

已知该条件下(25℃),上述各种离子开始沉淀和沉淀完全(c=1.0×10-5 mol/L)时的pH如下表所示:
(1)能提高浸出速率的措施有(写出两条)_______ 。
(2)“残渣1”主要成分化学式为_______ 。
(3)“氧化过滤"步骤的主要目的是除去“铁元素”,过程中先加试剂A(选用H2O2溶液),再加氨水,整个过程控制温度在25℃。
①温度不宜过高的原因是_______ 。
②加入氨水调节pH的范围为_______ 。
③调节pH除了使用氨水外,还能选择的氧化物是_______ 。
(4)“氧化过滤”步骤中,滴加氨水到刚好有Fe(OH)3沉淀生成时,lgc(Fe3+)=_______ 。
(5)“沉淀”步骤中将Zn2+转化为ZnCO3,该过程的离子方程式为:_______ 。

已知该条件下(25℃),上述各种离子开始沉淀和沉淀完全(c=1.0×10-5 mol/L)时的pH如下表所示:
| 离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀的pH | 6.3 | 1.5 | 6.2 | 4.7 |
| 沉淀完全的pH | 9.7 | 2.8 | 8.0 | 6.7 |
(2)“残渣1”主要成分化学式为
(3)“氧化过滤"步骤的主要目的是除去“铁元素”,过程中先加试剂A(选用H2O2溶液),再加氨水,整个过程控制温度在25℃。
①温度不宜过高的原因是
②加入氨水调节pH的范围为
③调节pH除了使用氨水外,还能选择的氧化物是
(4)“氧化过滤”步骤中,滴加氨水到刚好有Fe(OH)3沉淀生成时,lgc(Fe3+)=
(5)“沉淀”步骤中将Zn2+转化为ZnCO3,该过程的离子方程式为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】锌的化学性质与铝相似,工业上有较高的利用价值。某含锌废催化剂中锌以氧化物的形式存在,还含有硅、铜、铅等元素杂质,采用“氨浸除杂蒸发煅烧”新工艺生产高纯碱式碳酸锌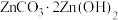 ,达到了废物综合利用的目的,工艺流程如下:
,达到了废物综合利用的目的,工艺流程如下:

(1)“浸取”前,需将含锌废催化剂粉碎并加水制成悬浊液(化浆),目的是_______ 。
(2)“浸取”后的溶液溶质仅含锌氨配合物 ,请写出“浸取”中含锌物质反应的化学方程式为
,请写出“浸取”中含锌物质反应的化学方程式为_______ 。
(3)“浸取”中锌的浸出率对本工艺至关重要,下图是锌浸出率随温度变化影响的曲线图。适宜选择的温度为_______ 左右,温度不宜过高的原因是_______ 。

(4)实验室进行操作Ⅰ时需用到的硅酸盐仪器有_______ 。
(5)“置换”是为了除去滤液中的 、
、 ,也可加入
,也可加入 溶液使其生成硫化物沉淀。已知常温下
溶液使其生成硫化物沉淀。已知常温下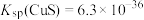 ,
, ,要使溶液中
,要使溶液中 、
、 的浓度均小于
的浓度均小于 ,则沉淀时需要控制的
,则沉淀时需要控制的 浓度至少为
浓度至少为_______  。
。
(6)“蒸氨”中锌氨溶液最终以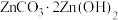 形式从溶液中析出,其化学反应方程式为:
形式从溶液中析出,其化学反应方程式为:_______ 。
(7)本工艺中可以循环利用的物质为_______ 。
 ,达到了废物综合利用的目的,工艺流程如下:
,达到了废物综合利用的目的,工艺流程如下:
(1)“浸取”前,需将含锌废催化剂粉碎并加水制成悬浊液(化浆),目的是
(2)“浸取”后的溶液溶质仅含锌氨配合物
 ,请写出“浸取”中含锌物质反应的化学方程式为
,请写出“浸取”中含锌物质反应的化学方程式为(3)“浸取”中锌的浸出率对本工艺至关重要,下图是锌浸出率随温度变化影响的曲线图。适宜选择的温度为

(4)实验室进行操作Ⅰ时需用到的硅酸盐仪器有
(5)“置换”是为了除去滤液中的
 、
、 ,也可加入
,也可加入 溶液使其生成硫化物沉淀。已知常温下
溶液使其生成硫化物沉淀。已知常温下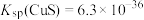 ,
, ,要使溶液中
,要使溶液中 、
、 的浓度均小于
的浓度均小于 ,则沉淀时需要控制的
,则沉淀时需要控制的 浓度至少为
浓度至少为 。
。(6)“蒸氨”中锌氨溶液最终以
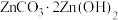 形式从溶液中析出,其化学反应方程式为:
形式从溶液中析出,其化学反应方程式为:(7)本工艺中可以循环利用的物质为
您最近一年使用:0次
【推荐3】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7)。工艺流程及相关物质溶解度曲线如图:
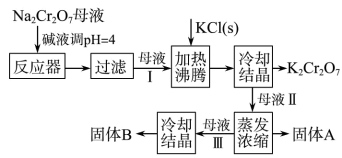
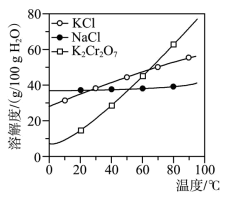
(1)向Na2Cr2O7母液中加碱液调pH的目的是为了除去Fe3+,如何确定母液中Fe3+已除尽?___________
(2)母液Ⅰ的溶质主要为__________ (填化学式);固体B主要为__________ (填化学式)。
(3)流程中要得到母液Ⅲ和固体A的操作为蒸发浓缩、_________ ,原因是________________ 。
(4)工业酸性废水中含 离子会造成铬污染,排放前先将
离子会造成铬污染,排放前先将 还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气。结果溶液的pH值不断升高,溶液由酸性转变为碱性。
还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气。结果溶液的pH值不断升高,溶液由酸性转变为碱性。
①在以上处理过程中, 转化为毒性较低的Cr3+的离子方程式为:
转化为毒性较低的Cr3+的离子方程式为:_________ 。
②在阴极区有Fe(OH)3和Cr(OH)3沉淀生成(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。已知电解后的溶液中c(Cr3+)为3×10-5 mol·L-1,则溶液中c(Fe3+)为________ mol·L-1。


(1)向Na2Cr2O7母液中加碱液调pH的目的是为了除去Fe3+,如何确定母液中Fe3+已除尽?
(2)母液Ⅰ的溶质主要为
(3)流程中要得到母液Ⅲ和固体A的操作为蒸发浓缩、
(4)工业酸性废水中含
 离子会造成铬污染,排放前先将
离子会造成铬污染,排放前先将 还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气。结果溶液的pH值不断升高,溶液由酸性转变为碱性。
还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气。结果溶液的pH值不断升高,溶液由酸性转变为碱性。①在以上处理过程中,
 转化为毒性较低的Cr3+的离子方程式为:
转化为毒性较低的Cr3+的离子方程式为:②在阴极区有Fe(OH)3和Cr(OH)3沉淀生成(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)。已知电解后的溶液中c(Cr3+)为3×10-5 mol·L-1,则溶液中c(Fe3+)为
您最近一年使用:0次
【推荐1】氧化钪(Sc2O3)是一种稀土氧化物,可用于制作激光、半导体材料。以钪锰矿石(主要含MnO2、SiO2及少量Sc2O3、Al2O3、CaO、FeO)为原料制备Sc2O3的工艺流程如图,其中TBP和P507均为有机萃取剂。
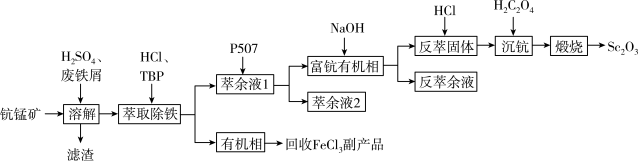
回答下列问题:
(1)Sc2O3中Sc的化合价为___ 。
(2)“溶解”时铁屑被MnO2氧化为Fe3+,该反应的离子方程式是___ 。
(3)“滤渣”的主要成分是___ 。
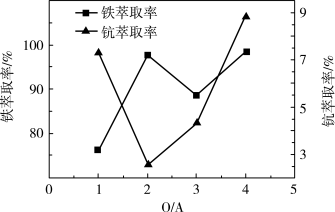
(4)“萃取除铁”时铁和钪的萃取率与O/A比(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A比为___ 。
(5)有机萃取剂P507萃取Sc3+的反应原理为阳离子交换:ScCl3+3HR=ScR3+3HCl(HR代表P507)。在“富钪有机相”中反应生成Sc(OH)3的化学方程式是___ 。
(6)“萃余液2”中的金属阳离子除Al3+、Ca2+外,还有___ 。
(7)Sc2(C2O4)3在空气中“煅烧”生成Sc2O3的化学方程式是___ 。
(8)某厂用1000kg的钪锰矿制备Sc2O3,最终得到Sc2O3306g,该矿中含钪的质量分数为___ 。

回答下列问题:
(1)Sc2O3中Sc的化合价为
(2)“溶解”时铁屑被MnO2氧化为Fe3+,该反应的离子方程式是
(3)“滤渣”的主要成分是
(4)“萃取除铁”时铁和钪的萃取率与O/A比(有机相与水相的体积比)的关系如图所示。该工艺中最佳O/A比为

(5)有机萃取剂P507萃取Sc3+的反应原理为阳离子交换:ScCl3+3HR=ScR3+3HCl(HR代表P507)。在“富钪有机相”中反应生成Sc(OH)3的化学方程式是
(6)“萃余液2”中的金属阳离子除Al3+、Ca2+外,还有
(7)Sc2(C2O4)3在空气中“煅烧”生成Sc2O3的化学方程式是
(8)某厂用1000kg的钪锰矿制备Sc2O3,最终得到Sc2O3306g,该矿中含钪的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】某NaCl样品中含有少量Na2CO3、Na2SO4和不溶于水的杂质,为了提纯NaCl,设计如下流程:

请据此回答下列问题:
(1)步骤①需要2次用到玻璃棒,其作用分别为_______ 、_______ ;
(2)步骤②中加入试剂I时反应的化学方程式为_______ 、_______ ;
(3)检验 沉淀完全的方法是取少量混合物A,
沉淀完全的方法是取少量混合物A,_______ ;步骤③的目的是_______ ;
(4)试剂III是_______ (填名称),加入它的目的是_______ ;
(5)步骤⑤需用玻璃棒不断搅拌,其目的是_______ 。

请据此回答下列问题:
(1)步骤①需要2次用到玻璃棒,其作用分别为
(2)步骤②中加入试剂I时反应的化学方程式为
(3)检验
 沉淀完全的方法是取少量混合物A,
沉淀完全的方法是取少量混合物A,(4)试剂III是
(5)步骤⑤需用玻璃棒不断搅拌,其目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
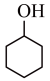
【推荐3】己二酸在有机合成工业、医药、润滑剂制造等方面都有重要作用,实验室常用环己醇来制备,其反应原理如下,KMnO4在该实验条件下被还原成MnO2。
 KOOC(CH2)4COOK
KOOC(CH2)4COOK HOOC(CH2)4COOH
HOOC(CH2)4COOH
实验步骤:
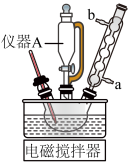
①按如图安装装置,在250 mL三颈烧瓶中加入50 mL 0.3 mol·L-1 KOH溶液和8.5 g高锰酸钾。打开电磁搅拌器,水浴升温至35 ℃使之溶解。控制滴速滴加环己醇2.l mL,维持反应温度在43 ℃~47 ℃,充分反应后趁热过滤,滤渣用少量热水洗涤。
②将滤液和洗涤液倒入100 mL烧杯中,加入适量饱和亚硫酸氢钠溶液,再用浓盐酸酸化至pH为2~4,小火加热蒸发滤液至10 mL左右,然后倒入冷水中,过滤析出的晶体,并用冷水洗涤2~3次,干燥、称重得产品2.1 g。
回答下列问题:
(1)仪器A名叫恒压滴液漏斗,与用分液漏斗相比,其优点是_______ ;冷凝管的出水口是 _______ (填“a”或“b”)。
(2)步骤①中趁热过滤所得滤渣的主要成分是_______ 。
(3)实验时,发现环己醇的黏性太强,恒压滴液漏斗中残留过多从而导致产率较低,可以向环己醇中加入_______ (“水”或“乙醇”)稀释从而降低黏性,不用另一种试剂稀释的原因是 _______ 。
(4)浓盐酸酸化的目的是调pH至2~4,若pH过高将会使产品的产率_______ (填“增大”“不变”或“减小”)。由环己醇制备己二酸的实验中,产品的产率为 _______ (写出计算过程,保留两位有效数字)。产品的产率= ×100%
×100%

 KOOC(CH2)4COOK
KOOC(CH2)4COOK HOOC(CH2)4COOH
HOOC(CH2)4COOH| 名称 | 相对分子质量 | 密度(g·Ml-1) | 溶解性 |
| 环己醇 | 100 | 0.96 | 溶于水,易溶于乙醇 |
| 己二酸 | 146 | 1.36 | 易溶于热水,易溶于乙醇 |
①按如图安装装置,在250 mL三颈烧瓶中加入50 mL 0.3 mol·L-1 KOH溶液和8.5 g高锰酸钾。打开电磁搅拌器,水浴升温至35 ℃使之溶解。控制滴速滴加环己醇2.l mL,维持反应温度在43 ℃~47 ℃,充分反应后趁热过滤,滤渣用少量热水洗涤。
②将滤液和洗涤液倒入100 mL烧杯中,加入适量饱和亚硫酸氢钠溶液,再用浓盐酸酸化至pH为2~4,小火加热蒸发滤液至10 mL左右,然后倒入冷水中,过滤析出的晶体,并用冷水洗涤2~3次,干燥、称重得产品2.1 g。

回答下列问题:
(1)仪器A名叫恒压滴液漏斗,与用分液漏斗相比,其优点是
(2)步骤①中趁热过滤所得滤渣的主要成分是
(3)实验时,发现环己醇的黏性太强,恒压滴液漏斗中残留过多从而导致产率较低,可以向环己醇中加入
(4)浓盐酸酸化的目的是调pH至2~4,若pH过高将会使产品的产率
 ×100%
×100%
您最近一年使用:0次



