(1)已知:氢化钠(NaH)为白色晶体,其中H-有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价,写出其化学反应方程式,并用双线桥标出电子转移的方向与数目______________________
(2)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用A粉还原NO3-,发生的反应可表示如下,请配平下列反应方程式:
____ 、____ 、____ 、____ 、____ 、___ 、
(3)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:
①该反应的氧化剂是____________ 氧化产物与还原产物的物质的量比是__________
②如果反应生成0.3mol的单质碘,则转移的电子数目是_____________
③先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,静置后观察到的现象是_________________________
(2)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用A粉还原NO3-,发生的反应可表示如下,请配平下列反应方程式:

(3)碘是人体不可缺乏的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是:

①该反应的氧化剂是
②如果反应生成0.3mol的单质碘,则转移的电子数目是
③先取少量的加碘盐加蒸馏水溶解,然后加入稀硫酸和KI溶液,最后加入一定量的CCl4,振荡,静置后观察到的现象是
更新时间:2019-11-20 22:26:44
|
相似题推荐
【推荐1】阅读下面科普信息,回答问题:
一个体重50kg的健康人含铁2g,这2g铁在人体中以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是_________
A.Fe B.Fe2+ C.Fe3+
(2)工业盐中毒后,可以服用维生素C来缓解中毒状况,这说明维生素C具有______ 性。
(3)在Fe+4HNO3(稀)═Fe(NO3)3+NO+H2O↑的反应中,用双线桥法表示电子的转移____________ ,反应中HNO3表现出了______ 性和______ 性,则1molFe参加反应时,被还原的HNO3为_________ mol,转移电子数为________ mol。
一个体重50kg的健康人含铁2g,这2g铁在人体中以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是
A.Fe B.Fe2+ C.Fe3+
(2)工业盐中毒后,可以服用维生素C来缓解中毒状况,这说明维生素C具有
(3)在Fe+4HNO3(稀)═Fe(NO3)3+NO+H2O↑的反应中,用双线桥法表示电子的转移
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】氧化还原反应在物质的制备和转化中有重要的应用。
(1)碘酸钾(KIO3)是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另一种化合物。
①写出该反应的化学方程式:_______ 。
②该反应中被氧化的I原子与被还原的I原子的个数之比为_______ 。
③每生成2个KIO3,该反应中转移电子_______ 个。
(2)一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”能快速溶于水,放出大量CO2,得到ClO2溶液。生成ClO2的化学方程式为5NaClO2+4NaHSO4=4ClO2+NaCl+4Na2SO4+2H2O。
①该反应的离子方程式为_______ 。
②该反应中氧化剂为_______ (填化学式,下同),还原剂为_______ 。
③用双线桥法表示该反应中电子转移的方向和数目:_______ 。
④产生CO2的离子方程式为_______ 。
(1)碘酸钾(KIO3)是一种重要的食品添加剂,可作为食盐中的补碘剂。一种制备KIO3的方法是将I2与KOH溶液共热,生成KIO3、H2O和另一种化合物。
①写出该反应的化学方程式:
②该反应中被氧化的I原子与被还原的I原子的个数之比为
③每生成2个KIO3,该反应中转移电子
(2)一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”能快速溶于水,放出大量CO2,得到ClO2溶液。生成ClO2的化学方程式为5NaClO2+4NaHSO4=4ClO2+NaCl+4Na2SO4+2H2O。
①该反应的离子方程式为
②该反应中氧化剂为
③用双线桥法表示该反应中电子转移的方向和数目:
④产生CO2的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】高铁酸钾( )是一种新型,高效,多功能绿色消毒剂.比
)是一种新型,高效,多功能绿色消毒剂.比 、
、 、
、 、
、 氧化性更强,无二次污染,主要用于饮用水的处理.工业上先制得高铁酸钠.然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.
氧化性更强,无二次污染,主要用于饮用水的处理.工业上先制得高铁酸钠.然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.
(1)湿法制备高铁酸钾( )的反应体系中有六种微粒:
)的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 .写出湿法制备高铁酸钾的离子反应方程式并用双线桥标出电子转移的方向和数目
.写出湿法制备高铁酸钾的离子反应方程式并用双线桥标出电子转移的方向和数目______________ 氧化性:NaClO____________  (填“大于”或“小于”).
(填“大于”或“小于”).
(2)干法制备高铁酸钠的主要反应为: .
.
①该反应中的氧化产物是__________ ,每生成1个 转移
转移__________ 个 .
.
②简要说明 作为水处理剂时所起的作用:
作为水处理剂时所起的作用:__________________________ .
 )是一种新型,高效,多功能绿色消毒剂.比
)是一种新型,高效,多功能绿色消毒剂.比 、
、 、
、 、
、 氧化性更强,无二次污染,主要用于饮用水的处理.工业上先制得高铁酸钠.然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.
氧化性更强,无二次污染,主要用于饮用水的处理.工业上先制得高铁酸钠.然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.(1)湿法制备高铁酸钾(
 )的反应体系中有六种微粒:
)的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 .写出湿法制备高铁酸钾的离子反应方程式并用双线桥标出电子转移的方向和数目
.写出湿法制备高铁酸钾的离子反应方程式并用双线桥标出电子转移的方向和数目 (填“大于”或“小于”).
(填“大于”或“小于”).(2)干法制备高铁酸钠的主要反应为:
 .
.①该反应中的氧化产物是
 转移
转移 .
.②简要说明
 作为水处理剂时所起的作用:
作为水处理剂时所起的作用:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】2020年11月20日,北京硒博会全国农业展览馆1号馆盛大开幕。硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中含量稀少且分布分散,故常从精炼铜的阳极泥中提取硒。
(1)粗铜精炼时,通常用精铜作___________ (填“阴”或“阳”)极,阳极溶解铜的质量___________ (填“>”“=”或“<”)阴极析出铜的质量。
(2)Se与S处于同一主族,比S原子多1个电子层,硒化氢的电子式为____ ,该族2~5周期元素的单质分别与 反应生成1mol气态氢化物的反应热如下,其中表示生成1mol硒化氢的反应热是
反应生成1mol气态氢化物的反应热如下,其中表示生成1mol硒化氢的反应热是____ (填字母)。
A. B.
B.
C.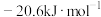 D.
D.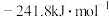
(3)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:i.将含硒的阳极泥与浓硫酸混合后隔绝空气焙烧,产生 、
、 的混合气体;ii.用水吸收i中产生的混合气体,可得Se固体。
的混合气体;ii.用水吸收i中产生的混合气体,可得Se固体。
①尾气中含有少量 ,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为
,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为____ 。
②写出步骤i中发生反应的化学方程式:___________ 。
(1)粗铜精炼时,通常用精铜作
(2)Se与S处于同一主族,比S原子多1个电子层,硒化氢的电子式为
 反应生成1mol气态氢化物的反应热如下,其中表示生成1mol硒化氢的反应热是
反应生成1mol气态氢化物的反应热如下,其中表示生成1mol硒化氢的反应热是A.
 B.
B.
C.
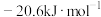 D.
D.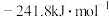
(3)阳极泥中的硒主要以Se和CuSe的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:i.将含硒的阳极泥与浓硫酸混合后隔绝空气焙烧,产生
 、
、 的混合气体;ii.用水吸收i中产生的混合气体,可得Se固体。
的混合气体;ii.用水吸收i中产生的混合气体,可得Se固体。①尾气中含有少量
 ,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为
,可用NaOH溶液吸收,二者反应生成一种盐,该盐的化学式为②写出步骤i中发生反应的化学方程式:
您最近一年使用:0次
【推荐2】一种用草酸泥渣(含PbC2O4和PbSO4)制备PbCrO4的工艺流程如图:
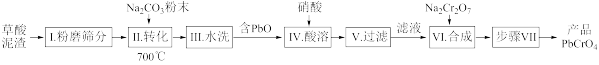
已知:①PbC2O4完全分解的化学方程式为PbC2O4 PbO+CO↑+CO2↑。②PbCrO4难溶于水。回答下列问题:
PbO+CO↑+CO2↑。②PbCrO4难溶于水。回答下列问题:
(1)泥渣“粉磨筛分”的目的是_______ ;实验室过滤操作需要的玻璃仪器有漏斗、烧杯和_____ 。
(2)用Na2CO3将难以热分解的硫酸铅转化为易分解的的碳酸铅。若在水溶液中进行,PbSO4(s)+ (aq)=PbCO3(s)+
(aq)=PbCO3(s)+ (aq),该反应的平衡常数K
(aq),该反应的平衡常数K______ 。[已知Ksp(PbCO3) =6.4×10-4,Ksp(PbSO4)=1.6×10-8]。
(3)铬酸钠在硫酸溶液中可转化为重铬酸钠,该反应的离子方程式为______ ,步骤V“合成”时发生反应的化学方程式为_________ 。
(4)铬酸铅是一种用于水彩和油彩的黄色颜料,遇到空气中的硫化氢颜色会变黑,该过程的化学方程式为________ 。

已知:①PbC2O4完全分解的化学方程式为PbC2O4
 PbO+CO↑+CO2↑。②PbCrO4难溶于水。回答下列问题:
PbO+CO↑+CO2↑。②PbCrO4难溶于水。回答下列问题:(1)泥渣“粉磨筛分”的目的是
(2)用Na2CO3将难以热分解的硫酸铅转化为易分解的的碳酸铅。若在水溶液中进行,PbSO4(s)+
 (aq)=PbCO3(s)+
(aq)=PbCO3(s)+ (aq),该反应的平衡常数K
(aq),该反应的平衡常数K(3)铬酸钠在硫酸溶液中可转化为重铬酸钠,该反应的离子方程式为
(4)铬酸铅是一种用于水彩和油彩的黄色颜料,遇到空气中的硫化氢颜色会变黑,该过程的化学方程式为
您最近一年使用:0次
【推荐1】铁的化合物应用非常广泛,刻制印刷电路板时要用FeCl3溶液为腐蚀液,其反应的化学方程式为:2FeCl3+Cu =2FeCl2+CuCl2
⑴该反应的氧化剂是_______________________ (填化学式)。
⑵请用双线桥法标出该反应电子的转移的方向和数目。2FeCl3+Cu =2FeCl2+CuCl2_____________________
⑶使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是_____________________________ (填序号)。
①氯气 ②铁 ③盐酸 ④稀硫酸
⑷某久置的FeCl2溶液略显黄色,某同学认为可能有部分Fe2+被氧化为Fe3+,因此配制FeCl2溶液时需加少量铁粉,请写出Fe3+转化为Fe2+的离子方程式____________________ 。
⑴该反应的氧化剂是
⑵请用双线桥法标出该反应电子的转移的方向和数目。2FeCl3+Cu =2FeCl2+CuCl2
⑶使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是
①氯气 ②铁 ③盐酸 ④稀硫酸
⑷某久置的FeCl2溶液略显黄色,某同学认为可能有部分Fe2+被氧化为Fe3+,因此配制FeCl2溶液时需加少量铁粉,请写出Fe3+转化为Fe2+的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.碘酸钾(KIO3)是一种白色或无色固体,可溶于水,具有较强的氧化性。常添加于食盐中用以防治碘缺乏病。已知在某反应体系中存在以下几个物质: KIO3、K2SO4、KI、I2、H2SO4、H2O。
(1)写出上述反应的化学方程式_________ 。
(2)下列说法中正确的是_____ 。
A.I2是非电解质 B.K2SO4溶液的导电能力比KI溶液的强
C.H2SO4溶液在该反应中体现了酸性 D.KIO3既有氧化性又有还原性
Ⅱ.二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用,实验室可用KClO3通过以下反应制得:2KClO3+H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2O,试回答下列问题。
(3)该反应中还原产物的化学式是_____ ;被氧化的元素是______ 。
(4)用单线桥标出上述反应的电子转移情况____ 2KClO3+H2C2O4+H2SO4 == 2ClO2↑+K2SO4+2CO2↑+2H2O
(5)ClO2和Cl2均能将电镀废水中的CN− 反应为无毒的物质,自身反应后均生成Cl−,此过程说明ClO2和Cl2均具有__ (填“氧化”或“还原”)性。处理含相同量CN−的电镀废水,所需Cl2的物质的量是ClO2的___ 倍。
(1)写出上述反应的化学方程式
(2)下列说法中正确的是
A.I2是非电解质 B.K2SO4溶液的导电能力比KI溶液的强
C.H2SO4溶液在该反应中体现了酸性 D.KIO3既有氧化性又有还原性
Ⅱ.二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用,实验室可用KClO3通过以下反应制得:2KClO3+H2C2O4+H2SO4===2ClO2↑+K2SO4+2CO2↑+2H2O,试回答下列问题。
(3)该反应中还原产物的化学式是
(4)用单线桥标出上述反应的电子转移情况
(5)ClO2和Cl2均能将电镀废水中的CN− 反应为无毒的物质,自身反应后均生成Cl−,此过程说明ClO2和Cl2均具有
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
(1)已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。该反应中氧化剂是_____ ;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______ (用NA表示)。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。维生素C的作用是_____ (氧化剂或还原剂)。
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A 焰色反应 B 分别滴加酸化的FeSO4溶液和KSCN溶液 C 分别滴加AgNO3溶液
| 药品 | NaNO2 (亚硝酸钠) |
| 性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。该反应中氧化剂是
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。维生素C的作用是
(3)下列方法中,可用来区分NaNO2和NaCl的是
A 焰色反应 B 分别滴加酸化的FeSO4溶液和KSCN溶液 C 分别滴加AgNO3溶液
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】化学是一门以实验为基础的科学。下列是中学化学中一些常见的实验装置,按要求回答下列问题:

(1)写出仪器名称:A___________ 、B___________ 、C___________ 。
(2)装置①中的错误是___________ 。
(3)粗盐提纯所需装置为___________ 和___________ 。
(4)除去自来水中的Cl−制取蒸馏水可选择的装置为___________ ,加热前应先加入几粒沸石,目的是___________ ;如何检验蒸馏得到的水中是否还存在氯离子___________ 。

(1)写出仪器名称:A
(2)装置①中的错误是
(3)粗盐提纯所需装置为
(4)除去自来水中的Cl−制取蒸馏水可选择的装置为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】选择下列实验方法分离物质,将分离方法的序号填在横线上.
A萃取分液 B升华 C结晶 D过滤 E蒸馏 F分液
(1)分离饱和食盐水与沙子的混合物___________
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾___________
(3)从碘水中提取碘单质___________
(4)分离氯化钠固体和碘单质的混合物___________
(5)分离水和汽油的混合物___________
(6)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物___________
A萃取分液 B升华 C结晶 D过滤 E蒸馏 F分液
(1)分离饱和食盐水与沙子的混合物
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾
(3)从碘水中提取碘单质
(4)分离氯化钠固体和碘单质的混合物
(5)分离水和汽油的混合物
(6)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物
您最近一年使用:0次

 溶液
溶液

