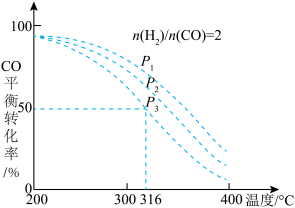
将H2和CO以 =2的方式充入1 L的恒容密闭容器中,一定条件下发生反应:4H2(g)+2CO(g)
=2的方式充入1 L的恒容密闭容器中,一定条件下发生反应:4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g),测得CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是
CH3OCH3(g)+H2O(g),测得CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是
 =2的方式充入1 L的恒容密闭容器中,一定条件下发生反应:4H2(g)+2CO(g)
=2的方式充入1 L的恒容密闭容器中,一定条件下发生反应:4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g),测得CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是
CH3OCH3(g)+H2O(g),测得CO的平衡转化率随温度、压强变化关系如图所示。下列说法正确的是
| A.该反应的△H<0 |
| B.压强大小:P1<P2<P3 |
| C.在316℃时,该反应的平衡常数为0.25 |
D.若在P3和316℃时,起始时 =3,则达到平衡时,CO转化率大于50% =3,则达到平衡时,CO转化率大于50% |
更新时间:2020-01-19 23:43:09
|
相似题推荐
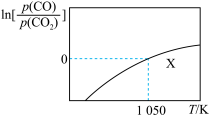
【推荐1】在一体积可变的密闭容器加入足量的Mn3C固体,并充入0.1 mol CO2,发生反应Mn3C(s)+CO2(g)⇌3Mn(s)+2CO(g)。已知:CO与CO2平衡分压比的自然对数值[ln ]与温度的关系如图所示(已知:平衡分压=总压×物质的量分数,Kp是用平衡分压代替浓度计算所得的平衡常数)。下列说法正确的是( )
]与温度的关系如图所示(已知:平衡分压=总压×物质的量分数,Kp是用平衡分压代替浓度计算所得的平衡常数)。下列说法正确的是( )
 ]与温度的关系如图所示(已知:平衡分压=总压×物质的量分数,Kp是用平衡分压代替浓度计算所得的平衡常数)。下列说法正确的是( )
]与温度的关系如图所示(已知:平衡分压=总压×物质的量分数,Kp是用平衡分压代替浓度计算所得的平衡常数)。下列说法正确的是( )
| A.该反应ΔH<0 |
| B.缩小容器体积有利于提高CO2的平衡转化率 |
| C.X点反应达到平衡时,则CO2的转化率为33.3% |
| D.假设1050 K时,X点反应达到平衡时容器的总压强为a kPa,则该温度下Kp为0.5a kPa |
您最近半年使用:0次
多选题
|
适中
(0.65)
【推荐2】一定温度下,在三个容积均为1 L的恒容密闭容器中按不同方式投入反应物,发生反应CO(g)+2H2(g) CH3OH(g)(正反应放热),测得反应的相关数据如下:
CH3OH(g)(正反应放热),测得反应的相关数据如下:
下列叙述正确的是( )
 CH3OH(g)(正反应放热),测得反应的相关数据如下:
CH3OH(g)(正反应放热),测得反应的相关数据如下:| 容器 | 容器1 | 容器2 | 容器3 |
| 反应温度T/K | 500 | 500 | 600 |
| 反应物投入量 | 1 mol CO、 2 mol H2 | 2 mol CH3OH | 1 mol CO、 2 mol H2 |
| 平衡v正(H2)/(mol·L-1·s-1) | v1 | v2 | v3 |
| 平衡c(CH3OH)/(mol·L-1) | c1 | c2 | c3 |
| 平衡体系总压强p/Pa | p1 | p2 | p3 |
| 物质的转化率α | α1(CO) | α2(CH3OH) | α3(CO) |
| 平衡常数K | K1 | K2 | K3 |
| A.v1<v2,2c1>c2 | B.α1(CO)>α3(CO),v1<v3 |
| C.p2>2p3,K1<K3 | D.c2>2c3,α2(CH3OH)+α3(CO)<1 |
您最近半年使用:0次
多选题
|
适中
(0.65)
名校
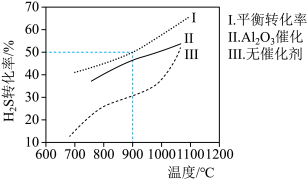
【推荐3】在两个容积均为2L恒温密闭容器中,起始时均充入amolH2S,控制不同温度和分别在有、无Al2O3催化时进行H2S的分解实验[反应为:2H2S(g) 2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
下列说法不正确 的是
 2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
2H2(g)+S2(g)]。测得的结果如下图所示(曲线Ⅱ、Ⅲ表示经过相同时间且未达到化学平衡时H2S的转化率)。
下列说法
| A.H2S分解为放热反应 |
| B.加入Al2O3可提高H2S的平衡转化率 |
C.900℃反应2H2S(g) 2H2(g)+S2(g)的平衡常数K=0.125a 2H2(g)+S2(g)的平衡常数K=0.125a |
| D.约1100℃曲线Ⅱ、Ⅲ几乎重合,说明Al2O3可能几乎失去催化活性 |
您最近半年使用:0次
多选题
|
适中
(0.65)
【推荐1】一定温度下,在3个容积均为 的恒容密闭容器中反应
的恒容密闭容器中反应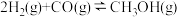 达到平衡,下列说法正确的是
达到平衡,下列说法正确的是
 的恒容密闭容器中反应
的恒容密闭容器中反应 达到平衡,下列说法正确的是
达到平衡,下列说法正确的是| 容器 | 温度/K | 物质的起始浓度/ | 物质的平衡浓度/ | ||
 |  |  | |||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A.该反应的正反应吸热 |
B.达到平衡时,容器Ⅱ中 小于容器Ⅲ中 小于容器Ⅲ中 的两倍 的两倍 |
| C.达到平衡时,容器Ⅲ中的正反应速率比容器I中的大 |
| D.达到平衡时,容器I中反应物的转化率比容器Ⅱ中的大 |
您最近半年使用:0次
多选题
|
适中
(0.65)
名校
解题方法
【推荐2】某温度下,在2L的恒容密闭容器中充入气体A和气体B发生反应生成气体C,反应过程中各组分的物质的量随反应时间的变化如图所示。下列说法正确的是
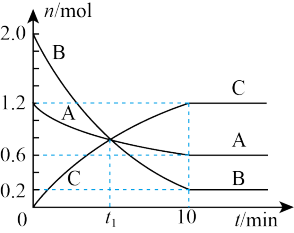

| A.t1时刻反应达到平衡状态 |
| B.该温度下,反应的平衡常数为300 |
C.该反应的化学方程式可表示为:A+3B 2C 2C |
| D.0~10min内平均速率v(B)=0.09mol·L-1·min-1 |
您最近半年使用:0次
多选题
|
适中
(0.65)
【推荐3】在三个容积均为2 L的密闭容器中按不同方式投入反应物,发生反应:
CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0)
CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0)
相关反应数据如下:
下列说法正确的是( )
CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0)
CO2(g)+H2(g) ΔH=-a kJ·mol-1(a>0)相关反应数据如下:
| 容器 | 容器类型 | 起始温度/ | 起始物质的量/mol | 平衡时H2物质的量/mol | |||
| CO | H2O | CO2 | H2 | ||||
| Ⅰ | 恒温恒容 | 800 | 1.2 | 0.6 | 0 | 0 | 0.4 |
| Ⅱ | 恒温恒容 | 900 | 0.7 | 0.1 | 0.5 | 0.5 | |
| Ⅲ | 绝热恒容 | 800 | 0 | 0 | 1.2 | 0.8 | |
下列说法正确的是( )
| A.容器Ⅰ中反应经10 min建立平衡,0~10 min内,平均反应速率v(CO)=0.04 mol·L-1·min-1 |
| B.若向容器Ⅰ平衡体系中再加入CO、H2O、CO2、H2各0.1 mol,平衡将正向移动 |
| C.达到平衡时,容器Ⅱ中反应吸收的热量小于0.1a kJ |
| D.达平衡时,容器Ⅲ中n(CO)<0.48 mol |
您最近半年使用:0次



