锑酸钠(NaSbO3)具有广泛的应用,可用作显像管、光学玻璃和各种高级玻璃的澄清剂,纺织品、塑料制品的阻燃剂,搪瓷乳白剂,制造铸件用漆的不透明填料及铁皮、钢板抗酸漆的成分。工业上用双氧水氧化法制备NaSbO3∙3H2O的工艺流程如下:
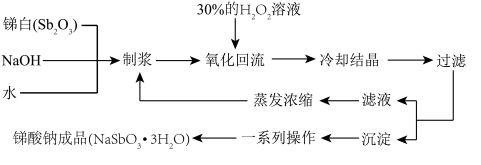
回答下列问题:
⑴NaSbO3∙3H2O中Sb的化合价为________ 。
⑵先将锑白、氢氧化钠和水按一定的比例制浆,制浆过程中,搅拌、加热的目的是________ 。
⑶将制得的浆液加热至适当温度后,慢慢滴入30%的H2O2溶液进行氧化回流,温度不宜过高的原因是________ 。此过程中涉及反应如下,配平此化学方程式:
____ Sb2O3 + ____ H2O2 + ____ NaOH + ____ H2O = ____ NaSbO3∙3H2O。
⑷此流程中,可以循环利用的主要物质有________ 。
⑸“沉淀”主要成分为锑酸钠,流程中“一系列操作”主要包括________ ,产品在90~100℃下烘干,温度不宜太高的原因是________________________________ 。

回答下列问题:
⑴NaSbO3∙3H2O中Sb的化合价为
⑵先将锑白、氢氧化钠和水按一定的比例制浆,制浆过程中,搅拌、加热的目的是
⑶将制得的浆液加热至适当温度后,慢慢滴入30%的H2O2溶液进行氧化回流,温度不宜过高的原因是
⑷此流程中,可以循环利用的主要物质有
⑸“沉淀”主要成分为锑酸钠,流程中“一系列操作”主要包括
更新时间:2020-02-04 14:01:34
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】亚氯酸钠(NaClO2)是一种高效氧化剂和漂白剂。一种制备NaClO2粗产品的流程如下:
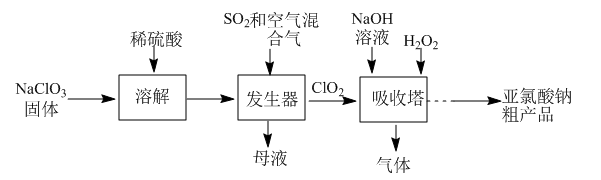
已知:纯ClO2易分解爆炸;NaClO2在碱性溶液中稳定存在,在酸性溶液中分解为NaClO3和NaCl。
回答下列问题:
(1)发生器中鼓入空气的作用是___________
(2)从母液中可回收的主要物质是___________
(3)吸收塔内反应的离子方程式为___________
(4)写出NaClO2在酸性溶液中分解的离子方程式___________
(5)漂白粉也是一种高效氧化剂和漂白剂,在空气中易失效,试用化学方程式解释其原因:___________ ;

已知:纯ClO2易分解爆炸;NaClO2在碱性溶液中稳定存在,在酸性溶液中分解为NaClO3和NaCl。
回答下列问题:
(1)发生器中鼓入空气的作用是
(2)从母液中可回收的主要物质是
(3)吸收塔内反应的离子方程式为
(4)写出NaClO2在酸性溶液中分解的离子方程式
(5)漂白粉也是一种高效氧化剂和漂白剂,在空气中易失效,试用化学方程式解释其原因:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】高铁酸钾(K2FeO4)是一种安全性很高的水处理剂,其合成的部分流程如下。

资料:
ⅰ.高铁酸钾可溶于水,微溶于浓KOH溶液,在碱性溶液中较稳定,在酸性或中性溶液中快速产生O2,且﹢3价铁能催化该反应。
ⅱ.次氯酸钾容易分解,2KClO 2KCl+O2。
2KCl+O2。
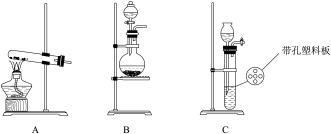
(1)实验室使用高锰酸钾与浓盐酸制备氯气时,应选择下列装置中的_______ 。
(2)写出步骤①的离子反应方程式_________________________________ 。
(3)加入KOH固体是为了过滤除盐,过滤除去的是__________________________________ 。
(4)相同投料比、相同反应时间内,反应温度对高铁酸钾产率的影响如图1所示:
请分析高铁酸钾产率随温度变化的原因:________________ 。

(5)相同投料比、相同反应时间内,硝酸铁浓度对产率的影响如图2所示:
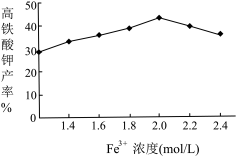
当Fe3+浓度大于2.0mol/L时,高铁酸钾产率变化的原因可能是:_________________________________________ 。
(6)高铁酸钾可用于除去水体中Mn(+2价),生成Mn(+4价)和Fe(+3价)。一定条件下,除去水体中1.1gMn(+2价),当去除率为90%时,消耗高铁酸钾的物质的量为______ mol。

资料:
ⅰ.高铁酸钾可溶于水,微溶于浓KOH溶液,在碱性溶液中较稳定,在酸性或中性溶液中快速产生O2,且﹢3价铁能催化该反应。
ⅱ.次氯酸钾容易分解,2KClO
 2KCl+O2。
2KCl+O2。(1)实验室使用高锰酸钾与浓盐酸制备氯气时,应选择下列装置中的

(2)写出步骤①的离子反应方程式
(3)加入KOH固体是为了过滤除盐,过滤除去的是
(4)相同投料比、相同反应时间内,反应温度对高铁酸钾产率的影响如图1所示:
请分析高铁酸钾产率随温度变化的原因:

(5)相同投料比、相同反应时间内,硝酸铁浓度对产率的影响如图2所示:

当Fe3+浓度大于2.0mol/L时,高铁酸钾产率变化的原因可能是:
(6)高铁酸钾可用于除去水体中Mn(+2价),生成Mn(+4价)和Fe(+3价)。一定条件下,除去水体中1.1gMn(+2价),当去除率为90%时,消耗高铁酸钾的物质的量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Fe及其他不溶于酸、碱的杂质。现用含镍废催化剂制备NiSO4·7H2O,其流程图如下:
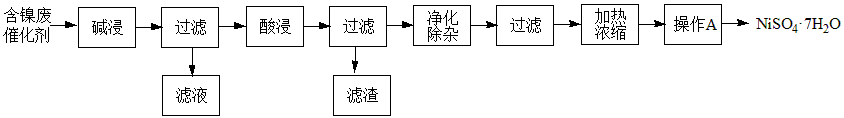
部分金属化合物的Ksp近似值如表所示:
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为___________ 。
(2)析出NiSO4·7H2O后失去结晶水后得到NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为___________ 。

部分金属化合物的Ksp近似值如表所示:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | NiCO3 |
| Ksp近似值 | 1.0×10-17 | 1.0×10-38 | 1.0×10-34 | 1.0×10-15 | 1.0×10-5 |
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为
(2)析出NiSO4·7H2O后失去结晶水后得到NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】为了将混有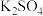 、
、 的
的 固体提纯,并制得纯净的
固体提纯,并制得纯净的 溶液,某同学设计如图所示实验方案:
溶液,某同学设计如图所示实验方案:
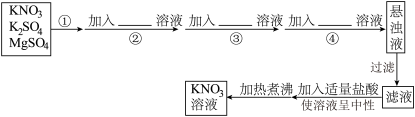
(1)操作①为__________ 。
(2)操作②~④加入试剂的顺序可以为__________ 。
(3)如果判断 已除尽,简述实验操作
已除尽,简述实验操作__________ 。
(4)实验过程中产生的多次沉淀__________ (填“需要”或“不需要”)多次过滤。
(5)该同学设计的实验方案不严密,理由是__________ 。
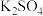 、
、 的
的 固体提纯,并制得纯净的
固体提纯,并制得纯净的 溶液,某同学设计如图所示实验方案:
溶液,某同学设计如图所示实验方案:
(1)操作①为
(2)操作②~④加入试剂的顺序可以为
(3)如果判断
 已除尽,简述实验操作
已除尽,简述实验操作(4)实验过程中产生的多次沉淀
(5)该同学设计的实验方案不严密,理由是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】2019年6月5日美国商务部表示,美方将采取“空前行动”,确保对科技业和军方极其关键的战略性矿物及稀土供应无虞。我国稀土出口量世界第一。以氟碳铈矿(主要含CeFCO3,少量其他稀土盐LnFCO3、非稀土元素Fe、Al、Mg和SiO2等)为原料制备CeO2的一种工艺流程如图所示:

(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_________________________________ 。“氧化焙烧”时,CeFCO3和其他稀土盐LnFCO3分别转化为CeO2和Ln2O3,请写出生成的CeO2化学方程式为:________________________ 。
(2)“氯化”过程的目的是将CeO2和Ln2O3分别转化为可溶性的CeCl3和LnCl3,除去Fe2O3、Al2O3、MgO、SiO2等杂质。若溶液中c(Ce3+)=0.01mol/L,为确保不析出Ce(OH)3沉淀,则溶液的pH________ (填pH的范围)。(已知Ksp[Ce(OH)3=1.0×10-20])
(3)CeO2和Ln2O3混合物中加入稀盐酸,Ln2O3溶解生成LnOCl的化学方程式为:___________________________________________________ 。
(4)化工生产条件的选择:
①“氯化”条件的选择
将氧化焙烧后氟碳铈矿和氯化铵按1:3、1:4、1:5、1:6、1:7质量比混合,在325℃下真空焙烧60min。稀土矿氧化物转化成稀土氯化物的氯化率如图所示:

氧化焙烧后氟碳铈矿和氯化铵的最佳质量比为________ 。
②“氧化”条件的选择
氧化过程中,反应温度、反应时间对混合稀土氯化物氧化率的关系如图所示:
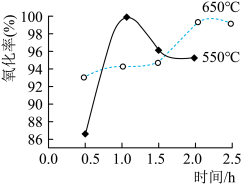
最佳温度和时间是_________ ,原因是_________________________________________ 。
(5)取上述流程中得到的CeO2产品0.4500g,加硫酸溶解后,用0.1000mol•L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不反应),消耗25.00mL标准溶液.该产品中CeO2的质量分数为___________ 。

(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是
(2)“氯化”过程的目的是将CeO2和Ln2O3分别转化为可溶性的CeCl3和LnCl3,除去Fe2O3、Al2O3、MgO、SiO2等杂质。若溶液中c(Ce3+)=0.01mol/L,为确保不析出Ce(OH)3沉淀,则溶液的pH
(3)CeO2和Ln2O3混合物中加入稀盐酸,Ln2O3溶解生成LnOCl的化学方程式为:
(4)化工生产条件的选择:
①“氯化”条件的选择
将氧化焙烧后氟碳铈矿和氯化铵按1:3、1:4、1:5、1:6、1:7质量比混合,在325℃下真空焙烧60min。稀土矿氧化物转化成稀土氯化物的氯化率如图所示:

氧化焙烧后氟碳铈矿和氯化铵的最佳质量比为
②“氧化”条件的选择
氧化过程中,反应温度、反应时间对混合稀土氯化物氧化率的关系如图所示:

最佳温度和时间是
(5)取上述流程中得到的CeO2产品0.4500g,加硫酸溶解后,用0.1000mol•L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不反应),消耗25.00mL标准溶液.该产品中CeO2的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】高锰酸钾是强氧化剂,用途十分广泛。
I.某化学兴趣小组拟以绿色的锰酸钾(K2MnO4)碱性溶液为主要原料在实验室制备KMnO4实验装置(固定和加热装置已省略)如下:
(1)仪器b的名称是_______ ,使用a的优点是_______ ,单向阀(只允许气体从左流向右)可以起到的作用是_______ 。
(2)如图安装好装置后,应先进行的操作是_______ 。
(3)装置B中生成KMnO4的离子方程式为_______ 。
Ⅱ.利用KMnO4标准溶液测定某FeC2O4晶体样品的纯度[样品中含有草酸铵(NH4)2C2O4杂质]。
步骤1:称取m g FeC2O4晶体样品并溶于稀H2SO4中,配成250mL溶液:
步骤2:取上述溶液25.00mL,用cmol/LKMnO4标准溶液滴定至终点:
步骤3:向反应后溶液中加入过量铜粉,充分反应后,过滤、洗涤,将滤液和洗涤液全部收集到锥形瓶中,加入适量稀H2SO4,再用c mol/L KMnO4标准溶液滴定至终点,消耗KMnO4溶液VmL。
(4)步骤2中KMnO4溶液除与Fe2+发生反应外,还与H2C2O4发生氧化还原反应,写出其与H2C2O4反应的离子方程式_______ 。
(5)m g FeC2O4晶体样品的纯度为_______ (用含c、V的式子表示,不必化简),若步骤1配制溶液时在空气中放置时间过长,则测定结果将_______ (填 “偏高”、 “偏低“或“无影响”)。
I.某化学兴趣小组拟以绿色的锰酸钾(K2MnO4)碱性溶液为主要原料在实验室制备KMnO4实验装置(固定和加热装置已省略)如下:
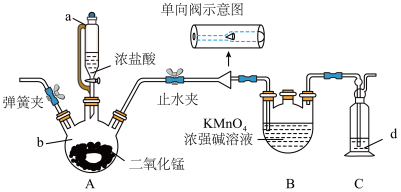
(1)仪器b的名称是
(2)如图安装好装置后,应先进行的操作是
(3)装置B中生成KMnO4的离子方程式为
Ⅱ.利用KMnO4标准溶液测定某FeC2O4晶体样品的纯度[样品中含有草酸铵(NH4)2C2O4杂质]。
步骤1:称取m g FeC2O4晶体样品并溶于稀H2SO4中,配成250mL溶液:
步骤2:取上述溶液25.00mL,用cmol/LKMnO4标准溶液滴定至终点:
步骤3:向反应后溶液中加入过量铜粉,充分反应后,过滤、洗涤,将滤液和洗涤液全部收集到锥形瓶中,加入适量稀H2SO4,再用c mol/L KMnO4标准溶液滴定至终点,消耗KMnO4溶液VmL。
(4)步骤2中KMnO4溶液除与Fe2+发生反应外,还与H2C2O4发生氧化还原反应,写出其与H2C2O4反应的离子方程式
(5)m g FeC2O4晶体样品的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Fe及其他不溶于酸、碱的杂质。现用含镍废催化剂制备NiSO4·7H2O,其流程图如下:

部分金属化合物的Ksp近似值如表所示:
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为___________ 。
(2)析出NiSO4·7H2O后失去结晶水后得到NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为___________ 。

部分金属化合物的Ksp近似值如表所示:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | NiCO3 |
| Ksp近似值 | 1.0×10-17 | 1.0×10-38 | 1.0×10-34 | 1.0×10-15 | 1.0×10-5 |
回答下列问题:
(1)“碱浸”时发生反应的离子方程式为
(2)析出NiSO4·7H2O后失去结晶水后得到NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH。该反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】锑(Sb)及其化合物在工业上有许多用途。以辉锑矿(主要成分为 ,还含有PbS、
,还含有PbS、 、CuO、
、CuO、 等)为原料制备金属锑的工艺流程如图所示:
等)为原料制备金属锑的工艺流程如图所示: 之外,还含有
之外,还含有 、
、 、
、 、
、 等;
等;
②常温下: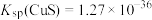 ,
,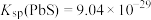 ;
;
③溶液中离子浓度小于或等于 mol/L时,认为该离子沉淀完全。
mol/L时,认为该离子沉淀完全。
(1)滤渣1中除了S之外,还有_______ (填化学式)。
(2)“浸出”时, 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)该生产流程能实现循环利用的物质是_______ (填化学式)。
(4)常温下,“除铜、铅”时, 和
和 均沉淀完全,此时溶液中的
均沉淀完全,此时溶液中的 不低于
不低于_______ 。所加 也不宜过多,其原因为
也不宜过多,其原因为_______ 。
(5)“除砷”时有 生成,该反应的离子方程式为
生成,该反应的离子方程式为_______ 。
 ,还含有PbS、
,还含有PbS、 、CuO、
、CuO、 等)为原料制备金属锑的工艺流程如图所示:
等)为原料制备金属锑的工艺流程如图所示:
 之外,还含有
之外,还含有 、
、 、
、 、
、 等;
等;②常温下:
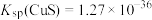 ,
,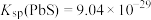 ;
;③溶液中离子浓度小于或等于
 mol/L时,认为该离子沉淀完全。
mol/L时,认为该离子沉淀完全。(1)滤渣1中除了S之外,还有
(2)“浸出”时,
 发生反应的化学方程式为
发生反应的化学方程式为(3)该生产流程能实现循环利用的物质是
(4)常温下,“除铜、铅”时,
 和
和 均沉淀完全,此时溶液中的
均沉淀完全,此时溶液中的 不低于
不低于 也不宜过多,其原因为
也不宜过多,其原因为(5)“除砷”时有
 生成,该反应的离子方程式为
生成,该反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】磷酸铁锂电池是以磷酸铁锂(LiFePO4)为正极材料的一种锂离子二次电池。一种由钛白副产硫酸亚铁[主要成分为FeSO4,还含有少量Fe2(SO4)3、TiOSO4、MgSO4]制备锂离子电池正极材料的前驱体FePO4的工艺流程如图所示:
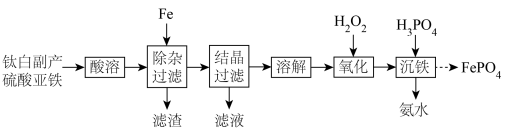
已知常温下:①“酸溶”后,溶液pH=2.3,有关微粒浓度如下表所示:
②TiO2++2H2O H2TiO3+2H+,pH=4时,H2TiO3沉淀完全。
H2TiO3+2H+,pH=4时,H2TiO3沉淀完全。
③Ksp[Mg(OH)2]=1.8×10-11。
(1)LiFePO4中,Li+的轨道表示式是___________ ,该化合物中Fe2+的基态离子的电子排布式为___________ 。
A.[Ar]3d6 B.[Ar]3d64s2 C.[Ar]3d5
(2)“除杂过滤”工序中,将TiO2+转化为H2TiO3除去。加入铁粉的作用是___________ 。
(3)当H2TiO3沉淀完全时,滤渣中是否含有Mg(OH)2 ?结合计算说明原因___________ 。(忽略溶液体积的变化)
(4)“结晶过滤”获得FeSO4·7H2O的操作为___________ 。
A.蒸发结晶、趁热过滤 B.蒸发浓缩、冷却结晶、过滤
(5)书写“氧化”时发生反应的离子方程式,并标出电子转移的方向和数目。___________
(6)工业上可以用电解磷铁渣(主要含FeP)的方法制备FePO4,电解原理如图所示:
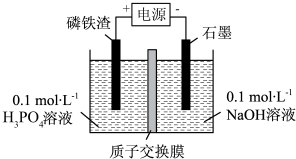
①溶液中的H+向___________ 极移动。
A.磷铁渣 B.石墨
②生成FePO4的电极反应式为___________ 。

已知常温下:①“酸溶”后,溶液pH=2.3,有关微粒浓度如下表所示:
| 微粒 | TiO2+ | Mg2+ |
| 浓度/mol·L-1 | 0.0043 | 0.07 |
 H2TiO3+2H+,pH=4时,H2TiO3沉淀完全。
H2TiO3+2H+,pH=4时,H2TiO3沉淀完全。③Ksp[Mg(OH)2]=1.8×10-11。
(1)LiFePO4中,Li+的轨道表示式是
A.[Ar]3d6 B.[Ar]3d64s2 C.[Ar]3d5
(2)“除杂过滤”工序中,将TiO2+转化为H2TiO3除去。加入铁粉的作用是
(3)当H2TiO3沉淀完全时,滤渣中是否含有Mg(OH)2 ?结合计算说明原因
(4)“结晶过滤”获得FeSO4·7H2O的操作为
A.蒸发结晶、趁热过滤 B.蒸发浓缩、冷却结晶、过滤
(5)书写“氧化”时发生反应的离子方程式,并标出电子转移的方向和数目。
(6)工业上可以用电解磷铁渣(主要含FeP)的方法制备FePO4,电解原理如图所示:

①溶液中的H+向
A.磷铁渣 B.石墨
②生成FePO4的电极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某化学课外兴趣小组根据学习的相关知识,设计了氯气的制取、净化和收集实验,其装置如下图所示,请根据题意回答下列问题:

(1)F 中盛装试剂的名称是:____________ ,圆底烧瓶中发生反应的化学方程式为:________________ 。
(2)从A装置中产生的氯气主要含有氯化氢杂质,因此选用装置B进行除杂,B中应该盛装的试剂名称为:______________ ,C 装置中盛装的是浓硫酸,其作用是:_______________ 。
(3) E 装置中盛装的是烧碱溶液,其作用是:________________ ,发生反应的离子方程式为:____________________ 。

(1)F 中盛装试剂的名称是:
(2)从A装置中产生的氯气主要含有氯化氢杂质,因此选用装置B进行除杂,B中应该盛装的试剂名称为:
(3) E 装置中盛装的是烧碱溶液,其作用是:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】硫化钠又称硫化碱,为无色、易溶于水和热乙醇的固体,常用于制造硫代硫酸钠、多硫化钠、硫化染料等。实验室中用工业硫化钠(因含重金属硫化物和煤粉等而呈褐色)、纯碱等物质制备硫代硫酸钠晶体(Na2S2O3·5H2O)的原理如下:Na2CO3+SO2=Na2SO3+CO2 S+ Na2SO3 Na2S2O3。回答下列问题:
Na2S2O3。回答下列问题:
(1)工业硫化钠的纯化
将18g工业硫化钠加入烧瓶中,再加入150 mL 95%的乙醇溶液和8 mL水。用如图所示装置进行沸水浴加热,并回流40 min,趁热过滤,冷却、搅拌、结晶、倾析,除去上层母液;最后用95%的乙醇溶液洗涤,烘干,得到Na2S·9H2O晶体。图中仪器a的名称是_______ ,该过程中回流40 min的目的是_______________________________ 。
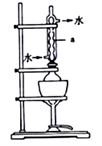
(2)硫代硫酸钠的制备
称取纯化后的Na2S·9H2O晶体14.4 g和mg Na2CO3,混合后置于锥形瓶中,加入150 mL蒸馏水,微热后按图所示组装仪器;然后,打开分液漏斗的活塞和螺旋夹6,并适当调节该螺旋夹,向锥形瓶中通入SO2气体,当溶液呈中性时,停止通入SO2气体,对反应后溶液进行后续处理,即可制得硫代硫酸钠(Na2S2O3·5H2O)。

①适当调节螺旋夹6的目的是_______________________________________ ;
②实验过程中,通入SO2一段时间后,溶液中会生成大量淡黄色沉淀,然后又变澄清。生成淡黄色沉淀的化学方程式为____________________________________ 。若通入SO2气体时间过长,会降低硫代硫酸钠的产率,原因是_______________________ 。
③为提高产品纯度,节约原料,m=____ g;
④反应结束后,需对溶液进行后续处理,得到硫代硫酸钠晶体(Na2S2O3·5H2O),其操作是蒸发浓缩,冷却结晶、过滤、_____ 、烘干。称量所得产品,质量为ng,则Na2S2O3·5H2O的产率为_____________ %。
 Na2S2O3。回答下列问题:
Na2S2O3。回答下列问题:(1)工业硫化钠的纯化
将18g工业硫化钠加入烧瓶中,再加入150 mL 95%的乙醇溶液和8 mL水。用如图所示装置进行沸水浴加热,并回流40 min,趁热过滤,冷却、搅拌、结晶、倾析,除去上层母液;最后用95%的乙醇溶液洗涤,烘干,得到Na2S·9H2O晶体。图中仪器a的名称是

(2)硫代硫酸钠的制备
称取纯化后的Na2S·9H2O晶体14.4 g和mg Na2CO3,混合后置于锥形瓶中,加入150 mL蒸馏水,微热后按图所示组装仪器;然后,打开分液漏斗的活塞和螺旋夹6,并适当调节该螺旋夹,向锥形瓶中通入SO2气体,当溶液呈中性时,停止通入SO2气体,对反应后溶液进行后续处理,即可制得硫代硫酸钠(Na2S2O3·5H2O)。

①适当调节螺旋夹6的目的是
②实验过程中,通入SO2一段时间后,溶液中会生成大量淡黄色沉淀,然后又变澄清。生成淡黄色沉淀的化学方程式为
③为提高产品纯度,节约原料,m=
④反应结束后,需对溶液进行后续处理,得到硫代硫酸钠晶体(Na2S2O3·5H2O),其操作是蒸发浓缩,冷却结晶、过滤、
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(
,得到亚硫酸钠( )粗品。其流程如下。
)粗品。其流程如下。
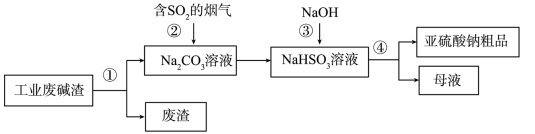
(1)为加快工业废碱渣中 的溶解,可采取的措施是
的溶解,可采取的措施是___________ (写出一种即可)。
(2)过程①进行的操作是___________ ,若在实验室进行该实验,使用的玻璃仪器除了烧杯和玻璃棒外,还需要___________ 。
(3)上述流程中,加入NaOH后,发生反应的化学方程式为___________ 。
(4)亚硫酸钠粗品中含有少量 ,原因是
,原因是___________ (用化学方程式表示)。
(5)设计实验证明亚硫酸钠粗品含有少量 的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,___________ ,出现白色沉淀,则证明含有 。
。
(6) 具有强还原性,可用于处理酸性废水中的
具有强还原性,可用于处理酸性废水中的 (转化为
(转化为 ),写出该反应的离子方程式:
),写出该反应的离子方程式:___________ 。
 )吸收烟气中的
)吸收烟气中的 ,得到亚硫酸钠(
,得到亚硫酸钠( )粗品。其流程如下。
)粗品。其流程如下。
(1)为加快工业废碱渣中
 的溶解,可采取的措施是
的溶解,可采取的措施是(2)过程①进行的操作是
(3)上述流程中,加入NaOH后,发生反应的化学方程式为
(4)亚硫酸钠粗品中含有少量
 ,原因是
,原因是(5)设计实验证明亚硫酸钠粗品含有少量
 的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,
的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解, 。
。(6)
 具有强还原性,可用于处理酸性废水中的
具有强还原性,可用于处理酸性废水中的 (转化为
(转化为 ),写出该反应的离子方程式:
),写出该反应的离子方程式:
您最近一年使用:0次



