某复合肥的主要成分有KCl、NH4H2PO4和CO(NH2)2等。测定该复合肥中氮的质量分数的实验步骤如下:
步骤1:准确称取0.5000 g样品于锥形瓶中,加入足量浓硫酸并加热,不再有CO2溢出时,冷却至室温。
步骤2:向锥形瓶中加入100mL蒸馏水,再加入适量的CaCl2溶液,并用NaOH溶液调节溶液近中性,过滤,洗涤,得0.1550 gCa3(PO4)2沉淀和滤液A。
步骤3:向滤液A中加入过量的甲醛溶液,加指示剂,用0. 5000 mol/LNaOH标准溶液滴定至终点,消耗NaOH溶液22.00 mL。 [已知:4 NH4++6HCHO=4H++(CH2)6N4+6H2O]
(1)步骤1中,CO(NH2)2与硫酸反应的化学方程式为____________________ 。
(2)欲使滤液A中c(PO43—)≤4.0×10-6mol/L,应保持溶液中c(Ca2+)≥______________ mol/L[已知KSP[Ca3(PO4)2]=2.0×10-33]。
(3)复合肥样品中N的质量分数为___________ 。
(4)计算复合肥样品中NH4H2PO4和CO(NH2)2的物质的量之比_____________ (写出计算过程)。
步骤1:准确称取0.5000 g样品于锥形瓶中,加入足量浓硫酸并加热,不再有CO2溢出时,冷却至室温。
步骤2:向锥形瓶中加入100mL蒸馏水,再加入适量的CaCl2溶液,并用NaOH溶液调节溶液近中性,过滤,洗涤,得0.1550 gCa3(PO4)2沉淀和滤液A。
步骤3:向滤液A中加入过量的甲醛溶液,加指示剂,用0. 5000 mol/LNaOH标准溶液滴定至终点,消耗NaOH溶液22.00 mL。 [已知:4 NH4++6HCHO=4H++(CH2)6N4+6H2O]
(1)步骤1中,CO(NH2)2与硫酸反应的化学方程式为
(2)欲使滤液A中c(PO43—)≤4.0×10-6mol/L,应保持溶液中c(Ca2+)≥
(3)复合肥样品中N的质量分数为
(4)计算复合肥样品中NH4H2PO4和CO(NH2)2的物质的量之比
更新时间:2020-02-15 21:40:14
|
相似题推荐
计算题
|
较难
(0.4)
解题方法
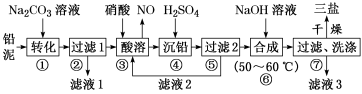
【推荐1】硫代硫酸钠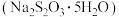 的俗名是大苏打,在化学实验中有广泛应用。
的俗名是大苏打,在化学实验中有广泛应用。
(1)实验室可通过向含 和
和 的溶液中通入
的溶液中通入 来制备
来制备 (其简单流程如图所示)。
(其简单流程如图所示)。

①写出制备 的化学方程式:
的化学方程式:________________ 。
②“一系列操作”包括________ 、________ 、过滤、洗涤、干燥。(填操作名称)
(2)工业上,常用 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 。写出发生反应的离子方程式:
。写出发生反应的离子方程式:_______ 。
(3)临床上, 可用于氰化物解毒,解毒原理:
可用于氰化物解毒,解毒原理: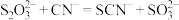 。检验该转化生成了
。检验该转化生成了 的操作为
的操作为________________ 。
(4)工业上,测定 样品纯度的方法:取
样品纯度的方法:取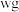 样品溶于稀硫酸,加入足量
样品溶于稀硫酸,加入足量 溶液,再加入
溶液,再加入 的
的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 。
。
相关反应: ;
;
 。
。
①该样品中 的质量分数为
的质量分数为________ (假设杂质不参与反应)。
②如果稀硫酸过多,测得结果会________ (填“偏高”、“偏低”或“无影响”)。
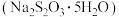 的俗名是大苏打,在化学实验中有广泛应用。
的俗名是大苏打,在化学实验中有广泛应用。(1)实验室可通过向含
 和
和 的溶液中通入
的溶液中通入 来制备
来制备 (其简单流程如图所示)。
(其简单流程如图所示)。
①写出制备
 的化学方程式:
的化学方程式:②“一系列操作”包括
(2)工业上,常用
 溶液吸收尾气中的
溶液吸收尾气中的 ,氧化产物为
,氧化产物为 。写出发生反应的离子方程式:
。写出发生反应的离子方程式:(3)临床上,
 可用于氰化物解毒,解毒原理:
可用于氰化物解毒,解毒原理: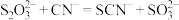 。检验该转化生成了
。检验该转化生成了 的操作为
的操作为(4)工业上,测定
 样品纯度的方法:取
样品纯度的方法:取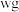 样品溶于稀硫酸,加入足量
样品溶于稀硫酸,加入足量 溶液,再加入
溶液,再加入 的
的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 。
。相关反应:
 ;
; 。
。①该样品中
 的质量分数为
的质量分数为②如果稀硫酸过多,测得结果会
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐2】准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100 mL H2SO4
溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示。求
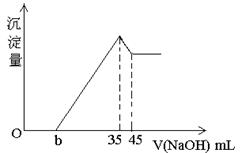
(1)硫酸溶液的物质的量浓度。
(2)若b=2.3,求铝土矿中SiO2的质量分数。
溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如图所示。求

(1)硫酸溶液的物质的量浓度。
(2)若b=2.3,求铝土矿中SiO2的质量分数。
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
【推荐3】化学工业中会产生大量含铬废水。需进行无害化处理检测达标后才能排放。
(1)工业常用NaHSO3还原法处理,方法:向酸性废水中加入NaHSO3使Cr2O 还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
①写出NaHSO3与Cr2O 反应的离子方程式:
反应的离子方程式:___________ 。
②已知25℃时Ksp[Cr(OH)3]=6.4×10-31,若除去废水中Cr3+,使其浓度小于1×10-5mol·L-1,此时溶液中的c(H+)<___________ mol·L-1
(2)废水中铬元素总浓度的测定方法:向一定量含Cr2O 和Cr3+的酸性废水样中加入足量(NH4)2S2O8,溶液将Cr3+氧化成Cr2O
和Cr3+的酸性废水样中加入足量(NH4)2S2O8,溶液将Cr3+氧化成Cr2O ,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O
,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O 与I-完全反应生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系为Cr3+
与I-完全反应生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系为Cr3+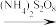 Cr2O
Cr2O
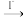 I2
I2 S4O
S4O 。
。
①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会___________ (填“偏大”、“偏小”或“不变”)。
②准确移取含Cr2O 和Cr3+的酸性废水样100.00mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000mol·L-1Na2S2O3标准溶液13.50mL。计算该废水中铬元素总浓度(以mg·L-1表示)(写出计算过程)。
和Cr3+的酸性废水样100.00mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000mol·L-1Na2S2O3标准溶液13.50mL。计算该废水中铬元素总浓度(以mg·L-1表示)(写出计算过程)。___________
(1)工业常用NaHSO3还原法处理,方法:向酸性废水中加入NaHSO3使Cr2O
 还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。①写出NaHSO3与Cr2O
 反应的离子方程式:
反应的离子方程式:②已知25℃时Ksp[Cr(OH)3]=6.4×10-31,若除去废水中Cr3+,使其浓度小于1×10-5mol·L-1,此时溶液中的c(H+)<
(2)废水中铬元素总浓度的测定方法:向一定量含Cr2O
 和Cr3+的酸性废水样中加入足量(NH4)2S2O8,溶液将Cr3+氧化成Cr2O
和Cr3+的酸性废水样中加入足量(NH4)2S2O8,溶液将Cr3+氧化成Cr2O ,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O
,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O 与I-完全反应生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系为Cr3+
与I-完全反应生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系为Cr3+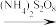 Cr2O
Cr2O
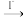 I2
I2 S4O
S4O 。
。①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会
②准确移取含Cr2O
 和Cr3+的酸性废水样100.00mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000mol·L-1Na2S2O3标准溶液13.50mL。计算该废水中铬元素总浓度(以mg·L-1表示)(写出计算过程)。
和Cr3+的酸性废水样100.00mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000mol·L-1Na2S2O3标准溶液13.50mL。计算该废水中铬元素总浓度(以mg·L-1表示)(写出计算过程)。
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐1】(1)已知25 ℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。请回答下列问题:
①25℃时,若向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,混合后溶液中的c(Ag+)为________ mol·L-1,pH为________ 。
②25℃时,取一定量含有I-、Cl-的溶液,向其中滴加AgNO3溶液,当AgCl和AgI同时沉淀时,溶液中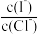 为
为________ 。
已知:2CrO42-+2H+ Cr2O
Cr2O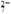 +H2O,25 ℃时,Ksp(Ag2CrO4)=9.0×10-12,Ksp(Ag2Cr2O7)=2.0×10-7,向Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是
+H2O,25 ℃时,Ksp(Ag2CrO4)=9.0×10-12,Ksp(Ag2Cr2O7)=2.0×10-7,向Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是__________ 。
(3)已知:25 ℃时Ksp(Ag2CrO4)=9.0×10-12,Ksp(AgCl)=1.8×10-10,说明Ag2CrO4的溶解度________ (填“大于”“小于”或“等于”)AgCl的。
(4)25 ℃时,Mg(OH)2饱和溶液________ (填“能”或“不能”)使石蕊溶液变蓝色。(已知Ksp[Mg(OH)2]=4.0×10-12,lg 5=0.7)。
①25℃时,若向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,混合后溶液中的c(Ag+)为
②25℃时,取一定量含有I-、Cl-的溶液,向其中滴加AgNO3溶液,当AgCl和AgI同时沉淀时,溶液中
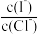 为
为已知:2CrO42-+2H+
 Cr2O
Cr2O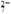 +H2O,25 ℃时,Ksp(Ag2CrO4)=9.0×10-12,Ksp(Ag2Cr2O7)=2.0×10-7,向Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是
+H2O,25 ℃时,Ksp(Ag2CrO4)=9.0×10-12,Ksp(Ag2Cr2O7)=2.0×10-7,向Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是(3)已知:25 ℃时Ksp(Ag2CrO4)=9.0×10-12,Ksp(AgCl)=1.8×10-10,说明Ag2CrO4的溶解度
(4)25 ℃时,Mg(OH)2饱和溶液
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐2】电解金属锰阳极渣(主要成分MnO2,杂质为Pb、Fe、Cu元素的化合物)和黄铁矿(FeS2)为原料可制备Mn3O4,其流程如图所示:
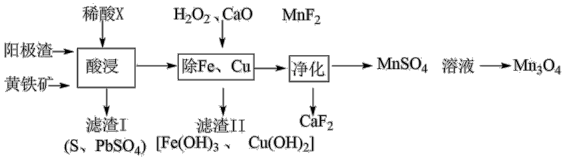
已知:Ksp(MnF2)=5.0×10−3、Ksp(CaF2)=3.5×10−11,回答下列问题:
(1)“酸浸”时,所用的稀酸X是_______ (填化学式)。
(2)“酸浸”过程中,Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图所示。
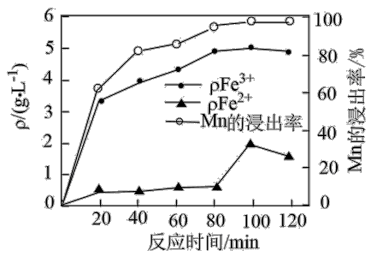
20~80 min内,浸出Mn元素的主要离子方程式为_______ 。
(3)室温下,反应MnF2(s)+Ca2+(aq) CaF2(s)+Mn2+(aq)达到平衡时,Mn2+的浓度为2 mol·L-1,则此时Ca2+的浓度为
CaF2(s)+Mn2+(aq)达到平衡时,Mn2+的浓度为2 mol·L-1,则此时Ca2+的浓度为_______ 。
(4)Mn3O4含量的测定:准确称取0.2400gMn3O4样品于锥形瓶中,加入25.00 mL0.2000 mol·L-1草酸钠溶液和适量硫酸,加热。待样品完全溶解后,冷却,立即用0.1000 mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液16.00 mL。测定过程中发生下列反应:Mn3O4+C2O +8H+=3Mn2++2CO2↑+4H2O;2MnO
+8H+=3Mn2++2CO2↑+4H2O;2MnO +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O;计算Mn3O4样品的纯度(写出计算过程)。
+16H+=2Mn2++10CO2↑+8H2O;计算Mn3O4样品的纯度(写出计算过程)。________

已知:Ksp(MnF2)=5.0×10−3、Ksp(CaF2)=3.5×10−11,回答下列问题:
(1)“酸浸”时,所用的稀酸X是
(2)“酸浸”过程中,Fe2+、Fe3+的质量浓度、Mn浸出率与时间的关系如图所示。

20~80 min内,浸出Mn元素的主要离子方程式为
(3)室温下,反应MnF2(s)+Ca2+(aq)
 CaF2(s)+Mn2+(aq)达到平衡时,Mn2+的浓度为2 mol·L-1,则此时Ca2+的浓度为
CaF2(s)+Mn2+(aq)达到平衡时,Mn2+的浓度为2 mol·L-1,则此时Ca2+的浓度为(4)Mn3O4含量的测定:准确称取0.2400gMn3O4样品于锥形瓶中,加入25.00 mL0.2000 mol·L-1草酸钠溶液和适量硫酸,加热。待样品完全溶解后,冷却,立即用0.1000 mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液16.00 mL。测定过程中发生下列反应:Mn3O4+C2O
 +8H+=3Mn2++2CO2↑+4H2O;2MnO
+8H+=3Mn2++2CO2↑+4H2O;2MnO +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O;计算Mn3O4样品的纯度(写出计算过程)。
+16H+=2Mn2++10CO2↑+8H2O;计算Mn3O4样品的纯度(写出计算过程)。
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐3】(1)pH相同的下列物质的溶液①(NH4)2SO4;②NH4HSO4;③NH4NO3,铵根离子浓度由小到大的顺序是__________ (填序号)。
(2)同浓度的下列溶液:①HCl;②NH4Cl;③Na2CO3;④NaHCO3,其中pH由大到小的顺序是______________ 。
(3)物质的量浓度相同的①盐酸、②硫酸溶液、元③醋酸(CH3COOH)溶液各100mL分别与足量的Zn反应,在相同的条件下,产生H2的体积分别为V1、V2、V3,它们由大到小的顺序是___________ 。
(4)等体积的CH3COOH与NaOH溶液反应后溶液中存在c(Na+)<c(CH3COO-),该溶液呈______ 性(填“酸”、“碱”或“中”),反应前c(NaOH)_____ c(CH3COOH)(填“>”“<”或“=”)
(5)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为____ mol/L,此时溶液中c(CrO42-)等于_____ mol/L。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
(2)同浓度的下列溶液:①HCl;②NH4Cl;③Na2CO3;④NaHCO3,其中pH由大到小的顺序是
(3)物质的量浓度相同的①盐酸、②硫酸溶液、元③醋酸(CH3COOH)溶液各100mL分别与足量的Zn反应,在相同的条件下,产生H2的体积分别为V1、V2、V3,它们由大到小的顺序是
(4)等体积的CH3COOH与NaOH溶液反应后溶液中存在c(Na+)<c(CH3COO-),该溶液呈
(5)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与
 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
【推荐1】质量、物质的量、物质的量浓度等是用于化学计算的常见物理量。
(1)质量之比为16:7:6的三种气体 、CO、NO。分子个数之比为
、CO、NO。分子个数之比为_______ ;氧原子个数之比为_______ ;相同条件下的体积之比为_______ 。
(2)标准状况下,17g 的体积为
的体积为_______ ,含有氢原子个数为_______ ,它与标准状况下_______ L  含有相同数目的氢原子。
含有相同数目的氢原子。
(3)某气体氧化物的化学式为 ,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为
,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为_______ ,R的相对原子质量为_______ 。
(4)同温同压下, 气体与
气体与 气体等体积化合,生成
气体等体积化合,生成 气体,已知反应前后气体的密度不变,则
气体,已知反应前后气体的密度不变,则 的分子式为
的分子式为_______ 。
(5)在t℃时将a g 完全溶于水得到V mL溶液,该溶液的密度为
完全溶于水得到V mL溶液,该溶液的密度为 ;质量分数为w,物质的量浓度为c
;质量分数为w,物质的量浓度为c  。下列计算结果正确的是
。下列计算结果正确的是
(6)将a L  和
和 的混合溶液分成两等份,一份加入b mol
的混合溶液分成两等份,一份加入b mol  溶液使溶液中的
溶液使溶液中的 刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c mol
刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c mol ,则原溶液中
,则原溶液中 的物质的量浓度为
的物质的量浓度为_______ 。
(7)将0.24g Mg和0.27g Al的混合物投入到100mL 1mol/L的盐酸中,充分反应后固体完全溶解。向所得溶液中加入2mol/L的NaOH溶液,恰好使金属离子全部沉淀完全。写出加入NaOH溶液发生的相关离子方程式_______ ,需要NaOH溶液的体积为_______ mL。
(8)常温下A和B两种气体组成的混合物(A的摩尔质量大于B的摩尔质量),经分析混合气体中只含有C、O元素:
①当混合物中C、O的质量比总是小于3:8时,混合气体中A和B分别是_______ 、_______ 。
②当混合物中C、O的质量比为1:2时,混合气体中A的体积百分数为_______ 。
(1)质量之比为16:7:6的三种气体
 、CO、NO。分子个数之比为
、CO、NO。分子个数之比为(2)标准状况下,17g
 的体积为
的体积为 含有相同数目的氢原子。
含有相同数目的氢原子。(3)某气体氧化物的化学式为
 ,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为
,在标准状况下,1.28g该氧化物的体积为448mL,则该氧化物的摩尔质量为(4)同温同压下,
 气体与
气体与 气体等体积化合,生成
气体等体积化合,生成 气体,已知反应前后气体的密度不变,则
气体,已知反应前后气体的密度不变,则 的分子式为
的分子式为(5)在t℃时将a g
 完全溶于水得到V mL溶液,该溶液的密度为
完全溶于水得到V mL溶液,该溶液的密度为 ;质量分数为w,物质的量浓度为c
;质量分数为w,物质的量浓度为c  。下列计算结果正确的是
。下列计算结果正确的是A.溶质的质量分数 |
B.溶质的物质的量浓度 |
C.溶液密度 可表示为 可表示为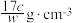 |
| D.上述溶液中再加入V mL水,所得溶液溶质的质量分数小于0.5w |
 和
和 的混合溶液分成两等份,一份加入b mol
的混合溶液分成两等份,一份加入b mol  溶液使溶液中的
溶液使溶液中的 刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c mol
刚好完全沉定,另一份加入足量NaOH溶液并加热可得到c mol ,则原溶液中
,则原溶液中 的物质的量浓度为
的物质的量浓度为(7)将0.24g Mg和0.27g Al的混合物投入到100mL 1mol/L的盐酸中,充分反应后固体完全溶解。向所得溶液中加入2mol/L的NaOH溶液,恰好使金属离子全部沉淀完全。写出加入NaOH溶液发生的相关离子方程式
(8)常温下A和B两种气体组成的混合物(A的摩尔质量大于B的摩尔质量),经分析混合气体中只含有C、O元素:
①当混合物中C、O的质量比总是小于3:8时,混合气体中A和B分别是
②当混合物中C、O的质量比为1:2时,混合气体中A的体积百分数为
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
【推荐2】将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)。试计算:
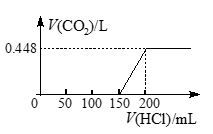
(1)盐酸的物质的量浓度为__________ mol/L。
(2)该样品中NaOH与Na2CO3的物质的量之比(写出计算过程,只有答案不给分)。__________

(1)盐酸的物质的量浓度为
(2)该样品中NaOH与Na2CO3的物质的量之比(写出计算过程,只有答案不给分)。
您最近一年使用:0次