在下列叙述中:①0.1mol•L-1HA溶液的导电性比0.1mol•L-1的盐酸的导电性弱;②测得0.1mol•L-1的HA溶液的pH=2.7;③常温下,测得NaA溶液的pH>7;④常温下,向HA的溶液中加入NaA固体,pH增大;⑤等pH等体积的盐酸和HA溶液分别与足量的Zn反应,HA放出的H2多。能说明HA是弱酸的是( )
| A.①②③④⑤ | B.②③④⑤ | C.①②③⑤ | D.①②③④ |
更新时间:2020-04-05 13:14:20
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】化学上常用标准电极电势 (氧化型/还原型)比较物质氧化能力。
(氧化型/还原型)比较物质氧化能力。 值越高,氧化型物质的氧化能力越强,
值越高,氧化型物质的氧化能力越强, 值与体系的pH有关,根据表格数据分析,下列说法中正确的是
值与体系的pH有关,根据表格数据分析,下列说法中正确的是
 (氧化型/还原型)比较物质氧化能力。
(氧化型/还原型)比较物质氧化能力。 值越高,氧化型物质的氧化能力越强,
值越高,氧化型物质的氧化能力越强, 值与体系的pH有关,根据表格数据分析,下列说法中正确的是
值与体系的pH有关,根据表格数据分析,下列说法中正确的是| 氧化型/还原型 | 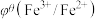 | 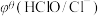 |
| 酸性介质 | 0.77 V | 1.49 V |
| 氧化型/还原型 | 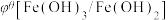 |  |
| 碱性介质 | -0.56 V | x |
| 氧化型/还原型 |  | 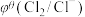 |
| 碱性介质 | 0.72 V | 1.63 V |
| A.表格数据分析,氧化性:Cl2>HClO |
| B.Fe2O3与浓盐酸发生反应:Fe2O3+2Cl-+6H+=2Fe2++Cl2↑+3H2O |
| C.从图中数据可知,氧化型物质的氧化性随着溶液酸性增强而减弱 |
| D.若x=0.81 V,碱性条件下可发生反应:Fe(OH)2+2NaClO+2NaOH=Fe2FeO4+2NaCl+2H2O |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列实验操作、现象和得出的结论都正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 用pH试纸测同温同浓度的KClO3和NaClO溶液的pH,NaClO溶液pH值大 | 溶液的碱性:NaClO>KClO3 |
| B | 向KBr、KI混合溶液中依次加入少量氯水和CCl4,振荡,静置,溶液分层,上层几乎无色,下层紫红色 | 非金属性:Cl>Br>I |
| C | 将Na[Al(OH)4](或写为NaAlO2)溶液加入NaHCO3溶液中,有白色沉淀生成 | 结合H+能力: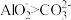 |
| D | 向两支盛有KI3溶液的试管中分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀生成 | KI3溶液中存在平衡: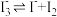 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】室温时,已知Ka(CH3COOH)=Kb(NH3∙H2O)。关于浓度均为0.1mol·L-1的醋酸和氨水的两种溶液的说法正确的是( )
①两溶液的pH之和为14
②两溶液中醋酸和NH3∙H2O的电离程度相同
③两溶液加水稀释,溶液中各离子浓度均降低
④两溶液等体积混合,pH=7,由水电离出c(H+)=1×10-7mol·L-1
①两溶液的pH之和为14
②两溶液中醋酸和NH3∙H2O的电离程度相同
③两溶液加水稀释,溶液中各离子浓度均降低
④两溶液等体积混合,pH=7,由水电离出c(H+)=1×10-7mol·L-1
| A.①② | B.②④ | C.①②④ | D.①②③④ |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】下列说法正确的是


A.向氨水中不断通入 ,随着 ,随着 的增加, 的增加,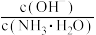 不断增大 不断增大 |
| B.在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu |
C.常温下,反应 , ,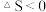 |
| D.将如图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】常温下,下列有关醋酸溶液的叙述中不正确的是
| A.向等体积pH均为2的醋酸和硫酸中分别加入足量锌粒,产生气体的量前者大于后者 |
| B.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和,则a+b=14 |
| C.相同条件下,将pH=2的硫酸溶液和pH=2的醋酸溶液分别稀释成pH=5的溶液,所加水的体积后者大 |
| D.将pH=a的醋酸稀释为pH=a+1的过程中,c(H+)减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列实验事实不能证明醋酸是弱电解质的是
| A.相同pH的醋酸溶液和盐酸分别与同样颗粒大小的锌反应时,产生H2的起始速率相等 |
| B.相同pH、相同体积的盐酸和醋酸溶液中和同浓度NaOH溶液的能力:醋酸>盐酸 |
| C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4 |
| D.常温下,醋酸溶液的导电性比同物质的量浓度盐酸的弱 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】相同温度条件下,c(H+)均为0.1mol/L的①盐酸②醋酸溶液各100mL分别和0.3g锌反应,下列说法中正确的是
| A.①中锌消失的快 | B.②锌消失的快 |
| C.①中产生的氢气多 | D.②中产生的氢气多 |
您最近一年使用:0次

 。下列有关叙述不正确的是
。下列有关叙述不正确的是

