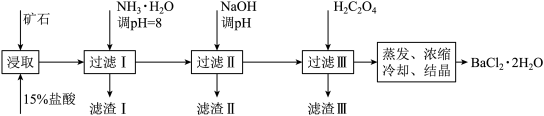
某矿石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用该矿石制备BaCl2•2H2O的流程如图,且三次滤渣的主要成分各不相同:
如表为常温时各离子转化为氢氧化物沉淀时的pH:
(1)用15%盐酸浸取前需充分研磨,目的是______ 。
(2)滤渣Ⅰ的主要成分为______ ;加入NaOH调pH的范围为______ ;加入H2C2O4时应避免过量的原因是______ 。[已知难溶物质:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9]
(3)已知:25℃时,Ksp(BaCO3)=5.4×10-9,Ksp(CaCO3)=2.7×10-9。向CaCO3固体的溶液中加入高浓度的BaCl2溶液,有BaCO3沉淀生成,请写出该反应的离子方程式______ ,该反应的平衡常数K=______ 。
(4)取制得的BaCl2•2H2O(含少量杂质)2.5g配成100mL溶液,取10.00mL该溶液于烧杯中,加入足量(NH4)2C2O4溶液,过滤,洗涤,将得到的BaC2O4沉淀用过量稀硫酸溶液溶解,过滤除去BaSO4沉淀,将所得的H2C2O4溶液移入锥形瓶,用0.05mol/L高锰酸钾标准液滴定至终点。
已知:Ba2++C2O42-═BaC2O4↓
BaC2O4+2H++SO42-═BaSO4↓+H2C2O4
5H2C2O4+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
①滴定中盛放高锰酸钾标准液的仪器为______ ,滴入最后一滴高锰酸钾溶液,锥形瓶中溶液颜色______ ,即说明达到滴定终点。
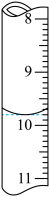
②若滴定前滴定管的读数为1.80mL,滴定终点时滴定管中液面如图,请计算BaCl2•2H2O的纯度为______ (保留3位有效数字)。

如表为常温时各离子转化为氢氧化物沉淀时的pH:
| Fe3+ | Mg2+ | Ca2+ | |
| 开始沉淀时的pH | 1.9 | 9.1 | 11.9 |
| 完全沉淀时的pH | 3.2 | 11.1 | 13.9 |
(1)用15%盐酸浸取前需充分研磨,目的是
(2)滤渣Ⅰ的主要成分为
(3)已知:25℃时,Ksp(BaCO3)=5.4×10-9,Ksp(CaCO3)=2.7×10-9。向CaCO3固体的溶液中加入高浓度的BaCl2溶液,有BaCO3沉淀生成,请写出该反应的离子方程式
(4)取制得的BaCl2•2H2O(含少量杂质)2.5g配成100mL溶液,取10.00mL该溶液于烧杯中,加入足量(NH4)2C2O4溶液,过滤,洗涤,将得到的BaC2O4沉淀用过量稀硫酸溶液溶解,过滤除去BaSO4沉淀,将所得的H2C2O4溶液移入锥形瓶,用0.05mol/L高锰酸钾标准液滴定至终点。
已知:Ba2++C2O42-═BaC2O4↓
BaC2O4+2H++SO42-═BaSO4↓+H2C2O4
5H2C2O4+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
①滴定中盛放高锰酸钾标准液的仪器为
②若滴定前滴定管的读数为1.80mL,滴定终点时滴定管中液面如图,请计算BaCl2•2H2O的纯度为

更新时间:2020-04-05 20:18:28
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
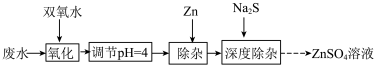
【推荐1】利用某工厂废水(主要成分含有 、
、 、
、 ,及少量
,及少量 、
、 、
、 )制备
)制备 溶液的实验流程如下:
溶液的实验流程如下:
已知:①溶液中金属离子的浓度小于 时,可视为沉淀完全。
时,可视为沉淀完全。
②室温下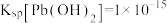 ,
,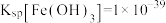 ,
,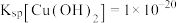 ,
,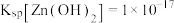
(1)①“氧化”步骤的离子方程式为_______ 。
②调节 的目的是
的目的是_______ 。
(2)流程中分两步除杂而不采用直接加 溶液除杂,除了减少
溶液除杂,除了减少 的使用量之外,还可能的原因是:
的使用量之外,还可能的原因是:_______ 。
(3)测定 溶液的浓度。准确量取
溶液的浓度。准确量取 溶液于
溶液于 容量瓶中,加水稀释至刻度;准确量取
容量瓶中,加水稀释至刻度;准确量取 稀释后的溶液于锥形瓶中,滴加氨水调节溶液的
稀释后的溶液于锥形瓶中,滴加氨水调节溶液的 ,用
,用 标准溶液滴定至终点(滴定反应为
标准溶液滴定至终点(滴定反应为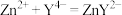 ),平行滴定3次,平均消耗
),平行滴定3次,平均消耗 标准溶液
标准溶液 。计算
。计算 溶液的物质的量浓度
溶液的物质的量浓度_______ (写出计算过程)。
(4)以 溶液为原料制备的
溶液为原料制备的 脱硫剂,可用于脱除煤气中的
脱硫剂,可用于脱除煤气中的 。
。
①400℃时,将一定比例 、
、 、
、 和
和 的混合气体以一定流速通过装有
的混合气体以一定流速通过装有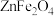 脱硫剂的硫化反应器。硫化过程中
脱硫剂的硫化反应器。硫化过程中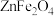 与
与 、
、 反应生成
反应生成 和
和 ,其化学方程式为
,其化学方程式为_______ 。
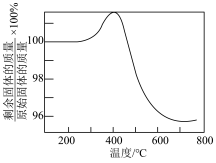
②将硫化后的固体在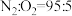 (体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是
(体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是_______ 。
 、
、 、
、 ,及少量
,及少量 、
、 、
、 )制备
)制备 溶液的实验流程如下:
溶液的实验流程如下:
已知:①溶液中金属离子的浓度小于
 时,可视为沉淀完全。
时,可视为沉淀完全。②室温下
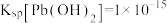 ,
,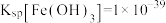 ,
,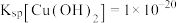 ,
,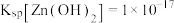
(1)①“氧化”步骤的离子方程式为
②调节
 的目的是
的目的是(2)流程中分两步除杂而不采用直接加
 溶液除杂,除了减少
溶液除杂,除了减少 的使用量之外,还可能的原因是:
的使用量之外,还可能的原因是:(3)测定
 溶液的浓度。准确量取
溶液的浓度。准确量取 溶液于
溶液于 容量瓶中,加水稀释至刻度;准确量取
容量瓶中,加水稀释至刻度;准确量取 稀释后的溶液于锥形瓶中,滴加氨水调节溶液的
稀释后的溶液于锥形瓶中,滴加氨水调节溶液的 ,用
,用 标准溶液滴定至终点(滴定反应为
标准溶液滴定至终点(滴定反应为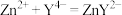 ),平行滴定3次,平均消耗
),平行滴定3次,平均消耗 标准溶液
标准溶液 。计算
。计算 溶液的物质的量浓度
溶液的物质的量浓度(4)以
 溶液为原料制备的
溶液为原料制备的 脱硫剂,可用于脱除煤气中的
脱硫剂,可用于脱除煤气中的 。
。①400℃时,将一定比例
 、
、 、
、 和
和 的混合气体以一定流速通过装有
的混合气体以一定流速通过装有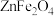 脱硫剂的硫化反应器。硫化过程中
脱硫剂的硫化反应器。硫化过程中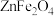 与
与 、
、 反应生成
反应生成 和
和 ,其化学方程式为
,其化学方程式为②将硫化后的固体在
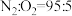 (体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是
(体积比)的混合气体中加热再生,固体质量随温度变化的曲线如图所示。在280~400℃范围内,固体质量增加的主要原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】利用废镍电池的金属电极芯(主要成分为Co、Ni,还含少量Fe、Al等)生产醋酸钴晶体、硫酸镍晶体的工艺流程如下

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
(1)用硫酸浸取金属电极芯时,提高浸取率的方法有___________ (写出一种合理方法即可)。
(2)沉淀A的主要成分是Fe(OH)3、___________ ,“浸出液”调节pH的范围为___________ ,调节pH选用的试剂可以是___________ (填字母)。
a.铁 b.氨水 c.碳酸钠溶液 d.稀硫酸
(3)“母液1”中加入NaClO反应的离子方程式为___________ 。
(4)向Co(OH)3中加入H2SO4-H2O2混合液,H2O2的作用是___________ 。
(5)“母液3”中应控制Na2CO3用量使终点pH为8.5为宜,此时c(Co2+)小于___________ mol·L-1;为防止生成Co(OH)2 沉淀,可用NH4HCO3代替Na2CO3制得CoCO3,写出该反应的离子方程式:___________ {已知:Ksp[Co(OH)2]=2×10-15};
(6)由“母液4”获取NiSO4·7H2O的操作是___________ 、___________ 、过滤、洗涤。

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Co(OH)3 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀pH | 2.2 | 7.4 | 7.6 | 0.1 | 4.0 | 7.6 |
| 完全沉淀pH | 3.2 | 8.9 | 9.2 | 1.1 | 5.2 | 9.2 |
(1)用硫酸浸取金属电极芯时,提高浸取率的方法有
(2)沉淀A的主要成分是Fe(OH)3、
a.铁 b.氨水 c.碳酸钠溶液 d.稀硫酸
(3)“母液1”中加入NaClO反应的离子方程式为
(4)向Co(OH)3中加入H2SO4-H2O2混合液,H2O2的作用是
(5)“母液3”中应控制Na2CO3用量使终点pH为8.5为宜,此时c(Co2+)小于
(6)由“母液4”获取NiSO4·7H2O的操作是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】汽车尾气和燃煤尾气是造成空气污染的原因之一,严重时导致雾霾。
(1)汽车尾气净化的主要原理为2NO(g) + 2CO(g) 2CO2(g) + N2(g)。在固定容积为2L的密闭容器中通入0.8mol的NO和0.8mol的CO,发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。据此判断:
2CO2(g) + N2(g)。在固定容积为2L的密闭容器中通入0.8mol的NO和0.8mol的CO,发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。据此判断:___________ 0(填“>”、“<”或“=”)
② 在T1温度下,0~2 s内的平均反应速率v(N2)=___________
③ 在T1温度下,该反应的平衡常数K=___________ (填计算结果)
(2)直接排放煤燃烧产生的烟气也会引起严重的环境问题。
① 煤燃烧产生的SO2也是空气污染源,假设用酸性KMnO4溶液吸收煤燃烧产生的SO2,该过程中MnO 被还原为Mn2+,请写出该过程的离子方程式
被还原为Mn2+,请写出该过程的离子方程式___________
② 将燃煤产生的二氧化碳加以回收,可降低碳的排放。下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图,据此完成下列问题:___________ (填“正极”或“负极”),b电极的反应式:___________
(3)某化学兴趣小组拟采用Ca(OH)2和Ba(OH)2溶液来吸收SO3气体。现分别以0.01mol/L的氢氧化钙和氢氧化钡溶液吸收SO3气体。假设采用Ca(OH)2溶液吸收(假设吸收过程中溶液的体积不变),当溶液中c(SO )达到
)达到___________ mol/L时,Ca2+开始沉淀。(CaSO4的Ksp=1.96×10-4,BaSO4的Ksp=1.08×10-10)
(1)汽车尾气净化的主要原理为2NO(g) + 2CO(g)
 2CO2(g) + N2(g)。在固定容积为2L的密闭容器中通入0.8mol的NO和0.8mol的CO,发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。据此判断:
2CO2(g) + N2(g)。在固定容积为2L的密闭容器中通入0.8mol的NO和0.8mol的CO,发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。据此判断:
② 在T1温度下,0~2 s内的平均反应速率v(N2)=
③ 在T1温度下,该反应的平衡常数K=
(2)直接排放煤燃烧产生的烟气也会引起严重的环境问题。
① 煤燃烧产生的SO2也是空气污染源,假设用酸性KMnO4溶液吸收煤燃烧产生的SO2,该过程中MnO
 被还原为Mn2+,请写出该过程的离子方程式
被还原为Mn2+,请写出该过程的离子方程式② 将燃煤产生的二氧化碳加以回收,可降低碳的排放。下图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图,据此完成下列问题:

(3)某化学兴趣小组拟采用Ca(OH)2和Ba(OH)2溶液来吸收SO3气体。现分别以0.01mol/L的氢氧化钙和氢氧化钡溶液吸收SO3气体。假设采用Ca(OH)2溶液吸收(假设吸收过程中溶液的体积不变),当溶液中c(SO
 )达到
)达到
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。 水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是_________________________ 。
(2)已知:20℃时溶解度/g
则步骤Ⅰ中加入Na2CO3可除去水垢中的______________________ 。
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有____________________________ 。
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因__________________ 。
(4)步骤Ⅲ中,加入Na2SO3的目的是______________________ 。(结合离子方程式用文字表达)
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①完成并配平其反应的离子方程式:
____ Fe+____NO2-+____H2O=______N2↑+__________+_______。
②如果有16.8 g铁被钝化,则转移的电子数为___________________ (保留三位有效数字)。
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是
(2)已知:20℃时溶解度/g
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| 1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
则步骤Ⅰ中加入Na2CO3可除去水垢中的
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因
(4)步骤Ⅲ中,加入Na2SO3的目的是
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜。
①完成并配平其反应的离子方程式:
②如果有16.8 g铁被钝化,则转移的电子数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
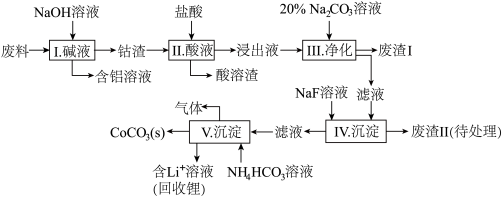
已知:①物质溶解性:LiF、CoCO3难溶于水,Li2CO3微溶于水;
②Co2O3有强氧化性,能氧化盐酸;
③部分金属离子形成氢氧化物沉淀的pH见下表:
请回答:
(1)步骤I中得到含铝溶液的反应的离子方程式是______________ 。
(2)步骤D中加入盐酸的作用是________________ 。
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH控制在_____ (填范围),废渣I中的成分有_____________ 。
(4)步骤V中产生CoCO3的离子方程式是________________ 。
(5)滤渣II用硫酸处理后用三室式电渗析法电解可得LiOH溶液和稀硫酸。则离子交换膜c为__________ (填“阴”或“阳”)离子交换膜,随着电解的进行,阴极区pH将________ (填“增大”、“减小”或“不变”)。

(6)向所得LiOH溶液中加入NH4HCO3即可得到Li2CO3。工业上以碳酸锂和碳酸钴在空气中高温煅烧制备锂离子电池的正极材料钴酸锂 (LiCoO2)时,还会产生一种三原子构成的直线型气体分子,该分子的电子式为___________ ,写出工业上用上述方法制备钴酸锂的化学反应方程式________________ 。
(7)某锂离子充电时电池的总反应为C6+ LiCoO2=LixC6+Li1-xCoO2,该锂离子电池放电时正极的电极反应式为_________________ 。

已知:①物质溶解性:LiF、CoCO3难溶于水,Li2CO3微溶于水;
②Co2O3有强氧化性,能氧化盐酸;
③部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤I中得到含铝溶液的反应的离子方程式是
(2)步骤D中加入盐酸的作用是
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH控制在
(4)步骤V中产生CoCO3的离子方程式是
(5)滤渣II用硫酸处理后用三室式电渗析法电解可得LiOH溶液和稀硫酸。则离子交换膜c为

(6)向所得LiOH溶液中加入NH4HCO3即可得到Li2CO3。工业上以碳酸锂和碳酸钴在空气中高温煅烧制备锂离子电池的正极材料钴酸锂 (LiCoO2)时,还会产生一种三原子构成的直线型气体分子,该分子的电子式为
(7)某锂离子充电时电池的总反应为C6+ LiCoO2=LixC6+Li1-xCoO2,该锂离子电池放电时正极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】实验室以含锰废液为原料可以制取 ,部分实验过程如下:
,部分实验过程如下:

已知室温下,部分难溶电解质的溶度积常数如下表:
(1)经检测,含锰废液中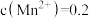 mol·L
mol·L 、
、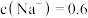 mol·L
mol·L 、
、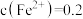 mol·L
mol·L ,还含
,还含 及少量
及少量 、
、 。“氧化”阶段,
。“氧化”阶段, 用量为理论用量的1.1倍。
用量为理论用量的1.1倍。
①“氧化”1 L该废液,需要加入 的物质的量为
的物质的量为______ 。
②检验 已经完全被氧化的方法是
已经完全被氧化的方法是______ 。
(2)“除杂I”加入 调节溶液
调节溶液 。该过程中发生反应的离子方程式为
。该过程中发生反应的离子方程式为______ 。
(3)“除杂Ⅱ”中反应之一为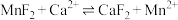 。结合反应的平衡常数解释用
。结合反应的平衡常数解释用 能除去
能除去 的原因:
的原因:________ 。
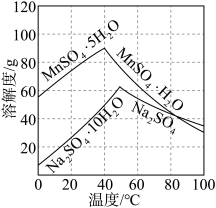
(4)已知 和
和 的溶解度如图所示。请补充完整由粗
的溶解度如图所示。请补充完整由粗 溶液制取
溶液制取 晶体的实验方案:取实验所得粗
晶体的实验方案:取实验所得粗 溶液,
溶液,_______ ,得到 晶体。(可选用的试剂:1 mol·L
晶体。(可选用的试剂:1 mol·L
 溶液,1 mol·L
溶液,1 mol·L
 溶液,1 mol·L
溶液,1 mol·L 盐酸)
盐酸)
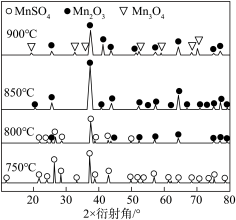
(5)如图为不同温度下硫酸锰焙烧2小时后残留固体的X-射线衍射图。由 固体制取活性
固体制取活性 的方案为:将
的方案为:将 固体置于可控温度的反应管中,
固体置于可控温度的反应管中,_____________ ,将 冷却、研磨、密封包装。(可选用的试剂有:1 mol·L-1
冷却、研磨、密封包装。(可选用的试剂有:1 mol·L-1 ,1 mol·L-1 NaOH溶液)
,1 mol·L-1 NaOH溶液)
 ,部分实验过程如下:
,部分实验过程如下:
已知室温下,部分难溶电解质的溶度积常数如下表:
| 难溶电解质 |  |  |  |  |  |
 | 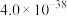 | 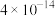 | 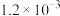 | 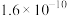 |  |
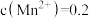 mol·L
mol·L 、
、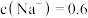 mol·L
mol·L 、
、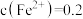 mol·L
mol·L ,还含
,还含 及少量
及少量 、
、 。“氧化”阶段,
。“氧化”阶段, 用量为理论用量的1.1倍。
用量为理论用量的1.1倍。①“氧化”1 L该废液,需要加入
 的物质的量为
的物质的量为②检验
 已经完全被氧化的方法是
已经完全被氧化的方法是(2)“除杂I”加入
 调节溶液
调节溶液 。该过程中发生反应的离子方程式为
。该过程中发生反应的离子方程式为(3)“除杂Ⅱ”中反应之一为
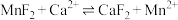 。结合反应的平衡常数解释用
。结合反应的平衡常数解释用 能除去
能除去 的原因:
的原因:(4)已知
 和
和 的溶解度如图所示。请补充完整由粗
的溶解度如图所示。请补充完整由粗 溶液制取
溶液制取 晶体的实验方案:取实验所得粗
晶体的实验方案:取实验所得粗 溶液,
溶液, 晶体。(可选用的试剂:1 mol·L
晶体。(可选用的试剂:1 mol·L
 溶液,1 mol·L
溶液,1 mol·L
 溶液,1 mol·L
溶液,1 mol·L 盐酸)
盐酸)
(5)如图为不同温度下硫酸锰焙烧2小时后残留固体的X-射线衍射图。由
 固体制取活性
固体制取活性 的方案为:将
的方案为:将 固体置于可控温度的反应管中,
固体置于可控温度的反应管中, 冷却、研磨、密封包装。(可选用的试剂有:1 mol·L-1
冷却、研磨、密封包装。(可选用的试剂有:1 mol·L-1 ,1 mol·L-1 NaOH溶液)
,1 mol·L-1 NaOH溶液)
您最近一年使用:0次



