解题方法
1 . 《天工开物》记载“凡钟为金乐之首”,在古代的金属乐器之中,钟是最重要的乐器。铸钟的材料,铜为上等,铁为下等。金属和金属材料在生产和生活中有着广泛的应用。请完成有关金属性质的实验。
Ⅰ.金属的物理性质
(1)铁是应用最广泛的金属.生活中用铁锅做饮具,主要利用铁的______ 性;
Ⅱ.金属的化学性质
(2)将稀盐酸滴加到装有铁、铜的试管中
①一种金属和酸不反应的理由______ ;
②另一种金属与酸反应的现象______ 。
Ⅲ.探究金属的活动性强弱
(3)①有X、Y、Z三种金属,它们具有如下性质:
a.X、Z均不与稀盐酸反应
b.
c.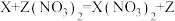
则X、Y、Z三种金属活动性由强到弱的顺序是______ ;
②在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液,向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是______ (填化学式)。
Ⅳ.某工厂欲从含有 的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如图:
的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如图:______ 。
(5)加入过量A物质的化学式是______ 。
(6)加入适B物质时反应的化学方程式是______ 。
Ⅴ.据有关资料报道,世界上每年因腐蚀而报废的金属设备或材料相当于年产量的20%~40%。
(7)炼铁时焦炭的作用______ ,回收报废金属的意义______ 。
(8)请写出自行车链条防止生锈的方法______ 。
Ⅰ.金属的物理性质
(1)铁是应用最广泛的金属.生活中用铁锅做饮具,主要利用铁的
Ⅱ.金属的化学性质
(2)将稀盐酸滴加到装有铁、铜的试管中
①一种金属和酸不反应的理由
②另一种金属与酸反应的现象
Ⅲ.探究金属的活动性强弱
(3)①有X、Y、Z三种金属,它们具有如下性质:
a.X、Z均不与稀盐酸反应
b.

c.
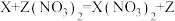
则X、Y、Z三种金属活动性由强到弱的顺序是
②在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,得到滤渣和滤液,向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是
Ⅳ.某工厂欲从含有
 的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如图:
的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如图:
(5)加入过量A物质的化学式是
(6)加入适B物质时反应的化学方程式是
Ⅴ.据有关资料报道,世界上每年因腐蚀而报废的金属设备或材料相当于年产量的20%~40%。
(7)炼铁时焦炭的作用
(8)请写出自行车链条防止生锈的方法
您最近一年使用:0次
2 . 水是一种重要的物质,在日常生活和生产实践中有着不可替代的作用。
(1)水的净化______ 性。
②图2为水的蒸馏装置图,图1与图2的净水原理中,能降低水硬度的净水方法是图_______ (填“1”或“2”)。
③我国人均淡水资源处于紧缺状态,保护水资源是我们每个公民的责任。为了践行“保护水资源”理念,你在生活中的做法为:_______ 。
(2)水的组成_______ (填物质名称),该反应的化学方程式为_______ 。
②电解水的实验中,在玻璃管里加含有酚酞的硫酸钠溶液(硫酸钠溶液呈中性),在实验过程中,观察到管a电极附近的溶液迅速变红,则该处溶液呈______ (填“酸”“碱”或“中”)性。电解后,待溶液混合均匀后测得溶液的pH=7。电解结束后,硫酸钠溶液溶质质量分数与电解前相比_______ (填“增大”、“减小”或“不变”);图4中能表示电解时,管b电极端变化的结果的是_______ (填对应选项的字母)。
(3)水在化学实验中具有重要作用_______ 。打开K,观察到导管内液面下降,导管口有气泡出,该气体是_______ 。(填化学式)
②如图6所示实验中,证明CO2能与水反应的现象是_______ ;因此实验后瓶中澄清石灰水变浑浊,此变化属于______ (填“物理变化”或“化学变化”)。
③如图7所示实验中,一段时间后,缓慢倾斜Y型管,将右侧的稀硫酸部分倒入左侧,依据_______ (填实验现象),可得出金属活动性:Zn>Cu。
(4)空气中的水蒸气的吸收
①生石灰可以用作食品干燥剂,原理是______ 。(写化学反应方程式)
②实验室中常用烧碱和生石灰按照一定比例混合成碱石灰,用做气体干燥剂,碱石灰可以干燥的气体有______ 。(填字母序号)
A.O2 B.H2 C.CO2 D.N2 E.SO2
(1)水的净化
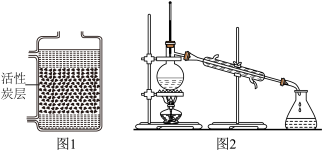
②图2为水的蒸馏装置图,图1与图2的净水原理中,能降低水硬度的净水方法是图
③我国人均淡水资源处于紧缺状态,保护水资源是我们每个公民的责任。为了践行“保护水资源”理念,你在生活中的做法为:
(2)水的组成

②电解水的实验中,在玻璃管里加含有酚酞的硫酸钠溶液(硫酸钠溶液呈中性),在实验过程中,观察到管a电极附近的溶液迅速变红,则该处溶液呈
(3)水在化学实验中具有重要作用

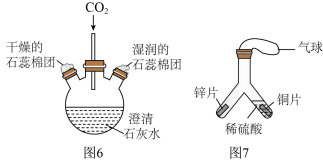
②如图6所示实验中,证明CO2能与水反应的现象是
③如图7所示实验中,一段时间后,缓慢倾斜Y型管,将右侧的稀硫酸部分倒入左侧,依据
(4)空气中的水蒸气的吸收
①生石灰可以用作食品干燥剂,原理是
②实验室中常用烧碱和生石灰按照一定比例混合成碱石灰,用做气体干燥剂,碱石灰可以干燥的气体有
A.O2 B.H2 C.CO2 D.N2 E.SO2
您最近一年使用:0次
解题方法
3 . 金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。
【金属的信息】
如图1、2是钠的相关信息。回答以下问题:_______ 。
(2)图2为钠的某种微粒结构示意图,该微粒的符号为_______ 。
【金属的性质】
(3)填写表格:
【金属发生化学反应的判断】
从“反应物的消耗”和“生成物的检验”两个角度可以对金属是否发生化学反应进行验证。
(4)反应物的消耗:称量0.650g铜粉置于密闭的容器中加热,并用氧气传感器测量密闭容器内氧气的含量从20.99%降低至6.15%,实验结束后将粉末取出,称量其质量_______ (填“大于”“小于”或“等于”)0.650g。
(5)生成物的检验:将(4)反应后得到的黑色粉末放入试管中,加入足量稀硫酸并加热,产生_______ 现象,证明黑色粉末是氧化铜。
【金属含量的测定】
(6)铜锌合金又称“假黄金”。取40g“假黄金”样品,磨成粉末放入烧杯中,向其中加入100g稀硫酸,恰好完全反应,反应后烧杯中物质的总质量为139.6g,请计算该“假黄金”样品中铜的质量分数是_______ 。
【金属的信息】
如图1、2是钠的相关信息。回答以下问题:

(2)图2为钠的某种微粒结构示意图,该微粒的符号为
【金属的性质】
(3)填写表格:
| 调查及实验内容 | 分析及结论 |
| ①由图3可知:合金的熔点 ②图4中 |
| ③图5“真金不怕火来炼”的意思是 ④图6金属铝耐腐蚀的原因是 |
| ⑤图7实验观察到金属A表面覆盖红色固体,则金属A和溶液a分别为 |
【金属发生化学反应的判断】
从“反应物的消耗”和“生成物的检验”两个角度可以对金属是否发生化学反应进行验证。
(4)反应物的消耗:称量0.650g铜粉置于密闭的容器中加热,并用氧气传感器测量密闭容器内氧气的含量从20.99%降低至6.15%,实验结束后将粉末取出,称量其质量
(5)生成物的检验:将(4)反应后得到的黑色粉末放入试管中,加入足量稀硫酸并加热,产生
【金属含量的测定】
(6)铜锌合金又称“假黄金”。取40g“假黄金”样品,磨成粉末放入烧杯中,向其中加入100g稀硫酸,恰好完全反应,反应后烧杯中物质的总质量为139.6g,请计算该“假黄金”样品中铜的质量分数是
您最近一年使用:0次
解题方法
4 . 阅读下列科普短文。
为深入实施“考古中国”及“古蜀文明保护传承工程”,一场高科技助力的多学科“综合考古”在四川三星堆遗址持续进行。为了给予出土文物最佳保护环境,我国首次开创了田野考古发掘新模式——“考古方舱”。考古发掘现场被大跨度钢结构大棚覆盖,文保人员进入舱内时需穿着防护服,尽量减少带入污染物。考古方舱可调节温度和湿度,文保人员还可利用仪器密切跟踪舱内的二氧化碳、二氧化氮等气体含量。考古实验室里配备了充氮保湿箱和各种检测仪器,帮助考古人员完成发掘中的调查。其中,北京大学主导的联合团队采用灵敏度更高的加速器质谱碳-14测年法进行分析,发现4号坑的年代最有可能是在公元前1199年至公元前1017年,属于商代晚期。同时在高光谱成像仪等“黑科技”设备下,4号坑中还发现了丝绸制品的残余,这为“古蜀是中国古代丝绸的重要起源地之一”的理论提供了确凿的证据。
金面具、青铜器在地下埋藏了数千年,青铜器上布满锈斑,锈斑主要分为有害锈【主要成分CuCl】和无害锈【主要成分是Cu2(OH)2CO3】两种,无害锈可以保护青铜器不会继续受损;而有害锈则会加速铜器锈蚀。为了初步判断器物表面的锈蚀是否为有害锈,考古工作者常采用硝酸银(AgNO3)滴定法测试文物表面的锈蚀样品。工作者先将样品浸泡于蒸馏水中12小时,而后使用定性滤纸过滤浸泡液,使浸泡液至相对清澈。在清澈的浸泡液中缓慢滴加3~4滴硝酸银溶液,观察是否有白色沉淀物(AgCl)产生,若出现白色沉淀物,则证明该锈蚀为有害锈。
此次三星堆考古发掘中,3D打印技术也得以大显身手。例如,3号坑的大口尊不易发掘。为了确保万无一失,专家们为它量身3D打印出了“硅胶壳,覆盖在铜尊表面,形成保护。随后再被装入用于固定的木质套箱,利用“文物起重机”取出。
三星堆遗址的考古仍在继续,多学科融合的科技之光必将让古老历史文化遗产绵延流传。回答下列问题:
(1)下列属于金属材料的是______。(多选)
(2)舱内密切跟踪的有害气体是______ (填化学式)。
(3)日常生活中,想要鉴别丝绸与棉布可用______ 法。
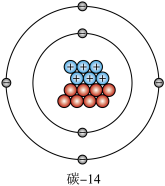
(4)碳-14是一种天然存在的碳的同位素,如图是碳-14的原子结构模型,该原子的质子数为______ 。______ 性。青铜器表面产生无害锈的原因是Cu与空气中的氧气、______ 等发生了反应。有害锈的主要成分CuCl中的Cu的化合价是______ 。
(6)考古工作者利用AgNO3溶液测试有害锈时,除了生成白色沉淀外,溶液中还有CuNO3生成,请写出此反应的化学方程式:______ ,该反应属于______ (填基本反应类型)。
为深入实施“考古中国”及“古蜀文明保护传承工程”,一场高科技助力的多学科“综合考古”在四川三星堆遗址持续进行。为了给予出土文物最佳保护环境,我国首次开创了田野考古发掘新模式——“考古方舱”。考古发掘现场被大跨度钢结构大棚覆盖,文保人员进入舱内时需穿着防护服,尽量减少带入污染物。考古方舱可调节温度和湿度,文保人员还可利用仪器密切跟踪舱内的二氧化碳、二氧化氮等气体含量。考古实验室里配备了充氮保湿箱和各种检测仪器,帮助考古人员完成发掘中的调查。其中,北京大学主导的联合团队采用灵敏度更高的加速器质谱碳-14测年法进行分析,发现4号坑的年代最有可能是在公元前1199年至公元前1017年,属于商代晚期。同时在高光谱成像仪等“黑科技”设备下,4号坑中还发现了丝绸制品的残余,这为“古蜀是中国古代丝绸的重要起源地之一”的理论提供了确凿的证据。
金面具、青铜器在地下埋藏了数千年,青铜器上布满锈斑,锈斑主要分为有害锈【主要成分CuCl】和无害锈【主要成分是Cu2(OH)2CO3】两种,无害锈可以保护青铜器不会继续受损;而有害锈则会加速铜器锈蚀。为了初步判断器物表面的锈蚀是否为有害锈,考古工作者常采用硝酸银(AgNO3)滴定法测试文物表面的锈蚀样品。工作者先将样品浸泡于蒸馏水中12小时,而后使用定性滤纸过滤浸泡液,使浸泡液至相对清澈。在清澈的浸泡液中缓慢滴加3~4滴硝酸银溶液,观察是否有白色沉淀物(AgCl)产生,若出现白色沉淀物,则证明该锈蚀为有害锈。
此次三星堆考古发掘中,3D打印技术也得以大显身手。例如,3号坑的大口尊不易发掘。为了确保万无一失,专家们为它量身3D打印出了“硅胶壳,覆盖在铜尊表面,形成保护。随后再被装入用于固定的木质套箱,利用“文物起重机”取出。
三星堆遗址的考古仍在继续,多学科融合的科技之光必将让古老历史文化遗产绵延流传。回答下列问题:
(1)下列属于金属材料的是______。(多选)
| A.钢架结构 |
| B.丝绸 |
| C.金面具 |
| D.青铜器 |
| E.硅胶壳 |
(2)舱内密切跟踪的有害气体是
(3)日常生活中,想要鉴别丝绸与棉布可用
(4)碳-14是一种天然存在的碳的同位素,如图是碳-14的原子结构模型,该原子的质子数为
(6)考古工作者利用AgNO3溶液测试有害锈时,除了生成白色沉淀外,溶液中还有CuNO3生成,请写出此反应的化学方程式:
您最近一年使用:0次
解题方法
5 . 实验教学作为传授化学知识的重要途径之一,在化学教学中的地位举足轻重。
【拉瓦锡的曲颈甑实验】
(1)200多年前,拉瓦锡将汞放入汞槽与曲颈甑中,通过一系列反应发现汞槽内的汞的液面上升,并得到了一层红色的氧化汞,液面上升的原因是密闭容器内外形成了______ 。随后,对收集起来的氧化汞加强热,得到了一种可供给呼吸的气体______ (填化学式)。
【实验室测定氧气的含量】
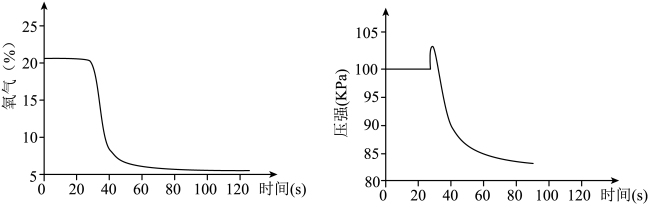
(2)学生们从能与氧气反应的物质,如木炭、硫磺、镁条、红磷等中进行选择,最终选择红磷作为实验药品的原因是______ ;利用下图1装置进行实验的过程中,发现有时进入水的体积大于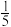 ,造成此结果的原因可能是
,造成此结果的原因可能是______ (写出一种即可);若将装置改进为图2,______ (填写: A.有B.没有)可能避免上述异常现象的发生?在改进的装置中,注射器中的蒸馏水至少需要______ mL。______ 。
(4)氧气是比较活泼的气体,能与大部分金属发生化学反应。因此有同学利用发热眼罩内胆与氧气反应设计实验方案,探究空气中氧气的含量。
该反应的原理与铁生锈反应类似,就是利用内胆中的铁粉与______ 反应。按上图示装置组装好后,学生们观察到量筒中的水面开始上升(量筒中原有空气100mL),直至______ 时,学生开始读数,得到最终上升高度约为19mL。实验中蒸馏水表面放置植物油的目的是______ 。
【拉瓦锡的曲颈甑实验】
(1)200多年前,拉瓦锡将汞放入汞槽与曲颈甑中,通过一系列反应发现汞槽内的汞的液面上升,并得到了一层红色的氧化汞,液面上升的原因是密闭容器内外形成了
【实验室测定氧气的含量】
(2)学生们从能与氧气反应的物质,如木炭、硫磺、镁条、红磷等中进行选择,最终选择红磷作为实验药品的原因是
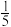 ,造成此结果的原因可能是
,造成此结果的原因可能是
(4)氧气是比较活泼的气体,能与大部分金属发生化学反应。因此有同学利用发热眼罩内胆与氧气反应设计实验方案,探究空气中氧气的含量。

| 产品名称 | 一次性发热贴 |
| 规格型号 | 130mm×95mm |
| 产品成分 | 铁粉、水、活性炭、蛭石、吸水性树脂、食盐 |
| 产品性能 | 最高温度68℃,平均温度52℃,持续实际≥10h |
| 使用范围 | 适用于户外或室内取暖 |
您最近一年使用:0次
解题方法
6 . 中华传统文化典籍中包含很多化学知识。下列解释错误的是
| A.《医学门》:“水洗净,细研。水飞去石澄清,慢火熬干”——“水飞去石”指的是过滤 |
| B.《华阳国志》:“取井火煮之,一斛水得五斗盐”——加热蒸发可得食盐 |
| C.《抱朴子内篇》:“曾青涂铁,铁赤色如铜”——描述了湿法冶铜的原理:铁与硫酸铜反应生成铜,该反应说明铜的活动性强于铁 |
| D.《汉书》:“高奴县有洧水可燃”———洧水指的是石油 |
您最近一年使用:0次
名校
解题方法
7 . 下列实验方案能达到目的的是
| 实验目的 | 实验方案 | |
| A | 鉴别氮气和二氧化碳 | 分别伸入燃着的木条 |
| B | 除去 中的 中的 | 加入适量的稀盐酸 |
| C | 配制 的氯化钠溶液 的氯化钠溶液 | 将 氯化钠与 氯化钠与 水混合均匀 水混合均匀 |
| D | 除去 溶液中的 溶液中的 | 加入过量铁粉,充分反应后过滤 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . 下列对实验现象描述,正确的是
| A.硫在空气中燃烧,产生明亮的蓝紫色火焰 |
| B.把氯化铵和熟石灰放入研钵中研磨,能闻到刺激性氨味 |
| C.红磷在空气中燃烧产生大量烟雾 |
| D.向放有铜片的试管中加入稀硫酸,有气泡产生 |
您最近一年使用:0次
解题方法
9 . 化学在生活和生产中都发挥着重要作用。
《天工开物》是我国古代劳动人民在长期生产生活实践中总结出来的宝贵财富,其中蕴含很多化学知识与方法。
(1)炼锡的场景:“凡煎炼亦用烘炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(指鼓入空气)熔化。”
①鼓入足量空气的目的是___________ ,从而提高炉温。
②“点铅勾锡”是炼锡的关键步骤,加铅能使锡较易熔化流出,其原因是___________ 。
(2)颜料制取:“水银入石亭脂(天然硫),同研……得银朱(HgS)。”银朱是古代作画的红色颜料,其化学名称是___________ 。
(3)池盐制取(图1):将盐池内清水(Na+、Cl-、Mg2+、 等)引入旁边耕成畦垄的地里。“待春秋之交,南风(热风)大起,则一宵(一夜)结成,曰颗盐(粗盐)。”若盐析出时刮东北风(冷风),则味苦(含硫酸镁)色恶,不堪食用。请根据溶解度曲线(图2)解释:
等)引入旁边耕成畦垄的地里。“待春秋之交,南风(热风)大起,则一宵(一夜)结成,曰颗盐(粗盐)。”若盐析出时刮东北风(冷风),则味苦(含硫酸镁)色恶,不堪食用。请根据溶解度曲线(图2)解释:___________ 。
②刮东北风(冷风)时析出盐且味苦的原因:___________ 。
(4)此书记载“铁质贱甚”,写出一个由铁得到铜的化学方程式___________ 。
(5)生石灰的制取和应用(图3):“每煤饼一层,垒石(石灰石)一层,铺薪其底,灼火燔(灼烧)之,火力到后,烧酥石性。以水沃之,亦自解散……成质之后,入水永劫不坏”。
①“灼火燔之”涉及的化学方程式为___________ ,该反应的基本反应类型是___________ 。
②“解散”是生石灰遇水由块状变成粉末。该粉末的主要成分是_______ (填化学式)。粉末“成质之后,入水永劫不坏”,可用于船只、墙壁的填缝防水。请写出“粉末成质”的化学方程式:______ ;根据“入水永劫不坏”,推测“成质”后的产物具有的性质是________ (写一条即可)。
《天工开物》是我国古代劳动人民在长期生产生活实践中总结出来的宝贵财富,其中蕴含很多化学知识与方法。
(1)炼锡的场景:“凡煎炼亦用烘炉,入砂数百斤,丛架木炭亦数百斤,鼓鞴(指鼓入空气)熔化。”
①鼓入足量空气的目的是
②“点铅勾锡”是炼锡的关键步骤,加铅能使锡较易熔化流出,其原因是
(2)颜料制取:“水银入石亭脂(天然硫),同研……得银朱(HgS)。”银朱是古代作画的红色颜料,其化学名称是
(3)池盐制取(图1):将盐池内清水(Na+、Cl-、Mg2+、
 等)引入旁边耕成畦垄的地里。“待春秋之交,南风(热风)大起,则一宵(一夜)结成,曰颗盐(粗盐)。”若盐析出时刮东北风(冷风),则味苦(含硫酸镁)色恶,不堪食用。请根据溶解度曲线(图2)解释:
等)引入旁边耕成畦垄的地里。“待春秋之交,南风(热风)大起,则一宵(一夜)结成,曰颗盐(粗盐)。”若盐析出时刮东北风(冷风),则味苦(含硫酸镁)色恶,不堪食用。请根据溶解度曲线(图2)解释:
②刮东北风(冷风)时析出盐且味苦的原因:
(4)此书记载“铁质贱甚”,写出一个由铁得到铜的化学方程式
(5)生石灰的制取和应用(图3):“每煤饼一层,垒石(石灰石)一层,铺薪其底,灼火燔(灼烧)之,火力到后,烧酥石性。以水沃之,亦自解散……成质之后,入水永劫不坏”。
①“灼火燔之”涉及的化学方程式为
②“解散”是生石灰遇水由块状变成粉末。该粉末的主要成分是
您最近一年使用:0次
10 . 化学反应热在生产、生活中有着广泛的应用。同学们对市售的各种发热商品的发热原理开展了项目式研究。
Ⅰ、自热火锅
(1)市售的“自热火锅”加热的原理是水与自热包内的物质(内含铁粉、生石灰、焦炭、活性炭等)接触反应,放出大量热,该反应的化学方程式为__________ ,该反应的基本反应类型为__________ 。
Ⅱ、暖贴
(2)“暖贴”可贴于身体的某个部位自行发热,用于取暖或热敷,其发热原理是利用铁粉生锈放出热量,铁粉生锈的条件是__________ ,该过程是将化学能转化为__________ 。
Ⅲ、野外加热袋
加热袋常用于野外加热食物。加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量的热。实验小组对放热过程中的反应原理展开了如下探究。
【阅读资料】常温下镁粉与水能发生置换反应生成一种碱和一种气体并放出热量。
【模拟实验】分别取不同成分的固体粉末放入如锥形瓶中,通过分液漏斗向其中均匀加入 水,记录甲中所得固液混合物的最高温度,实验信息如下表:(实验时室温为
水,记录甲中所得固液混合物的最高温度,实验信息如下表:(实验时室温为 )
)
【解释与结论】
(3)实验B,乙中现象为__________ 。
(4)实验A证明了镁粉与水能反应,该反应的化学方程式为__________ 。
(5)使镁粉与水迅速反应并放热的最佳方法是向镁粉中加入__________ 。
【反思改进】
(6)同学们分析实验数据发现,升高的温度没有达到食品加热袋的效果,原因可能是__________ (答出一点即可)。
(7)依据__________ 两个实验(填实验序号),可以初步得出 溶于水没有热量的变化的结论。
溶于水没有热量的变化的结论。
(8)通过以上探究,你认为在日常生活中我们使用发热商品时要注意的问题是__________ 。
Ⅰ、自热火锅
(1)市售的“自热火锅”加热的原理是水与自热包内的物质(内含铁粉、生石灰、焦炭、活性炭等)接触反应,放出大量热,该反应的化学方程式为
Ⅱ、暖贴
(2)“暖贴”可贴于身体的某个部位自行发热,用于取暖或热敷,其发热原理是利用铁粉生锈放出热量,铁粉生锈的条件是
Ⅲ、野外加热袋
加热袋常用于野外加热食物。加热袋中的固体粉末含镁粉、铁粉和氯化钠,使用时向其中加入水袋中的水,即可产生大量的热。实验小组对放热过程中的反应原理展开了如下探究。
【阅读资料】常温下镁粉与水能发生置换反应生成一种碱和一种气体并放出热量。
【模拟实验】分别取不同成分的固体粉末放入如锥形瓶中,通过分液漏斗向其中均匀加入
 水,记录甲中所得固液混合物的最高温度,实验信息如下表:(实验时室温为
水,记录甲中所得固液混合物的最高温度,实验信息如下表:(实验时室温为 )
)
| 实验序号 | A | B | C | D |  |  |
| 固体成分 |  |  |  |  |  |  |
| 乙中现象 | 少量肥皂泡难以点燃 | 少量肥皂泡难以点燃 | 较多肥皂泡点燃有爆鸣声 | 无肥皂泡 | 大量肥皂泡点燃有爆呜声 | |
| 混合物温度 |  |  |  |  |  |  |
(3)实验B,乙中现象为
(4)实验A证明了镁粉与水能反应,该反应的化学方程式为
(5)使镁粉与水迅速反应并放热的最佳方法是向镁粉中加入
【反思改进】
(6)同学们分析实验数据发现,升高的温度没有达到食品加热袋的效果,原因可能是
(7)依据
 溶于水没有热量的变化的结论。
溶于水没有热量的变化的结论。(8)通过以上探究,你认为在日常生活中我们使用发热商品时要注意的问题是
您最近一年使用:0次






