1 . 利用碘量法测定某纯净水样中溶解 的含量,实验如下(加入的试剂已除去
的含量,实验如下(加入的试剂已除去 )。
)。
步骤1 水样中 的固定:用
的固定:用 的水瓶盛满水样,加入
的水瓶盛满水样,加入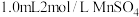 溶液,再加入含
溶液,再加入含 溶液和
溶液和 溶液的混合液
溶液的混合液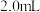 ,部分水样溢出,立即盖好瓶盖,翻转摇匀,生成白色沉淀
,部分水样溢出,立即盖好瓶盖,翻转摇匀,生成白色沉淀 ,随即有棕色沉淀
,随即有棕色沉淀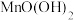 生成。
生成。
步骤2 生成 :当水样中的沉淀沉降到距瓶口三分之一以下时,缓缓加入适量稀
:当水样中的沉淀沉降到距瓶口三分之一以下时,缓缓加入适量稀 至液面下,部分溶液溢出,立即盖好瓶盖,翻转摇动,至沉淀完全溶解,得到黄色溶液。
至液面下,部分溶液溢出,立即盖好瓶盖,翻转摇动,至沉淀完全溶解,得到黄色溶液。
步骤3 测定及计算:用碘量法测出步骤2中生成的 为
为 ,进而计算出纯净水样中溶解
,进而计算出纯净水样中溶解 的含量。
的含量。
已知: 直接氧化
直接氧化 的反应速率很慢。
的反应速率很慢。
下列说法不正确 的是
 的含量,实验如下(加入的试剂已除去
的含量,实验如下(加入的试剂已除去 )。
)。步骤1 水样中
 的固定:用
的固定:用 的水瓶盛满水样,加入
的水瓶盛满水样,加入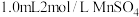 溶液,再加入含
溶液,再加入含 溶液和
溶液和 溶液的混合液
溶液的混合液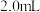 ,部分水样溢出,立即盖好瓶盖,翻转摇匀,生成白色沉淀
,部分水样溢出,立即盖好瓶盖,翻转摇匀,生成白色沉淀 ,随即有棕色沉淀
,随即有棕色沉淀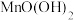 生成。
生成。步骤2 生成
 :当水样中的沉淀沉降到距瓶口三分之一以下时,缓缓加入适量稀
:当水样中的沉淀沉降到距瓶口三分之一以下时,缓缓加入适量稀 至液面下,部分溶液溢出,立即盖好瓶盖,翻转摇动,至沉淀完全溶解,得到黄色溶液。
至液面下,部分溶液溢出,立即盖好瓶盖,翻转摇动,至沉淀完全溶解,得到黄色溶液。步骤3 测定及计算:用碘量法测出步骤2中生成的
 为
为 ,进而计算出纯净水样中溶解
,进而计算出纯净水样中溶解 的含量。
的含量。已知:
 直接氧化
直接氧化 的反应速率很慢。
的反应速率很慢。下列说法
| A.步骤1中,用注射器加入试剂时应将细长针头插到液面下一定距离 |
B.步骤2中,生成 的反应: 的反应: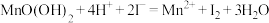 |
C.步骤2中,部分溶液溢出不影响测定纯净水样中溶解 的含量 的含量 |
D.步骤3中,经计算,该纯净水样中含有 的浓度为 的浓度为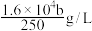 |
您最近半年使用:0次
名校
2 . 为测定草酸钴晶体(CoC2O4·2H2O)样品的纯度,某实验小组进行如下实验:
Ⅰ.取草酸钴晶体样品3.000 g,加稀H2SO4溶解,再加入100.00 mL 0.1000 mol/L酸性KMnO4溶液,充分反应至不再有CO2气体产生(常温下,草酸钴晶体难溶于水,该条件下Co2+不被氧化,杂质也不参与反应)。
Ⅱ.将溶液冷却,加水稀释定容至250 mL。
Ⅲ.取25.00 mL溶液,用0.1000 mol/L FeSO4标准溶液滴定。
Ⅳ.再重复步骤Ⅲ中的实验过程两次,三次的实验数据如表:
(1)步骤Ⅰ中加酸性KMnO4溶液时发生反应的离子方程式为______________ 。
(2)实验室使用的酸性KMnO4溶液一般是用________ 酸化(填酸的化学式)。
(3)步骤Ⅱ中,不会用到下列仪器中的_______ (填标号)。_______ (填“酸式”或“碱式”)滴定管;某次滴定中,开始时滴定管读数正确,结束时仰视,则所测草酸钴品体样品的纯度会_______ (填“偏大”“偏小”或“不变”)﹔某次实验中所有实验操作和读数均无误,所测草酸钴晶体样品的纯度的误差却偏小,则可能的原因是___________ 。
(5)草酸钴晶体样品的纯度为______ %。
Ⅰ.取草酸钴晶体样品3.000 g,加稀H2SO4溶解,再加入100.00 mL 0.1000 mol/L酸性KMnO4溶液,充分反应至不再有CO2气体产生(常温下,草酸钴晶体难溶于水,该条件下Co2+不被氧化,杂质也不参与反应)。
Ⅱ.将溶液冷却,加水稀释定容至250 mL。
Ⅲ.取25.00 mL溶液,用0.1000 mol/L FeSO4标准溶液滴定。
Ⅳ.再重复步骤Ⅲ中的实验过程两次,三次的实验数据如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗FeSO4溶液标准的体积/mL | 18.96 | 18.03 | 17.97 |
(1)步骤Ⅰ中加酸性KMnO4溶液时发生反应的离子方程式为
(2)实验室使用的酸性KMnO4溶液一般是用
(3)步骤Ⅱ中,不会用到下列仪器中的
a. 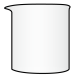 b.
b. 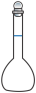 c.
c. 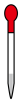 d.
d.
(5)草酸钴晶体样品的纯度为
您最近半年使用:0次
3 . 下列装置正确且能达到实验目的的是
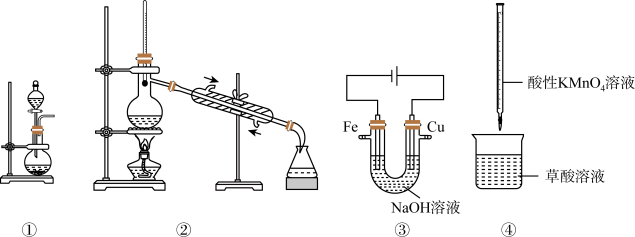
| A.装置①,利用浓盐酸和二氧化锰制备氯气 |
| B.装置②,分离丙酮和2-丙醇混合物 |
C.装置③,制备少量 |
D.装置④,利用已知浓度的酸性 溶液滴定草酸溶液 溶液滴定草酸溶液 |
您最近半年使用:0次
4 . 葡萄糖酸锌(Zn(C6H11O7)2)是目前最常用的补锌剂,某实验小组的同学查阅资料后,用以下两种方法合成了葡萄糖酸锌。回答下列问题:
Ⅰ.直接合成法
将一定量的ZnSO4·7H2O完全溶于水,在90℃水浴条件下逐渐加入一定量的葡萄糖酸钙,20分钟后趁热抽滤,滤液转移至仪器A中浓缩至粘稠状,冷却后加入95%的乙醇并不断搅拌,待沉淀转变为晶体状后抽滤得产品。
(1)仪器A的名称为___________ 。
(2)写出直接合成法生成葡萄糖酸锌的化学反应方程式___________ 。
(3)趁热抽滤所得滤渣为___________ (写化学式),趁热抽滤的目的是___________ 。
(4)此法所得产品中易有较多的 ,原因是
,原因是___________ 。
Ⅱ.间接合成法
①制备葡萄糖酸:向蒸馏水中加入少量浓硫酸,搅拌下分批加入一定量的葡萄糖酸钙,抽滤除去沉淀,滤液经离子交换树脂纯化后得无色高纯度的葡萄糖酸溶液。
②制备葡萄糖酸锌:取上述高纯溶液,加入一定的ZnO,60℃水浴充分反应后除去不溶物,向滤液中加入无水乙醇后用冰水浴冷却,有白色晶体析出,重结晶得纯度较高的葡萄糖酸锌。
(5)制备葡萄糖酸时常得到淡黄色滤液,可加入一定量___________ 进行物理脱色。
(6)重结晶步骤的具体操作为:将粗产品以温水溶解后,加入___________ ,过滤、洗涤、___________ ,称重。
(7)产品中锌含量测定:准确称取0.400g葡萄糖酸锌溶于20mL温水中,加入10mL缓冲溶液,4滴指示剂,用c mol/LEDTA标准溶液滴定至终点,平行测定三次,消耗标准溶液的平均值为V mL,计算产品中锌的质量分数为___________ %(已知锌离子与EDTA按物质的量之比1∶1反应)。
Ⅰ.直接合成法
将一定量的ZnSO4·7H2O完全溶于水,在90℃水浴条件下逐渐加入一定量的葡萄糖酸钙,20分钟后趁热抽滤,滤液转移至仪器A中浓缩至粘稠状,冷却后加入95%的乙醇并不断搅拌,待沉淀转变为晶体状后抽滤得产品。
(1)仪器A的名称为
(2)写出直接合成法生成葡萄糖酸锌的化学反应方程式
(3)趁热抽滤所得滤渣为
(4)此法所得产品中易有较多的
 ,原因是
,原因是Ⅱ.间接合成法
①制备葡萄糖酸:向蒸馏水中加入少量浓硫酸,搅拌下分批加入一定量的葡萄糖酸钙,抽滤除去沉淀,滤液经离子交换树脂纯化后得无色高纯度的葡萄糖酸溶液。
②制备葡萄糖酸锌:取上述高纯溶液,加入一定的ZnO,60℃水浴充分反应后除去不溶物,向滤液中加入无水乙醇后用冰水浴冷却,有白色晶体析出,重结晶得纯度较高的葡萄糖酸锌。
(5)制备葡萄糖酸时常得到淡黄色滤液,可加入一定量
(6)重结晶步骤的具体操作为:将粗产品以温水溶解后,加入
(7)产品中锌含量测定:准确称取0.400g葡萄糖酸锌溶于20mL温水中,加入10mL缓冲溶液,4滴指示剂,用c mol/LEDTA标准溶液滴定至终点,平行测定三次,消耗标准溶液的平均值为V mL,计算产品中锌的质量分数为
您最近半年使用:0次
5 . 氧钒(Ⅳ)碱式碳酸铵晶体{化学式为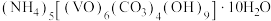 ,
,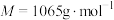 }是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
}是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:

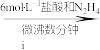
 溶液
溶液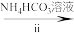 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体
已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)N2H4为二元弱碱,其在水中的电离过程与NH3类似,其第一步电离方程式为_____ ,第二步电离方程式为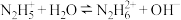 ;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:
;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:_____ 。
(2)步骤ii可通过如图装置完成。 的优点为
的优点为_____ ,检查其气密性的操作为_____ 。
②实验开始时,先打开_____ (填“K1”或“K2”)。
③盛装NH4HCO3溶液的仪器名称为_____ 。
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度。
实验步骤:粗产品wg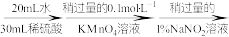
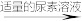
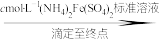 再重复实验两次。
再重复实验两次。
已知: 。
。
①滴入NaNO2溶液的目的是除去KMnO4,写出其反应的离子方程式:_____ 。
②若平均消耗cmol/L(NH4)2Fe(SO4)2标准溶液的体积为amL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为_____  。
。
③若其他操作均正确,但NaNO2的加入量不足,会引起测定结果_____ (填“偏大”“偏小”或“无影响”)。
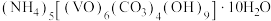 ,
,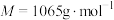 }是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
}是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
 溶液
溶液 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)N2H4为二元弱碱,其在水中的电离过程与NH3类似,其第一步电离方程式为
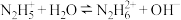 ;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:
;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:(2)步骤ii可通过如图装置完成。
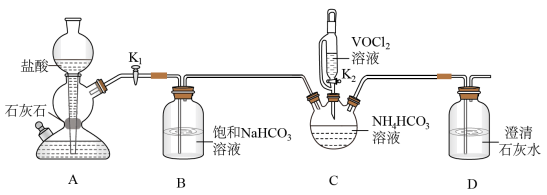
 的优点为
的优点为②实验开始时,先打开
③盛装NH4HCO3溶液的仪器名称为
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度。
实验步骤:粗产品wg
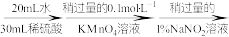
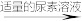
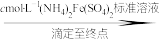 再重复实验两次。
再重复实验两次。已知:
 。
。①滴入NaNO2溶液的目的是除去KMnO4,写出其反应的离子方程式:
②若平均消耗cmol/L(NH4)2Fe(SO4)2标准溶液的体积为amL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为
 。
。③若其他操作均正确,但NaNO2的加入量不足,会引起测定结果
您最近半年使用:0次
6 . 钛酸钡( )因其优良的电学性能被广泛应用于多层陶瓷电容器(MLCC)等电子元器件。某同学以
)因其优良的电学性能被广泛应用于多层陶瓷电容器(MLCC)等电子元器件。某同学以 和高活性偏钛酸(
和高活性偏钛酸( )为原料,在实验室中采用低温固相法制备亚微米级钛酸钡粉体。
)为原料,在实验室中采用低温固相法制备亚微米级钛酸钡粉体。
已知:①氧化性: ;
; 。
。
②四氯化钛极易水解,易挥发。
I.制备偏钛酸(装置如图) 固体于三颈烧瓶中,加入浓盐酸配成
固体于三颈烧瓶中,加入浓盐酸配成 溶液,然后加水稀释转化成一定浓度的
溶液,然后加水稀释转化成一定浓度的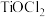 溶液,最后将装在仪器B中的氨水缓慢滴入
溶液,最后将装在仪器B中的氨水缓慢滴入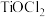 溶液中,搅拌,析出
溶液中,搅拌,析出 。反应过程中注意控制温度,以免反应过于剧烈。
。反应过程中注意控制温度,以免反应过于剧烈。
(1)仪器B的名称是_______ 。
(2)仪器A的作用是_______ ,冷凝水从_______ (填“a”或“b”)口通入。
(3)写出氨水与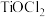 溶液反应产生
溶液反应产生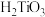 的化学方程式
的化学方程式_______ 。
Ⅱ.制备钛酸钡
将上述制得的作为反应原料,与按照物质的量之比为 混合后放入球磨罐中,放置于“罐磨机”上按照700r/min罐磨5h后倒入坩埚中,并置于烘箱中
混合后放入球磨罐中,放置于“罐磨机”上按照700r/min罐磨5h后倒入坩埚中,并置于烘箱中 反应3h,得到亚微米级白色钛酸钡样品粉体。
反应3h,得到亚微米级白色钛酸钡样品粉体。
(4)写出 与
与 反应的化学方程式
反应的化学方程式_______ 。
(5)在固相反应过程中,会经历“接触扩散—化学反应—成核—晶粒生长”的历程,则“罐磨机”的作用是_______ ,若想获得比亚微米级钛酸钡晶体更大颗粒的晶体,应置于_______ (填“<”或“>”)100℃的烘箱中反应3h。
Ⅲ.测定产品纯度
取 产品溶于稍过量的稀硫酸中配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量
产品溶于稍过量的稀硫酸中配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量 溶液,充分反应后,用
溶液,充分反应后,用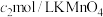 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。(
。( 的摩尔质量为Mg/mol)
的摩尔质量为Mg/mol)
(6)实验中所用滴定管为_______ (填“酸式”或“碱式”或“酸式和碱式”)滴定管。
(7)产品的纯度为_______ %。
 )因其优良的电学性能被广泛应用于多层陶瓷电容器(MLCC)等电子元器件。某同学以
)因其优良的电学性能被广泛应用于多层陶瓷电容器(MLCC)等电子元器件。某同学以 和高活性偏钛酸(
和高活性偏钛酸( )为原料,在实验室中采用低温固相法制备亚微米级钛酸钡粉体。
)为原料,在实验室中采用低温固相法制备亚微米级钛酸钡粉体。已知:①氧化性:
 ;
; 。
。②四氯化钛极易水解,易挥发。
I.制备偏钛酸(装置如图)

 固体于三颈烧瓶中,加入浓盐酸配成
固体于三颈烧瓶中,加入浓盐酸配成 溶液,然后加水稀释转化成一定浓度的
溶液,然后加水稀释转化成一定浓度的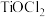 溶液,最后将装在仪器B中的氨水缓慢滴入
溶液,最后将装在仪器B中的氨水缓慢滴入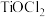 溶液中,搅拌,析出
溶液中,搅拌,析出 。反应过程中注意控制温度,以免反应过于剧烈。
。反应过程中注意控制温度,以免反应过于剧烈。(1)仪器B的名称是
(2)仪器A的作用是
(3)写出氨水与
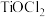 溶液反应产生
溶液反应产生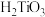 的化学方程式
的化学方程式Ⅱ.制备钛酸钡
将上述制得的作为反应原料,与按照物质的量之比为
 混合后放入球磨罐中,放置于“罐磨机”上按照700r/min罐磨5h后倒入坩埚中,并置于烘箱中
混合后放入球磨罐中,放置于“罐磨机”上按照700r/min罐磨5h后倒入坩埚中,并置于烘箱中 反应3h,得到亚微米级白色钛酸钡样品粉体。
反应3h,得到亚微米级白色钛酸钡样品粉体。(4)写出
 与
与 反应的化学方程式
反应的化学方程式(5)在固相反应过程中,会经历“接触扩散—化学反应—成核—晶粒生长”的历程,则“罐磨机”的作用是
Ⅲ.测定产品纯度
取
 产品溶于稍过量的稀硫酸中配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量
产品溶于稍过量的稀硫酸中配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量 溶液,充分反应后,用
溶液,充分反应后,用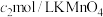 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。(
。( 的摩尔质量为Mg/mol)
的摩尔质量为Mg/mol)(6)实验中所用滴定管为
(7)产品的纯度为
您最近半年使用:0次
2024高三下·全国·专题练习
7 . 硫氰化钾( )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示: 不溶于水,密度比水的大;
不溶于水,密度比水的大;
② 不溶于
不溶于 ;
;
③三颈烧瓶内盛放有 、水和催化剂。
、水和催化剂。
回答下列问题:
制备 溶液:
溶液:
测定晶体中 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴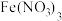 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。
(1)滴定时发生的反应: (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是_______ 。
(2)晶体中 的质量分数为
的质量分数为_______ (结果精确至0.1%)。
 )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示: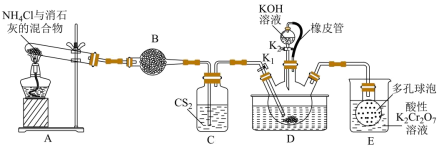
 不溶于水,密度比水的大;
不溶于水,密度比水的大;②
 不溶于
不溶于 ;
;③三颈烧瓶内盛放有
 、水和催化剂。
、水和催化剂。回答下列问题:
制备
 溶液:
溶液:测定晶体中
 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴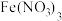 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。(1)滴定时发生的反应:
 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是(2)晶体中
 的质量分数为
的质量分数为
您最近半年使用:0次
2024高三下·全国·专题练习
8 .  作为绿色氧化剂应用广泛,氢醌法制备
作为绿色氧化剂应用广泛,氢醌法制备 原理及装置如下:
原理及装置如下: 、
、 等杂质易使
等杂质易使 催化剂中毒。回答下列问题:
催化剂中毒。回答下列问题:
(1)取 产品,加蒸馏水定容至
产品,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、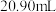 、
、 。假设其他杂质不干扰结果,产品中
。假设其他杂质不干扰结果,产品中 质量分数为
质量分数为_______ 。
 作为绿色氧化剂应用广泛,氢醌法制备
作为绿色氧化剂应用广泛,氢醌法制备 原理及装置如下:
原理及装置如下: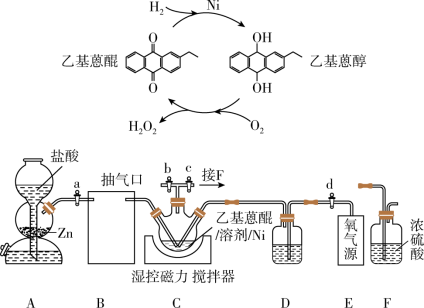
 、
、 等杂质易使
等杂质易使 催化剂中毒。回答下列问题:
催化剂中毒。回答下列问题:(1)取
 产品,加蒸馏水定容至
产品,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、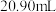 、
、 。假设其他杂质不干扰结果,产品中
。假设其他杂质不干扰结果,产品中 质量分数为
质量分数为
您最近半年使用:0次
9 . 工业上使用氯化粗五氧化二钒(杂质为Ti、Al的氧化物)的方法制备三氯氧钒( ),其装置如图所示(加热及夹持装置略)。已知:
),其装置如图所示(加热及夹持装置略)。已知: 熔点为−77℃,沸点为126℃,易水解(装置A为制备氯气的装置,未画出)。
熔点为−77℃,沸点为126℃,易水解(装置A为制备氯气的装置,未画出)。
(1)常温下,装置A中氯酸钾固体与浓盐酸发生反应,该反应中氧化剂和还原剂物质的量之比为________ ,装置A与实验室制取下列气体的装置相同的是________ (选填标号)。
a.铜与浓硫酸反应制二氧化硫 b.石灰石与盐酸反应制二氧化碳
c.熟石灰与氯化铵反应制氨气 d.过氧化钠和水反应制氧气
(2)装置C中盛装的试剂可以是________ ;实验开始先打开K,通入 一段时间后,加热
一段时间后,加热 装置,可产生一种还原性气体,则D装置中反应生成
装置,可产生一种还原性气体,则D装置中反应生成 的化学方程式为
的化学方程式为________ 。
(3)当D中反应结束后,停止加热,停止通氯气,此时杂质以氯化物的形式溶解在产物中,关闭开关K后,接下来进行的操作是________ (填操作名称)。
(4)装置H的作用为________ 。
(5)经检测,G所得的 中还含有
中还含有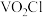 杂质,为测定其中
杂质,为测定其中 的质量分数,做如下实验:
的质量分数,做如下实验:
①取下锥形瓶,称量产品和锥形瓶的质量为 ;
;
②加入超纯水形成钒溶液,再向该钒溶液中加入氨水, 和
和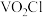 都会与氨水反应产生
都会与氨水反应产生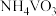 沉淀和
沉淀和 ;
;
③过滤洗涤后,将洗涤液与滤液合并后配制成250mL溶液,取25mL用浓度为 的
的 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 溶液
溶液 ;
;
④将锥形瓶洗涤干燥后称量其质量为 。
。
则 的质量分数表达式为
的质量分数表达式为________ ,下列情况会导致 的质量分数偏低的是
的质量分数偏低的是________ (选填标号)。
a.操作③过滤洗涤后,未将洗涤液与滤液合并
b.产品中残留少量 杂质
杂质
c.滴定读取标准液数据时,开始仰视,结束俯视
 ),其装置如图所示(加热及夹持装置略)。已知:
),其装置如图所示(加热及夹持装置略)。已知: 熔点为−77℃,沸点为126℃,易水解(装置A为制备氯气的装置,未画出)。
熔点为−77℃,沸点为126℃,易水解(装置A为制备氯气的装置,未画出)。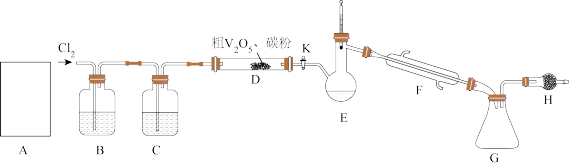
(1)常温下,装置A中氯酸钾固体与浓盐酸发生反应,该反应中氧化剂和还原剂物质的量之比为
a.铜与浓硫酸反应制二氧化硫 b.石灰石与盐酸反应制二氧化碳
c.熟石灰与氯化铵反应制氨气 d.过氧化钠和水反应制氧气
(2)装置C中盛装的试剂可以是
 一段时间后,加热
一段时间后,加热 装置,可产生一种还原性气体,则D装置中反应生成
装置,可产生一种还原性气体,则D装置中反应生成 的化学方程式为
的化学方程式为(3)当D中反应结束后,停止加热,停止通氯气,此时杂质以氯化物的形式溶解在产物中,关闭开关K后,接下来进行的操作是
(4)装置H的作用为
(5)经检测,G所得的
 中还含有
中还含有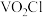 杂质,为测定其中
杂质,为测定其中 的质量分数,做如下实验:
的质量分数,做如下实验:①取下锥形瓶,称量产品和锥形瓶的质量为
 ;
;②加入超纯水形成钒溶液,再向该钒溶液中加入氨水,
 和
和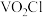 都会与氨水反应产生
都会与氨水反应产生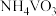 沉淀和
沉淀和 ;
;③过滤洗涤后,将洗涤液与滤液合并后配制成250mL溶液,取25mL用浓度为
 的
的 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 溶液
溶液 ;
;④将锥形瓶洗涤干燥后称量其质量为
 。
。则
 的质量分数表达式为
的质量分数表达式为 的质量分数偏低的是
的质量分数偏低的是a.操作③过滤洗涤后,未将洗涤液与滤液合并
b.产品中残留少量
 杂质
杂质c.滴定读取标准液数据时,开始仰视,结束俯视
您最近半年使用:0次
10 . 碘是生物必需的一种微量元素,海带、海藻等食物含碘量最为丰富。某小组通过实验提取并测定干海带中碘的含量。回答下列问题:
Ⅰ.从海带中提取碘。
该小组同学按如图实验流程进行实验。
干海带 海带灰
海带灰 海带浸出液
海带浸出液 的水溶液
的水溶液
(1)步骤i中需要用到含硅酸盐材质的仪器有________ (填仪器名称)。________ (用离子方程式表示)。
Ⅱ.滴定法测海带中碘的含量。
用 滴定
滴定 的水溶液,淀粉溶液作指示剂。原理为
的水溶液,淀粉溶液作指示剂。原理为 。
。
(3)用酸式滴定管量取 的水溶液时常需要排出气泡,操作是
的水溶液时常需要排出气泡,操作是________ 。
(4)小组同学进行了实验测定,在滴定终点附近,反复变回蓝色,一直测不到终点。
待测液 无色
无色 蓝色
蓝色 无色
无色 蓝色……
蓝色……
①提出猜想
猜想1:碘离子被________ 氧化。
猜想2:碘离子被步骤iii中过量的 氧化。
氧化。
②验证猜想
③查阅资料 小组同学认为可能是反应速率不同造成的, 氧化
氧化 的速率
的速率________ (填“快于”或“慢于”) 还原
还原 的速率,导致待测液反复变为蓝色。
的速率,导致待测液反复变为蓝色。
④优化设计 鉴于反应终点无法到达的问题,请提出合理的修正方案:________ 。
⑤完成实验 小组同学修正方案后,取5.000g干海带进行测定,消耗 溶液﹐则干海带中碘的含量为
溶液﹐则干海带中碘的含量为________  (保留2位有效数字)。
(保留2位有效数字)。
Ⅰ.从海带中提取碘。
该小组同学按如图实验流程进行实验。
干海带
 海带灰
海带灰 海带浸出液
海带浸出液 的水溶液
的水溶液(1)步骤i中需要用到含硅酸盐材质的仪器有
Ⅱ.滴定法测海带中碘的含量。
用
 滴定
滴定 的水溶液,淀粉溶液作指示剂。原理为
的水溶液,淀粉溶液作指示剂。原理为 。
。(3)用酸式滴定管量取
 的水溶液时常需要排出气泡,操作是
的水溶液时常需要排出气泡,操作是(4)小组同学进行了实验测定,在滴定终点附近,反复变回蓝色,一直测不到终点。
待测液
 无色
无色 蓝色
蓝色 无色
无色 蓝色……
蓝色……①提出猜想
猜想1:碘离子被
猜想2:碘离子被步骤iii中过量的
 氧化。
氧化。②验证猜想
序号 | 实验操作 | 实验现象 | 结论 |
1 | 取少量原海带浸出液﹐加入硫酸酸化,再滴加几滴淀粉溶液,鼓入空气 | 待测液始终保持无色 | 猜想1不成立 |
2 | 将 溶液、2滴 溶液、2滴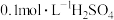 溶液、2滴淀粉溶液和1滴 溶液、2滴淀粉溶液和1滴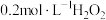 溶液混合配制待测液,用 溶液混合配制待测液,用 溶液滴定 溶液滴定 | 猜想2不成立 |
 氧化
氧化 的速率
的速率 还原
还原 的速率,导致待测液反复变为蓝色。
的速率,导致待测液反复变为蓝色。④优化设计 鉴于反应终点无法到达的问题,请提出合理的修正方案:
⑤完成实验 小组同学修正方案后,取5.000g干海带进行测定,消耗
 溶液﹐则干海带中碘的含量为
溶液﹐则干海带中碘的含量为 (保留2位有效数字)。
(保留2位有效数字)。
您最近半年使用:0次



