解题方法
1 . 现有一种以 为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的
为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的 和Pt进行回收。
和Pt进行回收。 不溶于硝酸。请回答下列问题:
不溶于硝酸。请回答下列问题:
(1)步骤I中将废催化剂焙烧的目的是___________ 。
(2)操作Ⅳ的名称是___________ ;检验废渣洗净的方法是___________ 。
(3)步骤Ⅲ中氧化剂是 ,反应后Pt转化成
,反应后Pt转化成 ,每生成1mol
,每生成1mol ,需要消耗H+的量为
,需要消耗H+的量为___________ mol。该步骤中有氯气生成,其离子方程式为___________ 。
(4)步骤V中,在适当酸度下,树脂上发生: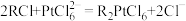 ,
, 吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用
吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用___________ (填化学式)淋洗。
(5)步骤Ⅵ中生成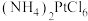 沉淀,将该沉淀在
沉淀,将该沉淀在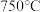 下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式
下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式___________ 。
 为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的
为载体的废旧催化剂,表面积碳且被有机物覆盖,含少量金属银。某实验室设计以下流程拟对废旧催化剂中的 和Pt进行回收。
和Pt进行回收。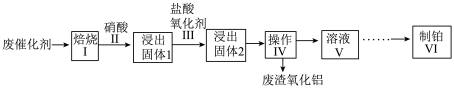
 不溶于硝酸。请回答下列问题:
不溶于硝酸。请回答下列问题:(1)步骤I中将废催化剂焙烧的目的是
(2)操作Ⅳ的名称是
(3)步骤Ⅲ中氧化剂是
 ,反应后Pt转化成
,反应后Pt转化成 ,每生成1mol
,每生成1mol ,需要消耗H+的量为
,需要消耗H+的量为(4)步骤V中,在适当酸度下,树脂上发生:
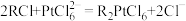 ,
, 吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用
吸附在树脂上得以富集,饱和后的树脂用碱液淋洗后得到含铂溶液,而要使树脂再生能重复使用,最好使用(5)步骤Ⅵ中生成
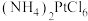 沉淀,将该沉淀在
沉淀,将该沉淀在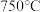 下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式
下煅烧生成铂和三种气体,其中一种气体是空气中的主要成份之一。请写出该反应的化学反应方程式
您最近一年使用:0次
名校
解题方法
2 . 物质的类别和核心元素的化合价是研究物质性质的两个重要维度,下图为硫、氮两种元素的“价-类二维图”。请回答下列问题:___________ (选填“硫”或“氮”)元素及其化合物。图中“g→h→i→j→k”和“a→b→c→d→e”的转化中,反应___________ (用字母表示)是非氧化还原反应。
(2)书写下列物质转化过程的化学方程式:
①“h→g”___________ ;②“g→i”___________ ;③“e→c”(e只体现强氧化性)___________ 。
(3)蘸有k的浓溶液的玻璃棒靠近蘸有g的浓溶液的玻璃棒,看到的现象是___________ ;生成物中含有的化学键有___________ ,氮的质量分数为___________ 。
(4)写出检验盐“l”中正离子的方法(要包含试剂、操作、现象、结论)___________ 。
(5)将i和j的混合气体15mL通入水中,可收集到同温同压下的气体7mL,被氧化的j有___________。

(2)书写下列物质转化过程的化学方程式:
①“h→g”
(3)蘸有k的浓溶液的玻璃棒靠近蘸有g的浓溶液的玻璃棒,看到的现象是
(4)写出检验盐“l”中正离子的方法(要包含试剂、操作、现象、结论)
(5)将i和j的混合气体15mL通入水中,可收集到同温同压下的气体7mL,被氧化的j有___________。
| A.12mL | B.8mL | C.6mL | D.4mL |
您最近一年使用:0次
3 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:___________ 性。从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小明认为可能是___________ 。小王觉得可以设计实验验证这一推论,具体操作是___________ 。
(3)配平下列反应:___________ 。
___________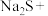 ___________
___________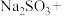 ___________
___________ ___________
___________ ___________
___________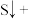 ___________
___________
(4)一种铁基脱硫剂脱除硫化氢( )的方法包括吸收和再生两个阶段,其工艺流程原理如下:
)的方法包括吸收和再生两个阶段,其工艺流程原理如下:___________ 写出“再生”的反应的离子方程式:___________ 。
②当吸收224 mL(标准状况) 时,若要保持脱硫液中
时,若要保持脱硫液中 的物质的量不变,则所通入的氧气的体积为
的物质的量不变,则所通入的氧气的体积为___________ mL。

(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小明认为可能是
(3)配平下列反应:
___________
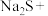 ___________
___________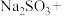 ___________
___________ ___________
___________ ___________
___________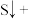 ___________
___________
(4)一种铁基脱硫剂脱除硫化氢(
 )的方法包括吸收和再生两个阶段,其工艺流程原理如下:
)的方法包括吸收和再生两个阶段,其工艺流程原理如下:
②当吸收224 mL(标准状况)
 时,若要保持脱硫液中
时,若要保持脱硫液中 的物质的量不变,则所通入的氧气的体积为
的物质的量不变,则所通入的氧气的体积为
您最近一年使用:0次
4 . 无机物 均为短周期元素组成的物质,且均含有同种元素,其中
均为短周期元素组成的物质,且均含有同种元素,其中 是最简单氢化物、
是最简单氢化物、 是单质;上述物质在一定条件下可以发生如下转化。
是单质;上述物质在一定条件下可以发生如下转化。
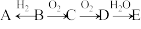
(1)若 为强碱,则A的电子式为
为强碱,则A的电子式为___________ 。
(2)若 为强酸,D在标准状况下是白色固体,则:
为强酸,D在标准状况下是白色固体,则:
① 的浓溶液与炭反应的化学方程式
的浓溶液与炭反应的化学方程式___________ 。
②实验室检验 的酸根离子的方法是
的酸根离子的方法是___________ 。
(3)若 为强酸,且
为强酸,且 和
和 可以发生反应生成一种盐
可以发生反应生成一种盐 ,则:
,则:
① 为
为___________ 。
②工业上制备C的化学方程式___________ 。
 均为短周期元素组成的物质,且均含有同种元素,其中
均为短周期元素组成的物质,且均含有同种元素,其中 是最简单氢化物、
是最简单氢化物、 是单质;上述物质在一定条件下可以发生如下转化。
是单质;上述物质在一定条件下可以发生如下转化。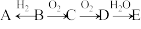
(1)若
 为强碱,则A的电子式为
为强碱,则A的电子式为(2)若
 为强酸,D在标准状况下是白色固体,则:
为强酸,D在标准状况下是白色固体,则:①
 的浓溶液与炭反应的化学方程式
的浓溶液与炭反应的化学方程式②实验室检验
 的酸根离子的方法是
的酸根离子的方法是(3)若
 为强酸,且
为强酸,且 和
和 可以发生反应生成一种盐
可以发生反应生成一种盐 ,则:
,则:①
 为
为②工业上制备C的化学方程式
您最近一年使用:0次
5 . 阅读信息,回答以下问题
Ⅰ.硫、氮元素是高中化学学习的两种重要非金属元素,其价类二维图分别如图所示:______ 。
(2)a与 发生反应的化学方程式:
发生反应的化学方程式:______ 。
(3)氨气是工业制硝酸的重要原料,写出①反应的化学方程式______ 。
(4)关于氮及其化合物的说法错误的是______。
Ⅱ.根据图示,回答以下问题:______ ;B的分子式为______ 。
(6)C物质颜色为______ ;将E溶于水配制成0.1 的溶液,滴入酚酞后呈现的颜色为
的溶液,滴入酚酞后呈现的颜色为______ 色。
(7)D→B的化学方程式为:______ 。
(8)A→B的化学方程式为:______ 。
Ⅰ.硫、氮元素是高中化学学习的两种重要非金属元素,其价类二维图分别如图所示:

(2)a与
 发生反应的化学方程式:
发生反应的化学方程式:(3)氨气是工业制硝酸的重要原料,写出①反应的化学方程式
(4)关于氮及其化合物的说法错误的是______。
| A.氮气分子结构稳定,常做保护气,不支持任何物质燃烧 |
B.NO、 均为大气污染气体,在大气中均可稳定存在 均为大气污染气体,在大气中均可稳定存在 |
C.可用浓盐酸检测输送 的管道是否发生泄漏 的管道是否发生泄漏 |
D. 具有强氧化性,可溶解铜、银等不活泼金属 具有强氧化性,可溶解铜、银等不活泼金属 |
Ⅱ.根据图示,回答以下问题:

(6)C物质颜色为
 的溶液,滴入酚酞后呈现的颜色为
的溶液,滴入酚酞后呈现的颜色为(7)D→B的化学方程式为:
(8)A→B的化学方程式为:
您最近一年使用:0次
解题方法
6 . 如图是由常见元素组成的一些单质及其化合物之间的转化关系图。常温常压下,B、E、F、H、I均为气体,F无色无味且能使澄清石灰水变浑浊;B、E、I均有刺激性气味,E能使湿润的红色石蕊试纸变蓝,B、E在空气中相遇会产生白烟,I为红棕色。A是一种常见的肥料。C、G、K的焰色试验呈黄色(反应中生成的部分物质已略去)。
(1)物质F的化学式为______ ,D物质的电子式________ 。
(2)写出反应D→B+E 的化学方程式:_______ 。
(3)写出反应④的离子方程式:_____ 。
(4)写出反应E→H 的化学方程式,并标出电子转移的方向和数目:_____ 。
(5)为避免硝酸生产尾气中的氮氧化物污染环境,人们开发了溶液吸收、催化还原等尾气处理方法。现可以使用 或其他物质将氮氧化物还原为
或其他物质将氮氧化物还原为 。请以尾气中的
。请以尾气中的 处理为例,写出相关反应的化学方程式
处理为例,写出相关反应的化学方程式_______ 。

(1)物质F的化学式为
(2)写出反应D→B+E 的化学方程式:
(3)写出反应④的离子方程式:
(4)写出反应E→H 的化学方程式,并标出电子转移的方向和数目:
(5)为避免硝酸生产尾气中的氮氧化物污染环境,人们开发了溶液吸收、催化还原等尾气处理方法。现可以使用
 或其他物质将氮氧化物还原为
或其他物质将氮氧化物还原为 。请以尾气中的
。请以尾气中的 处理为例,写出相关反应的化学方程式
处理为例,写出相关反应的化学方程式
您最近一年使用:0次
名校
7 . 实验室可用下列装置(部分夹持仪器略去)制取SO2并验证其性质。_______ ,则气密性良好。
(2)装置A中反应的化学方程式为_______ 。
(3)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有_______ (填“还原性”、“氧化性”或“漂白性”);经测定,产物中含有一种摩尔质量为104g/mol的盐,该盐的化学式为_______ 。
(4)试管D中反应的离子方程式为_______ 。
(5)实验结束时,关闭止水夹K,装置B的作用是_______ 。
(6)用图所示装置验证H2SO3酸性比H2CO3强。_______ ,Y为_______ ,Z为_______ 。
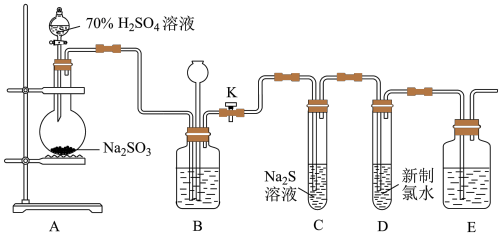
(2)装置A中反应的化学方程式为
(3)实验时,通气一段时间后,C中试管中出现大量淡黄色浑浊现象,证明二氧化硫具有
(4)试管D中反应的离子方程式为
(5)实验结束时,关闭止水夹K,装置B的作用是
(6)用图所示装置验证H2SO3酸性比H2CO3强。
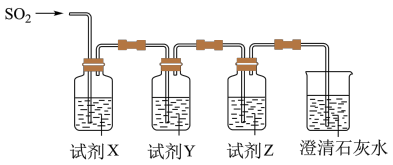
您最近一年使用:0次
名校
解题方法
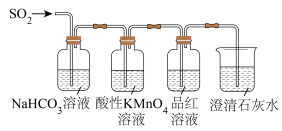
8 . 某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。________ 。
(2)当观察到________ ,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知:浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
(3)上述实验中,铁丝绕成螺旋状的目的是________ 。
(4)实验1中,铁与稀硫酸反应的离子方程式为________ 。
(5)实验2中的现象常被称为________ 。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。________ ;检测装置A的溶液中含有Fe3+的试剂是_______ 。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有________ 。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。
(2)当观察到
Ⅱ.研究铁与硫酸的反应。
已知:浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
| 实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
| 2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是
(4)实验1中,铁与稀硫酸反应的离子方程式为
(5)实验2中的现象常被称为
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。
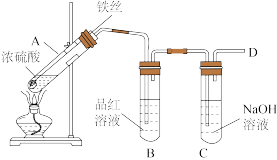
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有
您最近一年使用:0次
名校
解题方法
9 . 地球上既有辽阔的海洋也有浩瀚的沙漠。
(1)“从沙滩到用户”的关键第一步反应是利用石英砂可以制备粗硅,其反应的方程式为______ ;
(2)下图的实验装置中,在试管C中观察到凝胶状的白色沉淀。反应的化学方程式为______ 。______ 。有同学依据以上实验得出以下一些结论,其中正确的是______ (填序号)。
A.物质的酸性:
B.元素的非金属性:Cl>C>Si
C.试管B中饱和 溶液的主要作用是除去
溶液的主要作用是除去 气体中温有的HCl
气体中温有的HCl
D.在试管B中发生反应的离子方程式为:
(3)硅酸钠溶液是一种粘稠的液体,这与硅酸根离子的长键结构有关: 溶液,发现有丁达尔现象。依据胶体微粒大小对其中所含原子数的估算,胶体微粒中大约会含有
溶液,发现有丁达尔现象。依据胶体微粒大小对其中所含原子数的估算,胶体微粒中大约会含有 个原子。假设硅酸钠溶液中硅酸根离子含有1000个原子,那么在硅酸根离子的长链中,包含有
个原子。假设硅酸钠溶液中硅酸根离子含有1000个原子,那么在硅酸根离子的长链中,包含有______ 个硅氧四面体的结构单元。
(1)“从沙滩到用户”的关键第一步反应是利用石英砂可以制备粗硅,其反应的方程式为
(2)下图的实验装置中,在试管C中观察到凝胶状的白色沉淀。反应的化学方程式为

A.物质的酸性:

B.元素的非金属性:Cl>C>Si
C.试管B中饱和
 溶液的主要作用是除去
溶液的主要作用是除去 气体中温有的HCl
气体中温有的HClD.在试管B中发生反应的离子方程式为:

(3)硅酸钠溶液是一种粘稠的液体,这与硅酸根离子的长键结构有关:
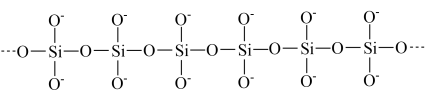
 俯视为
俯视为 简化为
简化为 连成长链
连成长链
 溶液,发现有丁达尔现象。依据胶体微粒大小对其中所含原子数的估算,胶体微粒中大约会含有
溶液,发现有丁达尔现象。依据胶体微粒大小对其中所含原子数的估算,胶体微粒中大约会含有 个原子。假设硅酸钠溶液中硅酸根离子含有1000个原子,那么在硅酸根离子的长链中,包含有
个原子。假设硅酸钠溶液中硅酸根离子含有1000个原子,那么在硅酸根离子的长链中,包含有
您最近一年使用:0次
名校
解题方法
10 . A~G的转化关系如图1所示(部分产物略去),其中E为红棕色气体,G为单质。常温下,将Al片浸在不同质量分数的C溶液中,经过相同时间的腐蚀后,Al片的质量损失情况如图2所示。
(1)写出下列物质的化学式:A___________ 、E___________ 。
(2)反应④、⑤的化学方程式:④___________ 、⑤___________ 。
(3)图2中Al质量损失随C溶液质量分数的变化先增大后减小,减小的原因为___________ 。
(4)足量Al与一定浓度的C反应,得到H溶液和D、E的混合物,这些混合物与1.68LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成C.若向所得H溶液中加入5mol/LNaOH溶液至Al3+恰好完全沉淀,则消耗NaOH溶液的体积是___________ mL。
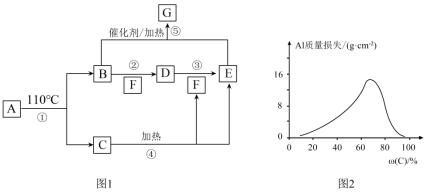
(1)写出下列物质的化学式:A
(2)反应④、⑤的化学方程式:④
(3)图2中Al质量损失随C溶液质量分数的变化先增大后减小,减小的原因为
(4)足量Al与一定浓度的C反应,得到H溶液和D、E的混合物,这些混合物与1.68LO2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成C.若向所得H溶液中加入5mol/LNaOH溶液至Al3+恰好完全沉淀,则消耗NaOH溶液的体积是
您最近一年使用:0次




